EphB4抑制早产大鼠视网膜病变新生血管的实验研究
2022-09-20陈晓隆张玉强
李 游,陈晓隆,张玉强
(1.爱尔眼科医院集团锦州爱尔眼科医院,辽宁锦州 121001;2.中国医科大学附属盛京医院眼科,沈阳 110004;3.锦州医科大学骨科研究所,辽宁锦州 121001)
在早产儿视网膜病变的患者中,视网膜新生血管大量增殖可导致出血,牵拉视网膜可导致裂孔及脱离,严重者可永久致盲[1],由此带来的各种问题越来越引起人们的重视。目前已知与早产儿视网膜病变的视网膜新生血管形成有关的因素有很多,但新生血管的增殖机制非常复杂[1-2],仍有许多未知因素无确切结论。因此,本课题组从基因角度入手,进一步研究早产儿视网膜病变的治疗方案。RTK信号通路是生成新生血管的机制之一[3],其中促红细胞生成肝细胞激酶(Eph)/促红细胞生成肝细胞激酶受体相互作用蛋白(Ephrin)系统传递血管内皮生长因子(VEGF)/血管内皮细胞生长因子受体(VEGFR)和内皮细胞TEK酪氨酸激酶(Tie)定位信号,其在血管形成中影响血管内皮细胞的增殖,控制新生血管发展[4],EphB4/EphrinB2在视网膜新生血管的形成和增殖中起到了重要的作用。因此,本课题组拟建立SD大鼠氧诱导视网膜病变模型来模拟人类早产儿视网膜病变,研究视网膜新生血管增殖过程中EphB4/EphrinB2表达的变化,观察玻璃体腔内注射EphB4能否抑制或减少视网膜新生血管的生成,现报道如下。
1 材料与方法
1.1 材料
20只健康SD孕鼠购于锦州医科大学实验动物中心,待新生幼鼠7 d龄时进行建模和实验。
1.2 方法
1.2.1SD大鼠视网膜病变模型的建立
80只7 d龄SD大鼠分为4组:模型组、干预组和对照组和正常组,每组20只。将模型组置于氧浓度75%的密闭舱内5 d后回到正常室内环境中,建立视网膜病变模型[2];干预组建立视网膜病变模型并于出仓后(12 d)玻璃体腔注射EphB4 1 μL(美国VasGene Therapeutics公司);对照组幼鼠同样建立视网膜病变模型,于12 d玻璃体腔注射生理盐水1 μL;正常组置于正常空气中常规饲养。各组分别于17 d处死并取材。
1.2.2组织的制备
腹腔注射3 g/kg水合氯醛处死大鼠,取双眼。将右眼一部分制作成视网膜铺片进行ADP酶染色,另一部分做冰冻切片进行EphB4/Ephrin免疫荧光检测。左眼视网膜组织集中冷冻保存,用于实时荧光定量PCR检测EphB4 mRNA。
1.2.3视网膜铺片的制作及ADP酶染色
摘取的SD幼鼠眼球在4%多聚甲醛中充分固定,手术显微镜下仔细分离出视网膜和脉络膜,用0.05 mol/L马来酸缓冲液冲洗,在37 ℃的ADP培养液中培养15 min,磷酸盐缓冲液(PBS)彻底清洗,10%硫酸铵着色,甘油明胶密封,显微镜下观察视网膜血管的形态和分布[2]。
1.2.4EphB4/EphrinB2蛋白的免疫荧光双标检测
制作视网膜冰冻切片。山羊血清封闭后加入一抗EphB4及EphrinB2多克隆抗体,4 ℃冷藏过夜后加入Cy3和荧光素钠标记的二抗IgG,暗盒内室温静置90 min,加入DAPI暗盒内室温静置5 min,充分洗涤,甘油明胶密封,遮光,激光共聚焦显微镜下观察EphB4/EphrinB2蛋白在视网膜的分布和表达情况[2]。
1.2.5EphB4 mRNA的实时荧光定量PCR检测
根据EphB4和内参β-actin的mRNA序列合成所需引物。先提取出视网膜组织中EphB4和内参β-actin的总RNA,将总RNA逆转录成cDNA的第一链,进行PCR扩增反应,绘制溶解曲线[1]。计算各组EphB4 mRNA的相对表达水平,进行统计[2]。
1.3 统计学处理
2 结 果
2.1 视网膜新生血管的观察
新生血管呈毛刷状或团簇状,而正常血管呈树枝状走形,二者有明显不同的形态。模型组和对照组视网膜血管迂曲扩张,可见大量的新生血管分布及眼底片状出血;干预组视网膜血管树枝状走向,形态良好,有少量新生血管;正常组血管发育良好,见图1。
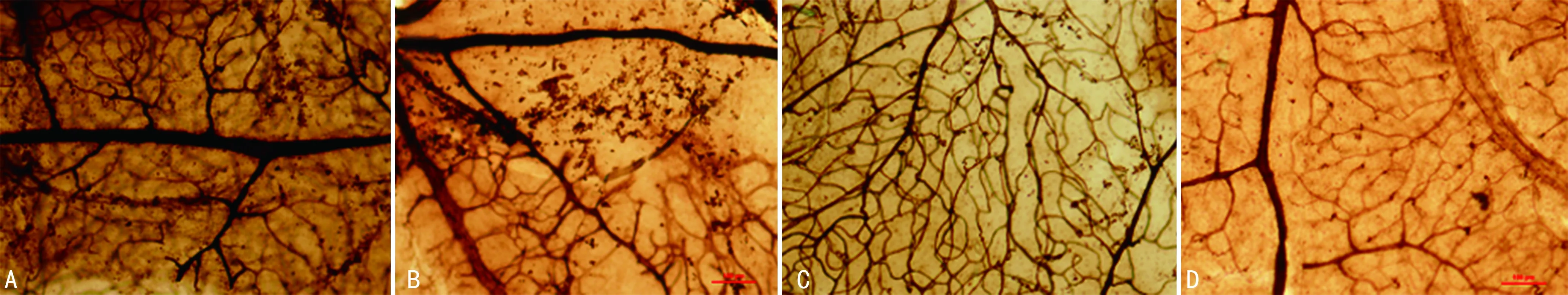
A:模型组;B:对照组;C:干预组;D:正常组。
2.2 视网膜中EphB4和EphrinB2蛋白的表达
激光共聚焦显微镜下可以清晰地观察到视网膜各层的组织形态,EphB4和EphrinB2大量表达于视网膜新生血管生成区,且图像重合后发现EphB4的红色荧光与EphrinB2的绿色荧光聚集在视网膜新生血管生成区互相重合呈黄色。细胞核染色为蓝色荧光。正常组少量表达EphB4和EphrinB2,模型组和对照组大量表达EphB4和EphrinB2,干预组EphB4和EphrinB2的荧光染色亮度明显弱于模型组和对照组,见图2。
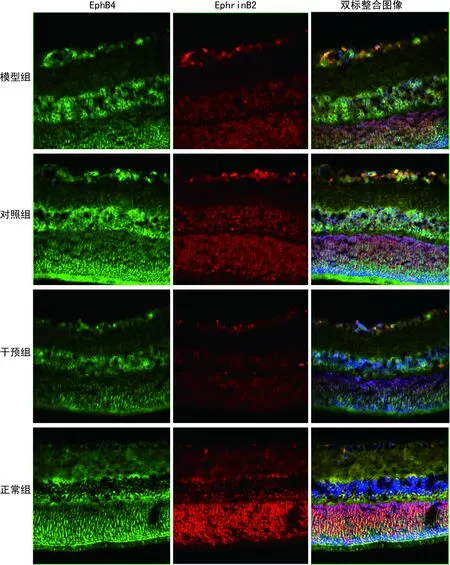
图2 SD大鼠视网膜EphB4/EphrinB2蛋白的免疫荧光双标染色(200×)
2.3 大鼠视网膜实时荧光定量PCR结果
EphB4 mRNA在模型组视网膜的相对表达水平为0.87±0.11,而正常组为0.19±0.03,两组比较差异有统计学意义(P<0.05)。EphB4 mRNA在干预组视网膜的相对表达水平为0.25±0.04,明显低于模型组及对照组(0.96±0.13),差异有统计学意义(P<0.05),见图3。
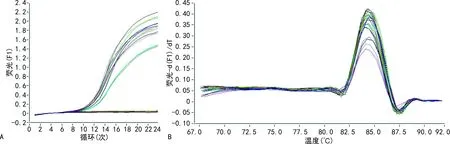
A:扩增曲线;B:溶解曲线。
3 讨 论
早产儿视网膜病变是一个非常复杂的病理过程。视网膜的新生血管没有发育完全,容易破裂出血和机化,形成机化膜后会牵拉视网膜发生裂孔,造成视网膜脱离,手术很难完全恢复视力。视网膜要形成新的血管,EphrinB配体及其同源Eph受体是最重要的导向分子之一,在信号传输中起着重要作用[6]。EphrinB2配体及其受体EphB4已被证明在动脉和静脉内皮细胞中均有特异表达,传递血管内皮细胞之间的双向信号,并控制胚胎中的心血管内皮细胞的生长和连接[7]。内皮特异性EphrinB2缺失导致血管形态发生缺陷。相反,功能性EphrinB2表达已被证明在出生后新生血管形成中促进动脉和静脉血管之间的相互作用[8]。在血管重塑过程中,EphrinB2的表达增强了血管修剪和周细胞对内皮组装的影响[9],参与了视网膜血管的形成。
有研究表明,玻璃体腔注射可溶性EphB4-Fc、EphrinB2或可溶性EphB4能抑制大鼠视网膜血管的形成[10]。同时,EphB4和EphrinB2也存在于在动脉和静脉血管丛,以及血管网的深层[11],EphB4在大鼠视网膜新生血管中的作用主要表现为视网膜浅静脉的血管生成及连接,在视网膜血管发育过程中也大量存在[9]。研究结果表明,EphB2-Fc激活EphrinB2可明显增强血管生成[12]。在小鼠胚胎细胞中敲除EphrinB2结合的PDZ区后发现,视网膜血管内皮细胞形成丝状伪足的能力明显降低,相互连接不紧密,易形成发育不完全的新生血管[13-14]。用EphrinB2抗体治疗后,血管内皮细胞骨架的动态变化达到平衡,血管形态多态性下降,更趋于环状,表明EphB4/EphrinB2是影响血管内皮细胞功能的重要因素之一,是治疗视网膜新生血管的有效靶点[15]。
综上所述,Eph/Ephrin RTK系统的复杂性、多方面性和普遍性正应用于各种复杂的分子、细胞研究。这是一个新的和快速增长的研究领域,因为它们影响一系列细胞行为和生物过程,因此,在治疗人类疾病方面具有巨大的潜力。Eph/Ephrin信号通路可以作为调节血管新生的靶点抑制视网膜新生血管的形成,本研究通过注射EphB4调节视网膜病变中视网膜EphB4/EphrinB2的活性,观察了EphrinB2表达的改变及对新生血管生成的影响,为治疗视网膜新生血管提供新的理论依据和治疗策略。
