严重冠状动脉左主干病变并Graves病1例报道并文献复习
2022-09-20周帝伶郑惠娟朱章志
周帝伶,郑惠娟,朱章志
(1.广州中医药大学,广州 510405;2.广州中医药大学第一附属医院,广州 510405)
1 临床资料
患者,女,51岁,因“反复胸闷痛3 d,加重3 h”于2021年1月16日至广州中医药大学第一附属医院就诊。入院前3 d患者反复胸闷、胸痛,疼痛可向咽部放射,每次持续约4 min自行缓解,未予重视及系统治疗。3 h前再次出现心前区闷痛不适,疼痛程度较前明显加重,遂就诊。既往Graves病史10余年,规律服用甲巯咪唑治疗2年后停药,后未复查甲状腺功能,偶有心悸不适,未予重视。否认其他病史。月经规律来潮,过敏史、个人史、婚育史、家族史无特殊。急诊查心电图提示:窦性心律,AVR导联、V1导联ST段抬高,AVR导联ST段抬高幅度大于V1导联,V2~V6导联和Ⅰ、Ⅱ、AVL导联ST段压低。考虑急性心肌梗死(左主干病变)。
给予阿司匹林300 mg+氯吡格雷片300 mg抗血小板聚集,行急诊经皮冠状动脉介入治疗(PCI)术。术中见:冠状动脉成左优势型。左主干开口狭窄约95%,左前降支近段局限性狭窄约30%,远段血流通畅,TIMI 3级;左旋支血管未见狭窄,右冠状动脉开口狭窄60%~70%,血流通畅(见图1A)。行主动脉内球囊反搏术+药物洗脱冠状动脉支架植入术,沿Runthrough导丝于左主干开口处至左前降支近段成功植入吉威4 mm×24 mm支架,造影显示左主干血流通畅,开口狭窄闭塞消失,远端TIMI 3级(见图1B、C)。
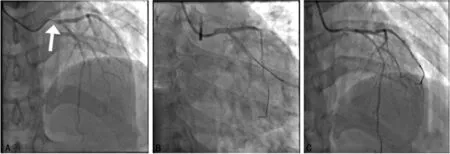
A:左主干开口狭窄约95%;B、C:支架植入后左主干血流恢复。
术后收入心血管科继续治疗,完善相关检查,血液分析(2021年1月17日):白细胞总数7.66×109/L,中性粒细胞百分数63.7%,血红蛋白量97 g/L,血小板总数358×109/L;C-反应蛋白11.2 mg/L;肌酸激酶89 U/L,肌酸激酶MB同工酶19 U/L;肌红蛋白126.6 ng/mL,超敏肌钙蛋白Ⅰ 0.918 ng/mL;总胆固醇2.45 mmol/L,甘油三酯0.79 mmol/L,高密度脂蛋白胆固醇1.04 mmol/L,低密度脂蛋白胆固醇1.20 mmol/L,肌酐45 μmol/L,肾小球滤过率89.20 mL/min;甲状腺功能:超敏促甲状腺素<0.005 mIU/L,游离三碘甲状腺原氨酸16.31 pmol/L,游离甲状腺素55.04 pmol/L,总三碘甲状腺原氨酸3.80 pmol/L,甲状腺素253.44 pmol/L。促甲状腺激素受体抗体39.34 IU/L;甲状腺球蛋白抗体236.84 IU/mL,甲状腺过氧化物酶抗体1 225.85 IU/mL。糖化血红蛋白5.9%,凝血、抗dsDNA抗体、抗核抗体、抗心磷脂抗体、狼疮抗凝剂效价未见明显异常。甲状腺彩超:甲状腺弥漫性肿大伴血供丰富,考虑甲状腺功能亢进(甲亢)声像。甲状腺不对称性肿大伴多发实性、囊实性结节,考虑结节性甲状腺肿。CDFI:双侧甲状腺血管弥漫性增多,血流信号丰富。心脏彩超未见明显异常。动态复查心电图(2021年1月17日、2021年1月18日)提示窦性心动过速。诊断:(1)急性ST段抬高型心肌梗死(泵功能Ⅰ级);(2)冠状动脉粥样硬化性心脏病(三支血管病变,累及左主干、左前降支、右冠状动脉,左主干-PCI术后);(3)Graves病。
给予阿司匹林100 mg(每日1次口服)联合氯吡格雷75 mg(每日1次口服)、阿托伐他汀钙片20 mg(每晚1次口服)、甲巯咪唑20 mg(每日1次口服)等治疗,复查甲状腺功能(2021年1月22日):超敏促甲状腺素0.005 mIU/L,游离三碘甲状腺原氨酸8.67 pmol/L,游离甲状腺素26.47 pmol/L。肌红蛋白24.5 ng/mL。出院后随诊,规律行抗甲状腺(甲巯咪唑逐渐减量至5 mg,每日1次口服)、抗血小板聚集(阿司匹林100 mg,每日1次口服+氯吡格雷片75 mg,每日1次口服)等治疗,门诊规律复查甲状腺功能、心肌损伤标志物未见异常,未再发胸闷胸痛、心悸等不适。
2 讨 论
血管内皮细胞衬着在血管内壁,不仅是循环血液和血管平滑肌之间的重要机械屏障,且具有接受、传递信息、内分泌等功能,其结构的完整和功能的正常对保障血管壁的光滑和血流的通畅具有重要意义[1-2]。血管内皮损伤引起的血管内皮功能障碍与心脑血管疾病的发生、发展密切相关[3-4]。血管性血友病因子(vWF)、内皮素-1、一氧化氮(NO)、P-选择素等均是血管内皮损伤的标志物,其合成释放增多提示血管内皮有损伤[5-6]。常曼丽等[7]在甲亢与血管内皮损伤关系的临床研究中发现,单纯甲亢及自身免疫性甲状腺疾病患者的血管内皮损伤指标vWF、内皮素-1、P-选择素水平远高于对照组,且发生血管内皮损伤的危险性是健康人群的2.37倍,单纯性甲亢和自身免疫性甲状腺疾病是血管内皮损伤的高危因素。在甲亢与血管内皮细胞损伤关系的研究中也发现,甲亢组患者血浆中vWF、血栓调节蛋白(TM)、NO、内皮素-1和P-选择素等血管内皮损伤标志物水平较正常对照组均明显升高[8]。除通过实验室方法检测血管内皮损伤标志物评估血管内皮功能外,李现彪[9]利用彩超技术,通过对比甲亢患者治疗前后血管弹性系数(Eρ)、僵硬度(β)、顺应性(AC)等数据,证实Graves病患者存在血管内皮功能障碍。陈耿钦等[10]通过对比甲亢患者治疗前后的血管内皮依赖性舒张功能、血管内皮非依赖性舒张功能亦证实甲亢患者存在血管内皮功能障碍。
上述研究均提示甲亢会导致血管内皮损伤,其机制可能与甲亢引起的血流动力学改变、内分泌功能改变相关。血流动力学方面,甲状腺激素分泌增多,导致外周血管阻力降低,脉压升高,增加了动脉牵拉,导致血管壁所受的压力增大,管壁弹性成分容易疲劳、断裂,最终引起内膜损伤,导致血管内皮功能的损害[11]。同时,甲亢可引起持续的血流高动力状态,造成血流剪切力增加,使血管管径不断增大,最终使其失去代偿能力,造成血管内皮细胞的损伤。另一方面,甲状腺激素分泌增多,会增高机体对血管紧张素Ⅱ、儿茶酚胺的敏感性,刺激血管内皮细胞释放内皮素,打破内皮素和NO的动态平衡,升高的内皮素、NO对血管内皮细胞又是损伤因子,其将进一步造成血管内皮损伤,导致血管内皮功能障碍[12-13]。
李现彪[9]关于甲亢患者血管内皮功能改变及治疗前后的观察对比研究中还发现,早在甲亢患者血管形态学改变出现之前,其血管内皮功能改变就已出现,且甲亢患者经过单纯的抗甲状腺药物治疗后,虽然其症状及体征消失,甲状腺激素水平得到控制,但并不能早期有效地改善血管内皮功能,消除其继发血管疾病的危险性。因此,早期、准确地观察到甲亢患者的血管内皮功能改变,对防治甲亢继发的血管疾病有重要意义。目前评估冠状动脉内皮功能的有创性方法主要是冠状动脉内或肱动脉内注入血管活性物质(如乙酰胆碱等),无创性方法多致力于评估外周血管内皮功能来间接评估冠状动脉内皮细胞功能,如血管舒张功能(FMD)[14]、低血流量介导的血管收缩(L-FMC)、外周动脉压力测定(RH-PAT)、静脉闭塞体积描记法(VOP)、光电容积脉搏波描记法(PPG)等技术,虽然这些技术不是直接测量冠状动脉内皮细胞功能,但已有研究证明其与侵入性检查具有合理相关性[15]。其中,FMD和RH-PAT是心血管事件的独立预测因子,且由RH-PAT评估的外周动脉内皮细胞功能障碍与无法解释的胸痛患者和左心室射血分数正常的心力衰竭患者未来心血管事件独立相关[16]。
大量临床证据表明,凝血的复杂过程受甲状腺激素影响,甲亢导致病理性凝血(包括深静脉血栓、肺栓塞、脑窦静脉血栓等)的风险明显增高[17]。这可能与甲亢患者血液循环中凝血因子、纤溶相关物质的表达水平改变相关。既往研究发现,甲亢患者血液循环中凝血因子Ⅷ、Ⅸ、Ⅹ及纤维蛋白原、vWF、纤溶酶原激活物抑制剂-1(PAI-1)水平升高,而纤溶酶原激活因子(t-PA)水平降低,这使得甲亢患者的止血平衡向高凝血、低纤溶状态转化[18-19]。此外,还有研究提示,甲亢导致的高血栓风险可能还存在一组其他血栓前机制,包括甲状腺激素增强血小板活化,刺激释放前调节性细胞因子和趋化因子,以及活化的血小板和内皮细胞可能的相互作用等,这些机制已经在临床研究和体外模型中公开,它们依赖于甲状腺激素水平的变化而变化,这些机制可能为血管内血栓形成提供特定的基础[20]。最近的观察强调了甲亢合并病理性凝血的可能性,以及甲状腺激素刺激凝血过程中以前未被重视的机制,这些机制涉及凝血因子、血小板、细胞因子和内皮细胞等。医师是否应常规监测甲亢患者的血栓形成风险,需要临床进一步评估。
综上所述,甲亢患者即使不合并其余心血管事件危险因素,也可能因为甲状腺激素分泌异常影响血管内皮细胞功能、凝血过程,而导致冠状动脉病变,罹患极严重的心血管事件。因此,临床诊治甲亢患者时,除治疗其原发病外,还应同时监测心血管事件风险,并及时、合理地进行干预,避免发生严重或致死的心血管事件。
