萝卜硫素抑制糖尿病小鼠耳蜗毛细胞损伤和Trx、Nrf2及p-Erk1/2表达下调
2022-09-18董钲浩董文康张淼黄泳淇黄倩雨邹焜钟诗雯扶玉珍暴凯敏任翔孔慧
董钲浩,董文康,张淼,黄泳淇,黄倩雨,邹焜,钟诗雯,扶玉珍,暴凯敏,任翔*,孔慧*
(1大连医科大学附属第二医院,大连 116023;2大连医科大学基础医学院组织胚胎学教研室,大连 116044;3湖北医药学院组织胚胎学教研室,十堰 442000)
糖尿病是一组以持续性高血糖为主要特征的代谢紊乱性疾病[1]。 当机体长期处于慢性高血糖环境将会导致不同器官损伤及功能障碍。糖尿病性耳聋是以耳蜗毛细胞散在缺失及退行性变为主要病理特征的感音神经性耳聋,多呈进行性发展,病程缓慢且不可逆[2,3]。临床主要表现为双耳高频听力下降,偶尔可以以突发性耳聋的形式出现,可伴眩晕,前庭功能减退等[4]。多数患者就医时已出现听力不可逆性损害,严重影响糖尿病人群的生活质量,因而明确糖尿病性耳聋早期诊断、治疗及预防成为近年研究的热点。有研究表明氧化应激、炎症反应等参与糖尿病耳聋的发生发展过程[5]。
硫氧还蛋白(thioredoxin, Trx)是一种存在于机体内的小分子抗氧化蛋白,分子量约为12 kDa,Trx通过活性位点中Cys的二硫键和巯基的互变来实现氧化还原调节功能[6]。NF-E2-相关因子2(NF-E2-related factor-2, Nrf2)是影响抗氧化反应元件(ARE)介导基因转录的核心蛋白[7]。 Nrf2通常与Keap1结合位于胞质中,激活后解离并易位至胞核中,与ARE序列结合而增强抗氧化基因的转录[8]。Erk家族是一组可传导有丝分裂信号的丝氨酸/苏氨酸蛋白激酶[9]。Erk通常位于细胞质中,激活后易位进入细胞核并调节转录因子活性和基因表达,Erk1和Erk2是Erk/MAPK 途径的重要成员[10],与细胞增殖和分化密切相关[11,12]。
萝卜硫素(sulforaphane, SF)是广泛存在于西蓝花等十字花科植物中的异硫氰酸盐,在人体内转化为莱菔硫烷后通过激活Nrf2信号转导通路表现出抗氧化应激功能[13]。已有研究显示SF作为抗氧化诱导剂可通过上调Trx的表达而延缓Tub基因突变小鼠耳蜗毛细胞的退行性变[14],但对糖尿病小鼠耳蜗毛细胞的影响及其相关机制还未完全阐明。因此,本研究以糖尿病小鼠为模型,明确SF对糖尿病小鼠耳蜗毛细胞退行性变的保护作用机制,为临床防治糖尿病性耳聋提供新的指导方向。
材料与方法
1 实验动物
选择20只健康Balb/c小鼠(购自大连医科大学动物实验中心)适应性喂养一周,室温20~25 ℃,湿度50%~60%,每12 h定点喂养。
2 主要试剂及仪器
萝卜硫素(L-suforaphane, SF)(加拿大Toronto Research Chemicals公司),链尿佐菌素(STZ)(上海希格玛高技术有限公司),Trx抑制剂PX-12(R&D),兔抗Trx抗体(Proteintech),兔抗GAPDH抗体(Proteintech),兔p-Erk1/2抗体(Cell Signaling),兔抗Nrf2抗体(Proteintech),HRP标记的山羊抗兔IgG(Proteintech),Dylight 488标记的山羊抗兔IgG(Abbkin),ECL发光化学试剂盒(上海雅酶生物医药科技有限公司),DAPI染色试剂盒(江苏凯基生物技术有限公司),全蛋白提取试剂盒(江苏凯基生物技术有限公司);三诺安稳型血糖仪(三诺生物传感股份有限公司),SMZ-168解剖显微镜(德国Motic公司),VCX130超声粉碎仪(SONICS Vibra Cell),酶标仪(Thermo Scientific);Bio-Rad Universal Hood Ⅱ成像分析仪(BIO RAD)。
3 糖尿病模型建立及实验分组
将20只小鼠随机分为正常对照组(NC),糖尿病组(DM),DM+SF组,DM+SF+PX12组,每组5只。正常对照组给与基础饲料,其他组给与高脂饲料饲养。各组饲养4周后均禁食12 h,DM组给与腹腔注射STZ(40 mg/kg),7 d后重复注射一次。NC组给与腹腔注射等体积的柠檬酸-柠檬酸钠缓冲液。于第二次STZ注射后每隔5 d测定小鼠尾静脉血糖值,当空腹血糖值≥7.8 mmol/L,则视糖尿病小鼠建模成功[15]。建模成功后,每日上午9:00对DM+SF组及DM+SF+PX12组小鼠分别腹腔注射用PBS溶解的SF(1.0 mg/kg)和SF+PX12(各1.0 mg/kg)(PX12先用DMSO溶解为0.1 mol/L后再用PBS溶解),注射连续15 d。对照组腹腔注射等体积生理盐水。
4 耳蜗SDH组织化学染色
小鼠麻醉后取出耳蜗,去除蜗壳后放入装有0.1% NBT 工作液(现配)的小皿中,用细针尖挑破圆窗膜并摘除镫骨,开放前庭窗和圆窗。从蜗顶钻一小孔,以NBT工作液进行耳蜗蜗管内灌注。将灌注后的耳蜗置于37 ℃ NBT工作液中孵育1 h,随后置于10%福尔马林内室温固定2 d,之后将耳蜗放于7% EDTA二钠脱钙液(pH6.9)中,直到耳蜗软化。
5 耳蜗基底膜铺片
用耳蜗镊去除蜗尖附近的耳蜗骨壁,依次分离螺旋韧带、基底膜和外侧壁组织,最后将基底膜与蜗轴分离。将基底膜转移到滴有甘油的载波片上,于体式显微镜下分段铺平,保证其外侧处于同一方向,覆盖盖玻片以中性树脂封片。
6 硫氧还蛋白免疫荧光染色
小鼠耳蜗组织经石蜡包埋制成石蜡切片,后将石蜡切片经烘箱60 ℃烘烤2 h,脱蜡水化,之后用pH6.0柠檬酸钠抗原修复液高压修复5 min,蒸馏水浸泡冷却至室温,PBS清洗3遍。滤纸吸干周围水分,蜡笔圈画组织。0.5%的Triton X-100室温孵育30 min,PBS清洗3遍,每次3 min。3% H2O2孵育15 min,以消除内源性过氧化物酶活性,PBS清洗3×3 min。滴加山羊血清工作液室温孵育30 min。于组织区域滴加配制好的Trx抗体(1:200),放入湿盒4 ℃冰箱过夜孵育。次日,弃掉一抗,PBS清洗3次,每次3 min。滤纸吸干组织周围液体,滴加Dylight 488标记的山羊抗兔IgG(1:1000),室温避光孵育1 h。PBS清洗3次,每次10 min。滴加DAPI工作液(2 μg/mL)复染细胞核,37 ℃避光孵育15 min。PBS清洗3×3 min,滤纸吸干,滴加抗淬灭剂进行封片,荧光显微镜下观察拍照。
7 Western blot检测耳蜗组织中相关蛋白的表达水平
建模成功后取各组小鼠耳蜗组织,分别加入100 μL蛋白裂解液,超声粉碎后冰上静置30 min,4 ℃下12000 r/min离心15 min,取上清,用BCA试剂盒测定蛋白定量法测定样品蛋白浓度,进行SDSPAGE凝胶电泳,PVDF转膜,5%脱脂奶粉(TTBS配制)室温摇床封闭;分别加入抗Trx(1:1000)、Nrf2(1:1000)、 p-Erk1/2(1:1000)及抗GAPDH(1:2000)等一抗,4 ℃孵育过夜;次日取出PVDF膜置于TTBS洗膜3×15 min, HRP标记的羊抗兔IgG(1:5000)室温孵育1.5 h,TTBS洗膜3×15 min;ECL孵育后Bio-rad成像分析仪成像,通过Labwork软件进行测定蛋白条带光密度值,以目的蛋白光密度值与内参蛋白光密度比值代表相应目的蛋白相对表达水平。
8 统计学分析
采用SPSS 25.0软件对实验数据统计分析,数据用均值±标准差(x±s)表示,2组间比较采用t检验,多组间比较采用单因素方差分析,并进一步应用snk-q检验两两比较组间差异。P<0.05为差异有统计学意义。
结 果
1 萝卜硫素抑制糖尿病小鼠耳蜗损伤
HE染色观察显示,与NC组相比,DM组小鼠耳蜗外毛细胞排列松散且不规则;DM+SF组相较于DM组耳蜗毛细胞体积增大且排列相对规则;而SF与PX12联合处理的DM组与单纯SF处理组相比,耳蜗毛细胞排列不规则且体积变小(图1)。由此提示SF可能通过Trx延缓糖尿病小鼠耳蜗形态学损伤。
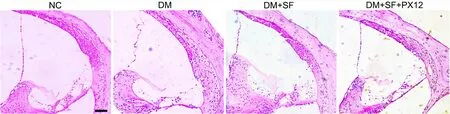
图1 萝卜硫素对糖尿病小鼠耳蜗损伤影响的HE染色观察。比例尺,100 µmFig. 1 HE staining for the effect of suforaphane on the injury of the cochlea in diabetic mice. Scale bar, 100 µm
2 萝卜硫素抑制糖尿病小鼠耳蜗毛细胞SDH活性降低和Trx表达下调
SDH组织化学染色显示:与NC组相比较,DM组较多外毛细胞SDH活性降低或缺失,单纯SF处理的DM小鼠耳蜗外毛细胞SDH活性降低或缺失明显减少,内毛细胞SDH活性物明显改变;而SF与PX12联合处理的DM小鼠耳蜗外毛细胞SDH活性仍明显降低或缺失,且内毛细胞SDH活性也降低或缺失(图2A—C)。免疫荧光染色显示:DM组小鼠耳蜗毛细胞内Trx免疫反应性较对照组明显减弱;SF处理后,Trx免疫反应性的降低被明显抑制;而SF与PX12联合后, Trx免疫反应性仍明显降低(图2D)。由此进一步说明,糖尿病小鼠耳蜗外毛细胞丢失显著,而SF可以减少糖尿病所致耳蜗毛细胞的丢失,在Trx受到抑制时,这种保护作用会相应减弱,SF可能通过上调Trx表达对糖尿病小鼠耳蜗毛细胞发挥保护作用。
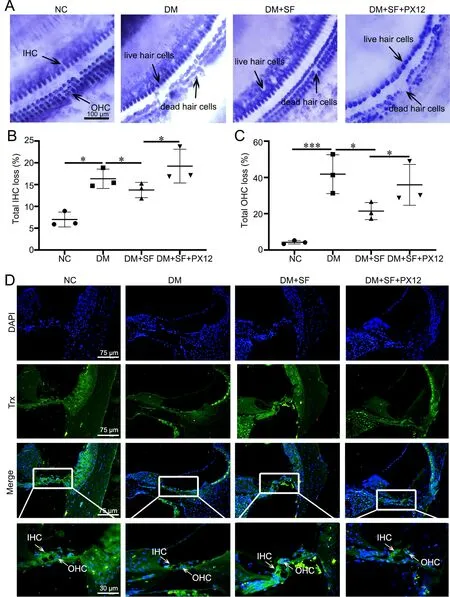
图2 萝卜硫素对糖尿病小鼠耳蜗毛细胞SDH活性和Trx免疫反应性的影响。A,耳蜗毛细胞SDH活性的组织化学染色;B,内毛细胞SDH活性缺失率统计学分析;C,外毛细胞SDH活性缺失率统计学分析;*P<0.05,***P<0.001。D,耳蜗毛细胞Trx免疫反应性免疫荧光染色Fig. 2 The effect of suforaphane on SDH activity and Trx immunoreactivity of the cochlear hair cells of the diabetic mice. A, histochemical staining of SDH activity in the cochlear hair cells ; B, statistical analysis of SDH activity deletion rate of the inner hair cells; C, statistical analysis of SDH activity deletion rate of the outer hair cells; *P<0.05,***P<0.001. D, immunofluorescence staining for Trx immunoreactivity in the in the cochlear hair cells of the diabetes mice.
3 萝卜硫素抑制糖尿病小鼠耳蜗毛细胞p-Erk1/2 /Nrf2通路活性的下调
Western blot检测显示:与NC组比较,DM组小鼠耳蜗组织中Nrf2、p-Erk1/2和Trx的表达水平显著下调; SF作用后,Nrf2、p-Erk1/2和Trx的表达水平较DM组明显升高;而SF与PX12联合处理后,Nrf2、p-Erk1/2和Trx的表达水平与DM组相似,明显低于NC组(图3)。本结果说明SF可抑制糖尿病小鼠耳蜗毛细胞p-Erk1/2 /Nrf2通路活性的下调,SF可能通过p-Erk1/2 /Nrf2抗氧化信号通路上调糖尿病小鼠耳蜗毛细胞的Trx表达。
讨 论
糖尿病是一组由多病因引起以慢性高血糖为特征的代谢性疾病。糖尿病患者长期处于糖、脂及蛋白质代谢紊乱,可累及肾脏、心脏、神经血管等多组织器官,严重威胁患者健康[16]。糖尿病性耳聋是一种进行性发展、病程缓慢、以高频听力下降为主的感音神经性耳聋,是糖尿病常见并发症之一。研究表明,活性氧(ROS)在感音神经性耳聋的发病中起重要作用[17]。一方面,耳蜗内的抗氧化酶类可灭活自由基使耳蜗处于自由基高代谢水平。另一方面,外毛细胞侧面独特的囊腔结构是氧自由基的产生场所及受累部位。
此外有研究表明,在颅脑损伤患者中Trx在减轻损伤或抑制损伤进展方面意义重大[18];外源性增加Trx能够有效降低肺缺血再灌注动物模型的肺组织损伤[19]。本研究使用SF和Trx抑制剂(PX12)分别作用于DM组小鼠,采用SDH活性染色进行耳蜗毛细胞观察。结果发现,DM组与NC组相比,外毛细胞显著减少,内毛细胞亦有所减少。表明糖尿病可引起耳蜗毛细胞丢失,单纯给予SF处理的DM组小鼠外毛细胞丢失现象有所减弱;而SF与PX12联合处理的DM组与单纯给予SF处理的DM组比较,小鼠外毛细胞丢失严重。此结果表明SF能减少因糖尿病造成的耳蜗毛细胞丢失,对耳蜗毛细胞退变起保护作用。当Trx活性受抑制时上述保护作用随之减弱,提示Trx在SF对糖尿病小鼠耳蜗毛细胞丢失过程中发挥保护作用过程中起到关键作用。
已有研究证实Nrf2-ARE途径参与Trx及TrxR表达的调控[20]。SF作为抗氧化剂的天然诱导剂,通过激活p-Erk1/2 /Nrf2信号通路在糖尿病神经退行性变中发挥重要作用。本研究结果显示,单纯给予SF处理后能上调DM组耳蜗组织中Nrf2、p-Erk1/2和Trx的表达,进一步说明SF可通过作用于p-Erk1/2/Nrf2信号通路上调Trx表达。综上所述,萝卜硫素通过作用于p-Erk1/2 /Nrf2抗氧化信号通路介导糖尿病小鼠耳蜗毛细胞内Trx表达上调,对糖尿病引起的耳蜗毛细胞退行性变起到保护作用。
糖尿病导致机体处于一种高血糖的状态,其会导致不同器官损伤及功能障碍,而氧化应激对于糖尿病及耳蜗病变的发生起到了关键性的作用,高血糖导致体内微环境参与氧化应激的发生,引起ROS大量累积,体内抗氧化酶的活性出现下降及下游通路的改变,从而最终引起耳蜗毛细胞的损伤和退化丢失。而大量天然植物提取物中存在着许多有效、安全的抗氧化物,因此针对其种类广泛寻找和明确其抗氧化作用及机制对于今后进一步治疗和预防糖尿病引起的感音神经性耳聋具有重要的理论及临床现实意义。
