EGCG促进合子基因组激活和多能性因子OCT4的表达
2022-09-18连秀丽杜娟刘玥孙建东徐伟伟林子杭江霞王世鄂
连秀丽,杜娟,刘玥,孙建东,徐伟伟,林子杭,江霞,王世鄂*
(1福建医科大学基础医学院干细胞工程与再生医学福建省高校重点实验室,福州 350122;2联勤保障部队第904医院生殖医学中心,无锡 214000;3福建医科大学基础医学院组织学与胚胎学系,福州 350122)
哺乳动物早胚发育主要包括以下3个阶段:①母型向合子型过渡(maternal-to-zygotic transition,MZT),形成具有全能性的卵裂球;②致密化形成桑葚胚;③腔化形成囊胚。其中MZT是影响早胚发育关键的第一步,该时期发生合子基因组激活(zygotic genome activation,ZGA),以此改变基因表达模式,产生胚胎特异性的RNA及蛋白[1]。在小鼠中,ZGA主要发生在2-细胞阶段[2]。课题组前期研究发现,小鼠2-细胞胚至4-细胞胚的顺利过渡,往往与ZGA密切相关[3,4]。
表没食子儿茶素没食子酸酯(epigalloeateehin-3-gallate,EGCG)是绿茶提取物茶多酚的主要活性物质,具有抗氧化、抗炎、抗癌等作用[5-7]。有研究发现,一定浓度的EGCG能够促进新鲜或冷冻精子体外受精的胚胎发育,也能够缓解高温对卵巢池中卵母细胞发育的负面影响,提高胚胎质量[8,9]。此外,EGCG在不同类型的干细胞中能够影响多能性因子的表达,例如OCT4、SOX2等[10,11]。并且前期结果表明,OCT4或SOX2表达量的改变将影响小鼠2-细胞胚至4-细胞胚的过渡率[12,13]。然而,EGCG对小鼠早胚体外发育的影响是否与ZGA以及多能性因子有关,尚不清楚。
因此,本研究以昆明(Kunming,KM)小鼠作为动物模型,旨在观察EGCG对小鼠早胚体外发育和对ZGA与多能性因子OCT4和SOX2表达的影响。为进一步阐明EGCG在哺乳动物早胚体外发育中的作用奠定基础。
材料与方法
1 实验动物
昆明小鼠(雌鼠4~6 w, 雄鼠>8 w)购自北京华阜康生物科技有限公司,合格证号:SCXK(京)2014-004),饲养3~5 d,调节生理周期(光照周期07:00—19:00),使其适应环境[福建医科大学实验动物中心,使用许可证号:SYXK(闽)2016-0006]供实验处理。所有动物实验相关操作均符合福建医科大学实验动物福利伦理委员会相关规定(批号:2018-004)。
2 主要试剂
孕马血清促性腺激素(PMSG)(宁波激素制药二厂);人绒毛膜促性腺激素(hCG)(Prospec公司);M2培养液(Sigma公司);M16培养液(Sigma公司);EGCG粉末(Sigma公司);鼠抗SOX2单克隆抗体(Santa Cruze公司);兔抗OCT4多克隆抗体(Abcam公司);免疫染色固定液(碧云天公司);Alexa Fluor® 594标记驴抗鼠IgG、Alexa Fluor® 488标记驴抗兔IgG(Life Technology公司);Quick-RNATMMicroPrep R1050试剂盒(Zymo公司);Reverse Transcription Kit试剂盒、dNTP Mix(Thermo公司);SYBR®Premix Ex TaqTM(Roche公司);PCR引物(上海生工)。
3 主要仪器设备
PikoReal96实时定量PCR仪(Thermo公司);SMZ445体视显微镜(Nikon公司);TS-100F倒置显微镜(Nikon公司);Leica SP5激光共聚焦扫描显微镜(Leica公司),水套式二氧化碳培养箱(Thermo公司)。
4 小鼠超排卵和受精
KM雌性小鼠腹腔注射10IU PMSG,46~48 h后注射6 IU hCG,随后与KM雄性小鼠1:1合笼,次日清晨检查阴栓判断是否受精。
5 小鼠1-细胞胚的收集和体外培养
于hCG注射后27 h,将有阴栓的雌鼠以颈椎脱臼法处死,打开腹腔,迅速分离并剪下输卵管;用M2培养液冲出输卵管中的1-细胞胚,洗涤3次以上;体式显微镜下观察,将具有雌雄原核的1-细胞胚移至预先于37 ℃、5% CO2培养箱中平衡好的M16液滴中洗涤3次;将清洗好的1-细胞胚随机移至预孵育的培养液滴中(分为对照组:M16,实验组:10 μg/mL EGCG、20 μg/mL EGCG),置于37℃、5% CO2、饱和湿度的二氧化碳培养箱中培养。实验重复3次以上,观察并记录各培养液滴中2-细胞胚、4-细胞胚、桑葚胚以及囊胚的发育情况。
6 免疫荧光染色
将早胚置于台式液中处理30~60 s后用0.1%PVA-PBS进行漂洗,随后移入免疫染色固定液中室温固定1 h,0.1% PVA-PBS连续清洗3次;再置于0.5% Triton X-100中室温孵育30 min,0.1% PVA-PBS连续清洗3次后于0.2%牛血清白蛋白(BSA)中室温封闭1 h;添加抗SOX2鼠单克隆抗体(1:1500)或抗OCT4兔多克隆抗体(1:800),4℃孵育过夜;次日,PBST清洗3次,每次10 min,添加Alexa Fluor®594标记驴抗鼠二抗或Alexa Fluor®488标记驴抗兔IgG(1:1000),室温避光孵育1 h;PBST清洗3次,每次10 min,添加DAPI(1:5000)进行细胞核复染,室温避光孵育1 h,PBST清洗3次,每次10 min;在激光扫描共聚焦显微镜下观察并拍照。
7 实时定量PCR
分别收集M16组和20 μg/ml EGCG组2-细胞胚各100枚,用DEPC处理过的0.3% PVP-PBS 洗涤3次后,置于装有400 μL RNA Lysis Buffer离心管中;根据Quick-RNATMMicroPrep R1050试剂盒说明书提供的方法提取总RNA;根据Reverse Transcription Kit试剂盒说明书,使用PCR仪合成cDNA;PCR引物序列信息列于表 1(以H2afz基因作为内参);在Real Time-PCR扩增仪上采用 SYBR®PremixEx TaqTM进行扩增,反应条件如下:95 ℃,10 min,1个循环;95 ℃,15 s,40个循环;60 ℃,1 min,40个循环。实验重复3次以上。

表1 引物序列Tab.1 Primer sets used in the present study
8 统计学分析
培养数据采用SPSS17.0统计软件进行卡方(χ2)检验;激光共聚焦扫描显微镜所得图片用SmtScape软件测定分析荧光强度;采用2‐ΔΔct法处理实时定量PCR结果;利用SPSS17.0统计软件对实验数据进行统计分析,检验方差齐性后运用独立样本t检验进行组间比较,均以P<0.05为差异具有统计学意义。
结 果
1 EGCG促进1-细胞胚体外发育
小鼠1-细胞胚分别在M16培养液和添加不同浓度 EGCG的培养液中连续培养观察。结果显示,10µg/mL EGCG和20 µg/mL EGCG均可使4-细胞胚、桑葚胚、囊胚的发育率有所提高,且从4-细胞胚开始过渡比例有着明显提升(表2)。

表2 EGCG对小鼠1-细胞胚体外发育的影响Tab. 2 Effects of EGCG on the development of the mouse one-cell embryo in vitro
2 EGCG促进2-细胞胚合子基因组激活标志基因MuERV-L和Hsp70.1表达
从培养结果可知20 μg/mL EGCG促进早胚发育效果更佳,因此将采用该组作为实验组进行后续机制研究。实时定量PCR检测显示:在小鼠2-细胞胚中,20 μg/mL EGCG组ZGA标志基因MuERV-L和Hsp70.1的mRNA表达水平高于M16组,而eIF1A、Zscan4d的mRNA表达量无明显改变(图1)。

图1 EGCG处理对2-细胞胚ZGA标志基因mRNA表达的影响。*P<0.05Fig. 1 Effects of EGCG treatment on the mRNA expression levels of ZGA marker genes of the two-cell embryo. *P<0.05
3 EGCG促进2-细胞胚多能性因子OCT4表达
免疫荧光染色显示:在小鼠2-细胞胚中,20 μg/mL EGCG组OCT4的荧光相对强度高于M16组(图2A、B),而SOX2的荧光相对强度无明显改变(图3A、B)。同时,Real Time-PCR检测结果显示:20 μg/mL EGCG组Oct4 mRNA表达量明显高于M16组(图2C),而Sox2 mRNA表达情况无变化(图3C)。
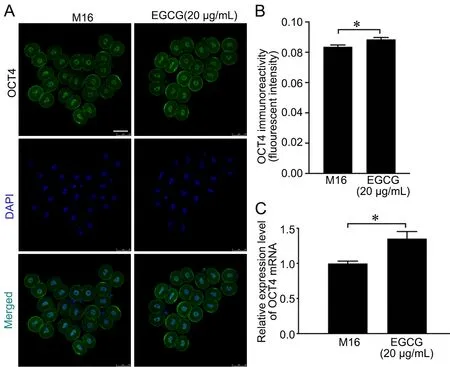
图2 EGCG处理对2-细胞胚OCT4表达的影响。A,OCT4表达的免疫荧光检测;比例尺,50 µm;B,OCT4免疫荧光强度的统计学分析。C,Oct4 mRNA表达水平的Real-time RT-PCR检测。*P<0.05Fig. 2 Effects of EGCG treatment on OCT4 expression in the two-cell embryo. A, immunofluorescence examination for OCT4 expression; scale bar, 50 µm; B, statistical analysis of OCT4 immunofluorescence intensity. C, Real time RT-PCR detection for Oct4 mRNA expression level. *P<0.05.
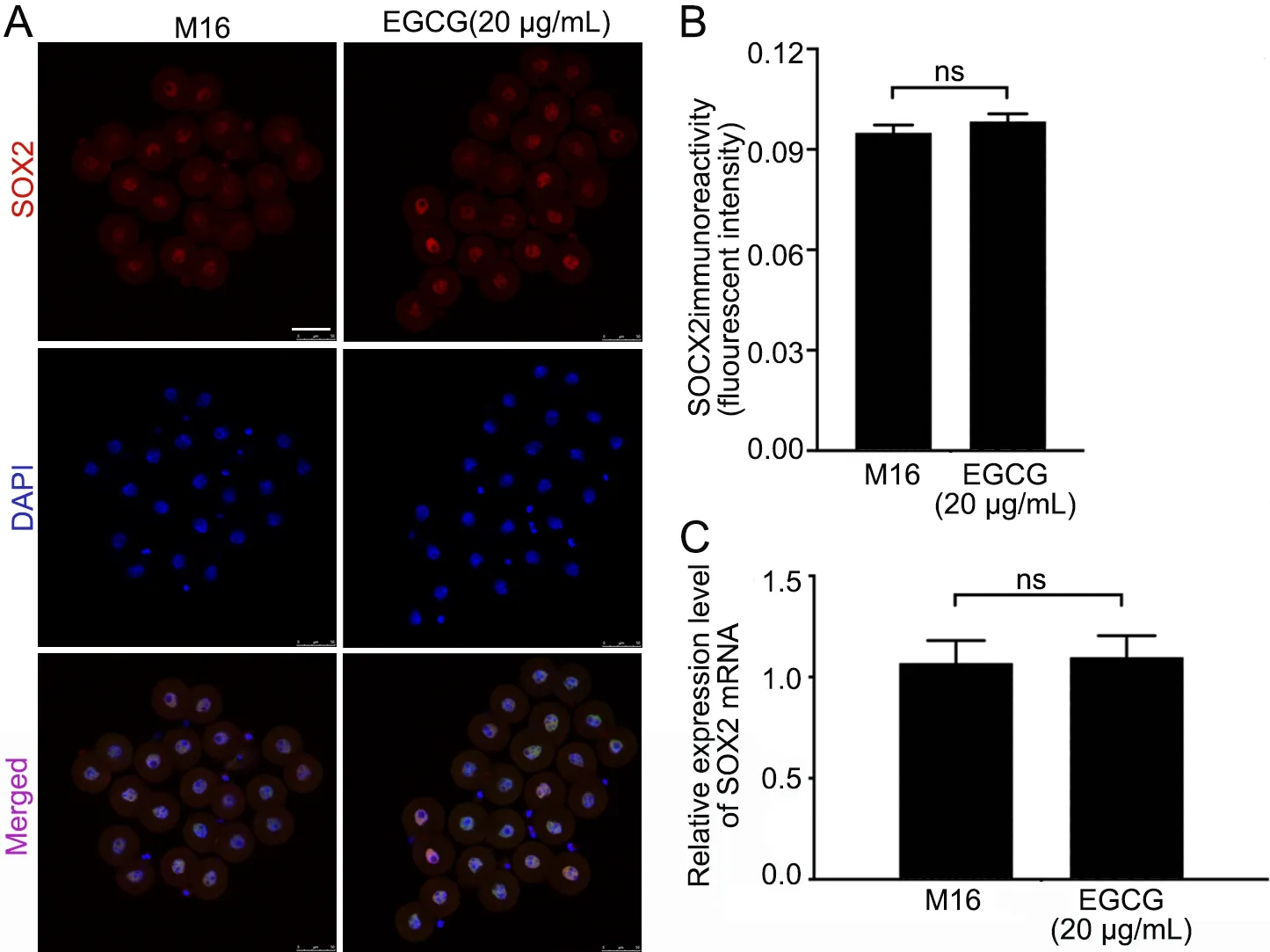
图3 EGCG处理对2-细胞胚SOX2表达的影响。A,SOX2表达的免疫荧光检测;比例尺,50 µm;B,SOX2免疫荧光强度的统计学分析。C,Sox2 mRNA表达水平的实时定量PCR检测。ns,无显著性(P>0.05)Fig. 3 Effects of EGCG treatment on SOX2 expression in the two-cell embryo. A, immunofluorescence examination for SOX2 expression; scale bar, 50 µm; B, statistical analysis of SOX2 immunofluorescence intensity.C, Real time RT-PCR detection for Sox2 mRNA expression level. ns, no significance (P>0.05)
讨 论
当今辅助生殖技术的应用给许多不孕不育患者带来了福音,该技术成功应用的先决条件之一是须确保早胚的顺利发育。许多研究学者通过在培养液中添加不同的物质以此促进早胚体外发育[14,15]。本研究发现,M16培养液中添加不同浓度的EGCG可促进KM小鼠早胚体外发育,且从4-细胞胚开始过渡率显著升高,以添加20 μg/mL EGCG效果最为明显。
翻译起始因子基因eIF1A是ZGA阶段特异性基因,其表达起始同第一次DNA复制呈正相关[16];含锌指和SCAN结构域蛋白Zscan4d是2-细胞胚晚期的主要转录本,敲减Zscan4将延迟2-细胞胚至4-细胞胚的进程[17];鼠内源性逆转录病毒基因MuERV-L在ZGA中最早转录,约在受精后8 h[18];热休克蛋白基因Hsp70.1在ZGA开始时高度转录,直至第二轮DNA复制完成前受到抑制[19]。上述4个基因被认为是ZGA起始的内源性标志基因[20]。本实验结果显示,20 μg/mL EGCG处理小鼠1-细胞胚后,显著增强ZGA标志基因MuERV-L和Hsp70.1的mRNA表达水平。有研究表明,在2-细胞胚中激活的MuERVL与开放的染色质密切相关,并可促进数百个邻近基因的表达[21,22]。同时,通过添加相应抗体来抑制HSP70蛋白功能,结果导致囊胚形成率降低,细胞死亡率增加[23]。以上两者mRNA表达量的升高,说明EGCG可能参与调节ZGA的启动。此外,前期研究发现EGCG可通过清除ROS和调节线粒体活性,促进早胚体外发育[24]。而在小胶质细胞和神经母细胞瘤中,HSP70可降低脂多糖诱导的ROS生成[25]。那么,EGCG清除ROS的能力或许与Hsp70.1表达升高有一定联系。
另有研究报道,多能性因子SOX2和OCT4在早胚发育过程扮演着关键角色。两者mRNA表达十分相似,从卵母细胞至早胚各发育阶段均有表达,且囊胚阶段仅表达于内细胞团(inner cell mass,ICM)[26]。SOX2能预示小鼠4-细胞胚后期发育的命运。在4-细胞胚中,若检测到SOX2长时间富集于DNA上,则此枚卵裂球发育至后期将被分配至ICM中[27]。在牛早胚中,注射Sox2 siRNA后,囊胚形成率明显降低[28]。其次,OCT4是小鼠2-细胞胚内关键调节因子,在转录和翻译后修饰过程中有着重要作用[29]。利用反义寡核苷酸技术降低Oct4的表达能使早胚阻滞在不同发育阶段[30]。此外,在斑马鱼早胚中,Sox2 与Oct4 共同激活约40%早期合子型基因[31]。因此,我们进一步通过免疫荧光染色和Real time-PCR技术检测发现,添加20 μg/mL EGCG实验组中的Oct4蛋白和mRNA表达量明显升高。Teng等人研究指出Oct4启动子活性受PI3K/AKT/mTOR信号通路正向调控[32]。同时EGCG可增强损伤内皮细胞p-AKT表达水平,激活PI3K/AKT/eNOS信号通路,抑制同型半胱氨酸(hcy)诱导的人脐静脉内皮细胞(HUVECs)凋亡[33]。并且有趣的是,课题组前期研究发现,抑制AKT活性显著下调了ZGA的两个标记基因MuERV-L和eIF-1A的mRNA水平[4]。这些结果和研究相关进展提示EGCG可能通过激活PI3K/AKT信号通路,促进Oct4表达,继而参与ZGA的网络调控。
综上所述,本研究结果显示,EGCG能够促进小鼠早胚体外发育,与其影响ZGA的启动和多能性因子Oct4表达有关。但是否存在EGCG/PI3K/AKT/Oct4信号通路尚未清楚,有待进一步研究阐明。
