下调ClC-5表达抑制多发性骨髓瘤细胞增殖并诱导凋亡
2022-09-18苗玉迪胡星星李艳春
苗玉迪,胡星星,李艳春*
(1陕西省人民医院血液内科,西安 710068;2西安国际医学中心医院血液病医院实验诊断中心,西安 710018)
多发性骨髓瘤(multiple myeloma,MM)是一种以骨髓中浆细胞异常增生为特征的造血系统恶性肿瘤,目前已成为第2大常见的血液系统恶性肿瘤[1]。尽管化疗、生物制剂、免疫制剂以及自体干细胞移植的应用使得MM的整体生存时间有所提高,但这些手段依然存在毒副作用较大且疗效不尽人意的缺陷[2,3]。对MM机制的研究有助于对今后MM治疗提供策略,因此,继续对MM机制的探索仍十分必要。
近来研究表明,氯通道(chloride channel,ClC)家族蛋白在MM细胞的增殖、命运以及化疗敏感性的调节中发挥重要作用[4-6]。比如,敲降ClC-3可通过抑制细胞周期运行来降低MM细胞的增殖[4,5];ClC-5可通过促进自噬减少MM细胞对硼替佐米化疗的敏感性[6]。另外,ClC-5在骨肉瘤[7]、胶质瘤[8]和白血病[9]细胞中高表达并参与它们的增殖调控,但ClC-5对MM细胞的影响和机制并不完全清楚。因此,本研究首先检测ClC-5在MM细胞中的表达情况,并通过ClC-5 siRNA转染敲降MM细胞中的表达,观察其细胞活性和凋亡的变化,并分析其机制。
材料与方法
1 细胞、试剂和抗体
外周血单个核细胞(peripheral blood mononuclear cell,PBMC)和MM细胞系(ARH77、U266和RPMI8266)(武汉普诺赛生命科技有限公司);DMEM培养基(美国Gibco公司);胎牛血清(德国PAA公司);DAPI试剂、BCA蛋白浓度检测试剂盒和ECL化学底物发光试剂盒(北京百奥莱博科技有限公司);CCK-8细胞活性检测试剂盒和Annexin V-FITC/PI双染色细胞凋亡检测试剂盒(江苏凯基生物技术股份有限公司);Lipofectamine 2000试剂(美国Invitrogen公司);ClC-5 siRNA和阴性对照(NC siRNA)以及小鼠源ClC-5抗体(美国Santa Cruz公司);Hoechst 33258试剂、RIPA试剂、兔源细胞色素c氧化酶IV亚基(cytochrome c oxidase IV,COX IV)抗体、JC-1染色试剂盒以及线粒体分离试剂盒(上海碧云天生物技术有限公司);Alexa Fluor®488标记的驴抗小鼠IgG(英国Abcam公司);兔源GAPDH抗体、兔源Cleaved Caspase-3抗体和兔源细胞色素c(cytochrome c,cyt-c)抗体(万类生物科技有限公司);HRP标记的山羊抗兔或山羊抗小鼠IgG(武汉博士德生物工程公司)。
2 细胞培养与转染
将PBMC、ARH77、U266和RPMI8266细胞分别接种在添加有10%胎牛血清的DMEM培养基中,按每隔3 d传代1次的方式进行传代培养。
3 免疫荧光法观察细胞中ClC-5表达
将处于对数生长期的PBMC、ARH77、U266和RPMI8266细胞接种在载玻片上,4%多聚甲醛固定,0.2% Triton X-100透膜2 min,10%山羊血清封闭45 min,滴加1:500稀释的抗ClC-5抗体并室温孵育1 h,PBS漂洗2次,再次滴加1:500稀释的Alexa Fluor®488标记的驴抗小鼠IgG并室温孵育45 min,PBS漂洗2次,DAPI试剂染核,激光共聚焦显微镜下观察。
4细胞转染
取处于对数生长期的PBMC、ARH77、U266和RPMI8266细胞重新接种于6孔板,用无血清DMEM培养基同步化处理6 h后,将细胞分为对照组(Control)、ClC-5 siRNA转染组(ClC-5 siRNA)和NC siRNA转染组(NC siRNA);ClC-5 siRNA组和NC siRNA组分别通过Lipofectamine 2000试剂对PBMC、ARH77以及U266细胞转染ClC-5 siRNA或NC siRNA,继续培养,Control组直接培养不进行转染处理。48 h后,用Western blot鉴定转染效率后用于后续研究。
5 CCK-8法检测细胞活性
取各组细胞接种到96孔板中,培养48 h,每孔加10 μL CCK-8试剂并孵育2 h。用酶标仪(德朗DR-200Bs,无锡华卫德朗仪器有限公司)读取450 nm波长处的光密度(A)值。细胞活性=各实验组A值/对照组组A值×100%。
6 Hoechst 33258染色观察细胞核形态
取各组细胞接种在载玻片上,培养48 h后,4%多聚甲醛固定,0.2% Triton X-100透膜2 min,PBS漂洗2次,Hoechst 33258试剂染核,激光扫描共聚焦显微镜(FV3000;日本Olympus公司)下(激发波长350 nm,发射波长455 nm)观察。
7 Annexin V-FITC/PI双染色检测细胞凋亡
将各组细胞接种在6孔板中,培养48 h后收集细胞。用PBS漂洗2次后并用结合缓冲液重悬1次,混匀。滴加10 μL FITC-Annexin V试剂,室温避光孵育15 min,再滴加10 μL PI试剂再次室温避光孵育15 min,用流式细胞仪分析细胞凋亡。
8 JC-1染色检测线粒体膜电位
取各组细胞接种在载玻片上,培养48 h后,PBS漂洗2次,加入1 mL JC-1染色液室温避光染色20 min,用JC-1染色缓冲液漂洗1次,在激光扫描共聚焦显微镜下观察。JC-1单体(monomer)用激发波长490 nm,发射波长530 nm观察,绿色荧光;JC-1聚合物(aggregates)用激发波长525 nm,发射波长590 nm观察,红色荧光。线粒体膜电位=红色荧光强度/绿色荧光强度。
9 Western blot检测蛋白表达
收集PBMC、ARH77、U266和RPMI8266细胞或已处理的各组细胞,按照试剂盒方法,用RIPA提取全蛋白;用线粒体分离试剂盒分别提取线粒体以及去除线粒体后的细胞质蛋白。上述蛋白用BCA法将蛋白浓度统一定量后,然后将各样品(30 mg蛋白/样品)进行聚丙烯酰胺凝胶电泳并分别转移至聚偏二氟乙烯膜上。在室温下,用5%牛血清蛋白封闭聚偏二氟乙烯膜上蛋白1 h,然后分别加入抗ClC-5抗体(1:1000)、抗Cleaved Caspase-3抗体(1:1000)、抗cyt-c抗体(1:1000)、抗COX IV抗体(1:10000)和抗GAPDH抗体(1:10000)在4 ℃下孵育过夜。用PBS-Tween 20漂洗3次,然后加入HRP标记山羊抗兔或山羊抗小鼠IgG(1:1000)室温下孵育1 h, PBS-Tween 20漂洗3次,加入ECL发光剂显影,并用ChemiDoc XRS图像系统拍摄图像。用Quantity one软件检测各条带A值,并以GAPDH作为细胞质蛋白或全蛋白内参,COX IV作为线粒体蛋白内参;以目的蛋白条带与内参蛋白A值的比值为目的蛋白的相对表达水平,对照组目的蛋白相对表达水平为1,计算实验组目的蛋白相对表达水平的变化倍数(标准化)。
10 统计学分析
数据表示为均数±标准差,用SPSS 19.0软件采用单因素方差分析事后Tukey检验法对所有数据进行多重比较,以P<0.05表示差异具有统计学意义。RPMI8266 cells (scale bar, 20 μm). B,Western blotting for the expression of ClC-5 in PBMC, ARH77, U266 and RPMI8266 cells; C, statistical analysis of the expression level of ClC-5 in PBMC, ARH77, U266 and RPMI8266 cells (*P<0.05 vs PBMC cell; n=3)
结 果
1 MM细胞高表达ClC-5
免疫荧光检测显示:ClC-5在PBMC细胞与MM细胞株(ARH77、U266和RPMI8266)中均有表达,且相对于PBMC细胞,ClC-5在MM细胞株中荧光强度更强(图1A)。进一步通过Western blot证实,MM细胞株中ClC-5的表达水平明显高于PBMC细胞(图1B和图1C)。
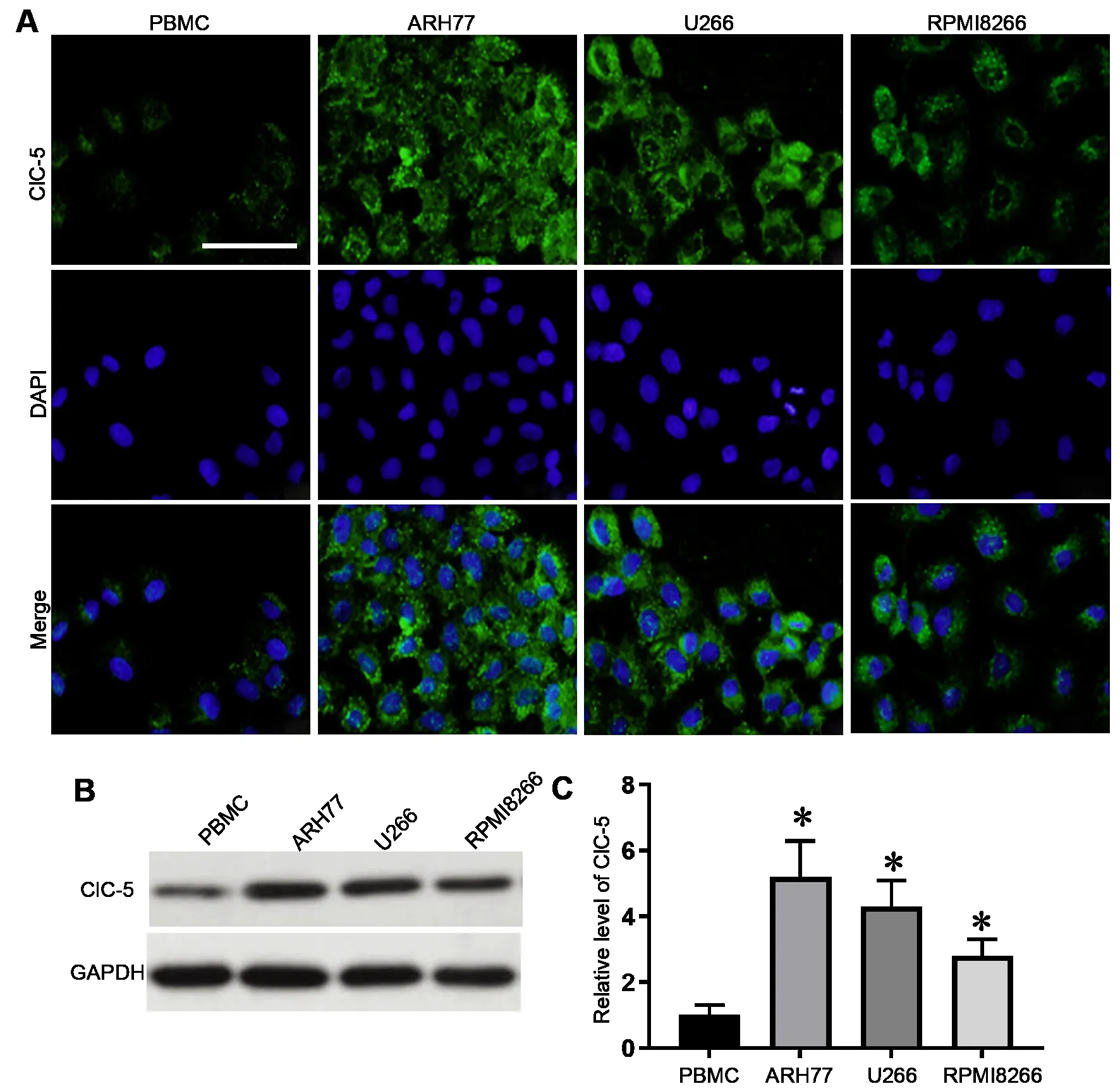
图1 ClC-5在PBMC细胞与MM细胞株中的表达。A,ClC-5在PBMC、ARH77、U266和RPMI8266细胞中表达的免疫荧光染色(比例尺,20 μm)。B,ClC-5在PBMC、ARH77、U266和RPMI8266细胞中表达的Western blot检测;C,PBMC、ARH77、U266和RPMI8266细胞中ClC-5表达水平的统计学分析(与PBMC细胞比较,*P<0.05,n=3)Fig. 1 Expression of ClC‐5 in PBMC cell and MM cell lines. A, immunofluorescence staining of the expression of ClC‐5 in PBMC, ARH77, U266 and
2 敲降ClC-5抑制MM细胞活性
Western blot检测显示,ClC-5 siRNA转染能有效敲降PBMC细胞与MM细胞株(ARH77和U266)中ClC-5表达(图2A、2B)。CCK-8法细胞活性检测显示,敲降ClC-5能抑制ARH77和U266细胞的活性,但对PBMC细胞的细胞活性无影响(图2C)。
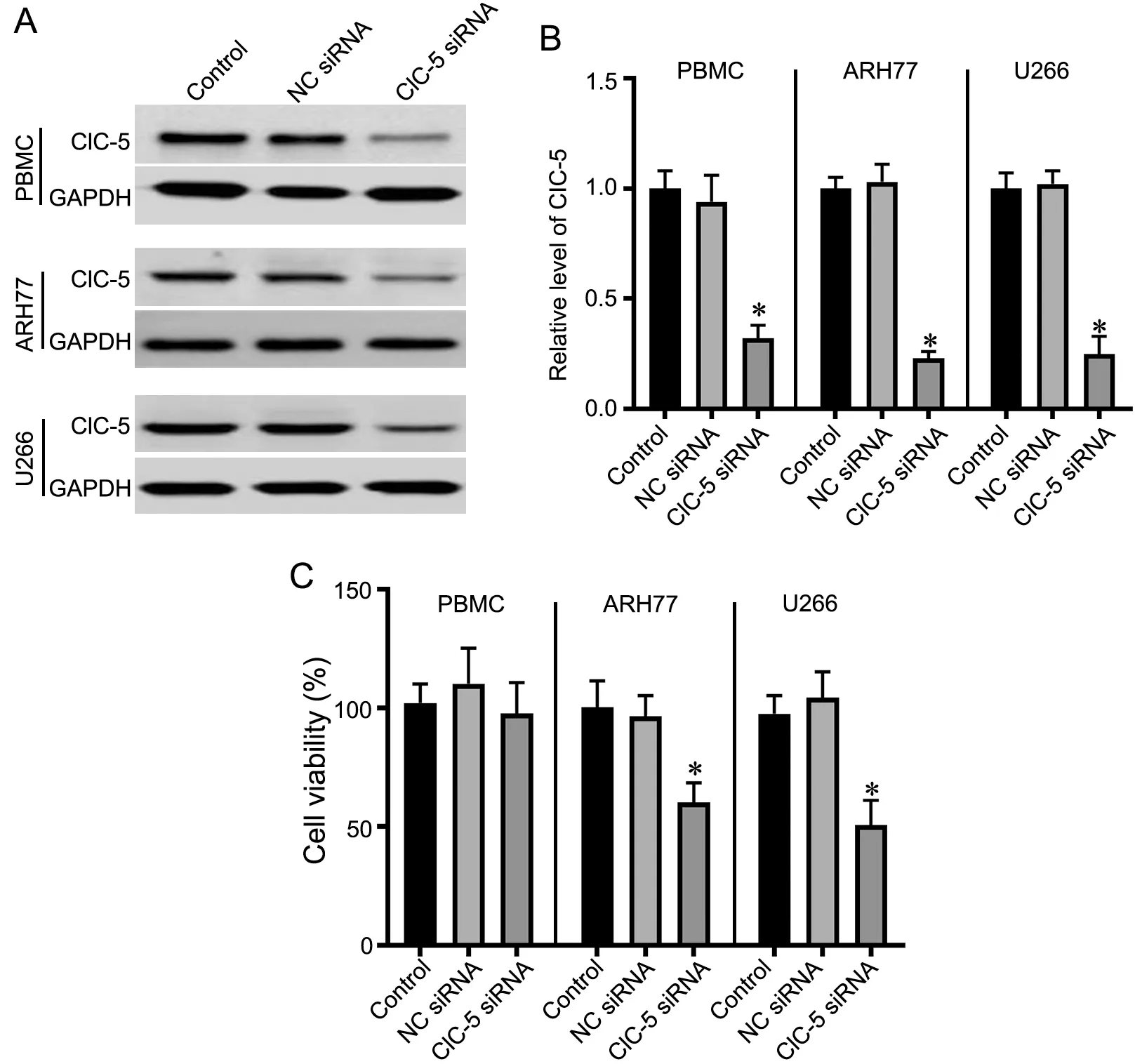
图2 敲降ClC-5对MM细胞活性的影响。A,ClC-5 siRNA敲降ClC-5效率的Western blot检测;B,ClC-5 siRNA敲降ClC-5效率的统计学分析。C,敲降ClC-5对MM细胞活性影响的CCK-8法检测。与对照组比较,*P<0.05,n=3Fig. 2 Effect of ClC‐5 knockdown on the viability of MM cells. A, Western blot detection of ClC‐5 knockdown efficiency by ClC‐5 siRNA; B, statistical analysis for ClC‐5 knockdown efficiency by ClC‐5 siRNA; C, CCK‐8 assay for the effect of knocking down ClC‐5 on the activity of MM cells. *P<0.05 vs Control group, n=3
3 敲降ClC-5促进MM细胞凋亡
Hoechst 33258染色显示,在ARH77和U266细胞中,对照组和NC siRNA组细胞核正常,而ClC-5 siRNA组细胞核的部分染色质出现高度凝聚的亮蓝色荧光颗粒(图3A)。Annexin V-FITC/PI双染色流式细胞术检测显示,敲降ClC-5能促进ARH77和U266细胞凋亡(图3B、C)。
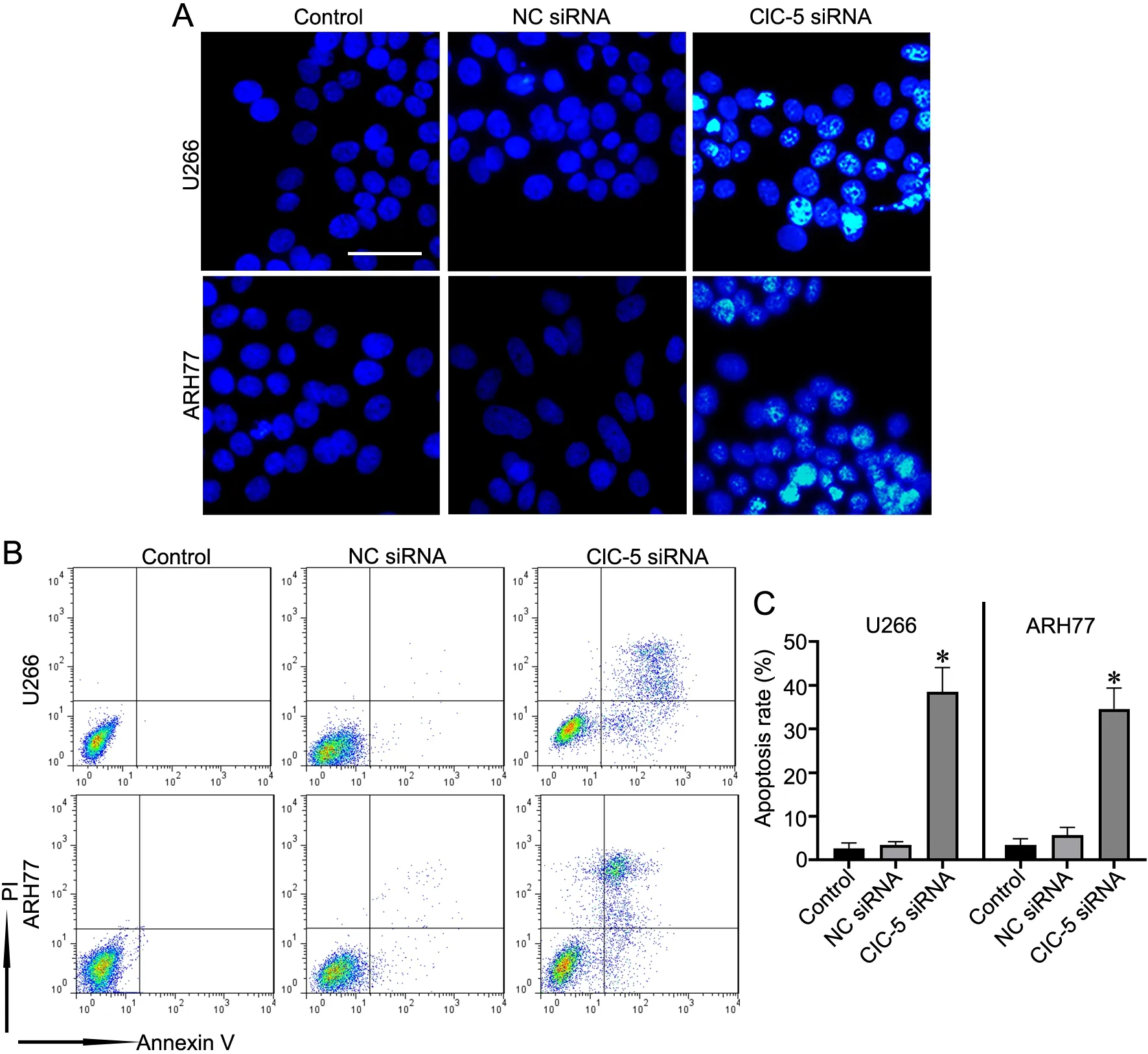
图3 敲降ClC-5对MM细胞凋亡的影响。A,细胞凋亡的Hoechst 33258染色检测(比例尺,20 μm)。B,细胞凋亡的Annexin V-FITC/PI双染色流式细胞术检测;C,Annexin V-FITC/PI双染色流式细胞术检测细胞凋亡的统计学分析(与对照组比较,*P<0.05,n=3)Fig. 3 Knockdown of ClC-5 promoted MM cells apoptosis. A, the nuclear morphology of cells in each group was observed by Hoechst 33258 staining(scale bar, 20μm); B, apoptosis of cells in each group was detected by flow cytometry with Annexin V‐FITC/PI double staining; C, statistical analysis for apoptosis detected by Annexin V‐FITC/PI double staining flow cytometry (*P<0.05 vs Control group, n=3)
4 敲降ClC-5降低MM细胞的线粒体膜电位
JC-1染色显示,在ARH77和U266细胞中,与对照组比较,ClC-5 siRNA组细胞的线粒体膜电位明显降低(图4)。
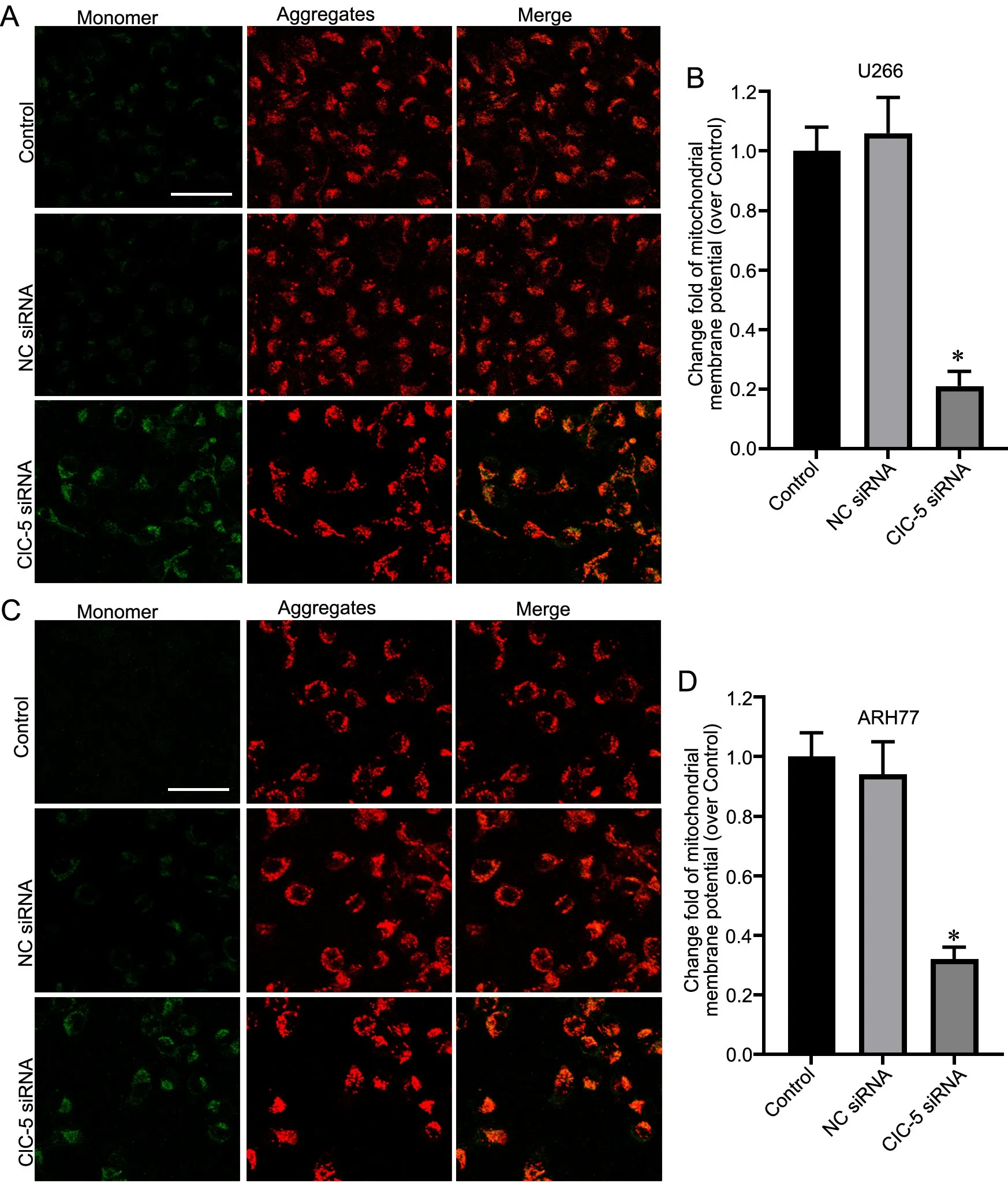
图4 敲降ClC-5对MM细胞线粒体膜电位的影响。A,U266细胞线粒体膜电位JC-1染色检测;B,敲降ClC-5对U266细胞线粒体膜电位影响的统计学分析。C,ARH77细胞线粒体膜电位JC-1染色;D,敲降ClC-5对ARH77细胞线粒体膜电位影响的统计学分析。比例尺,40 μm。与对照组比较,*P<0.05,n=3Fig. 4 The effect of knocking down ClC‐5 on the mitochondrial membrane potential of MM cells. A, detection of mitochondrial membrane potential by JC‐1 staining in U266 cells; B, statistical analysis for the effect of knocking down ClC‐5 on mitochondrial membrane potential of U266 cells; C,detection of mitochondrial membrane potential by JC‐1 staining in ARH77 cells; D, statistical analysis for the effect of knocking down ClC‐5 on mitochondrial membrane potential of ARH77 cells. Scale bar, 40 μm. *P<0.05 vs Control group, n=3.
5 敲降ClC-5促进MM细胞cyt-c释放和Cleaved Caspase-3表达
Western blot检 测 敲 降ClC-5对cyt-c释 放 和Cleaved caspase-3表达的影响显示(图5),在MARH77和U266细胞中,与对照组比较,ClC-5 siRNA组细胞线粒体中cyt-c水平明显降低,而细胞质中cyt-c水平明显升高,表明敲降ClC-5能促进MM细胞的线粒体cyt-c释放到细胞质;ClC-5 siRNA组细胞中Cleaved caspase-3水平较对照组明显升高。
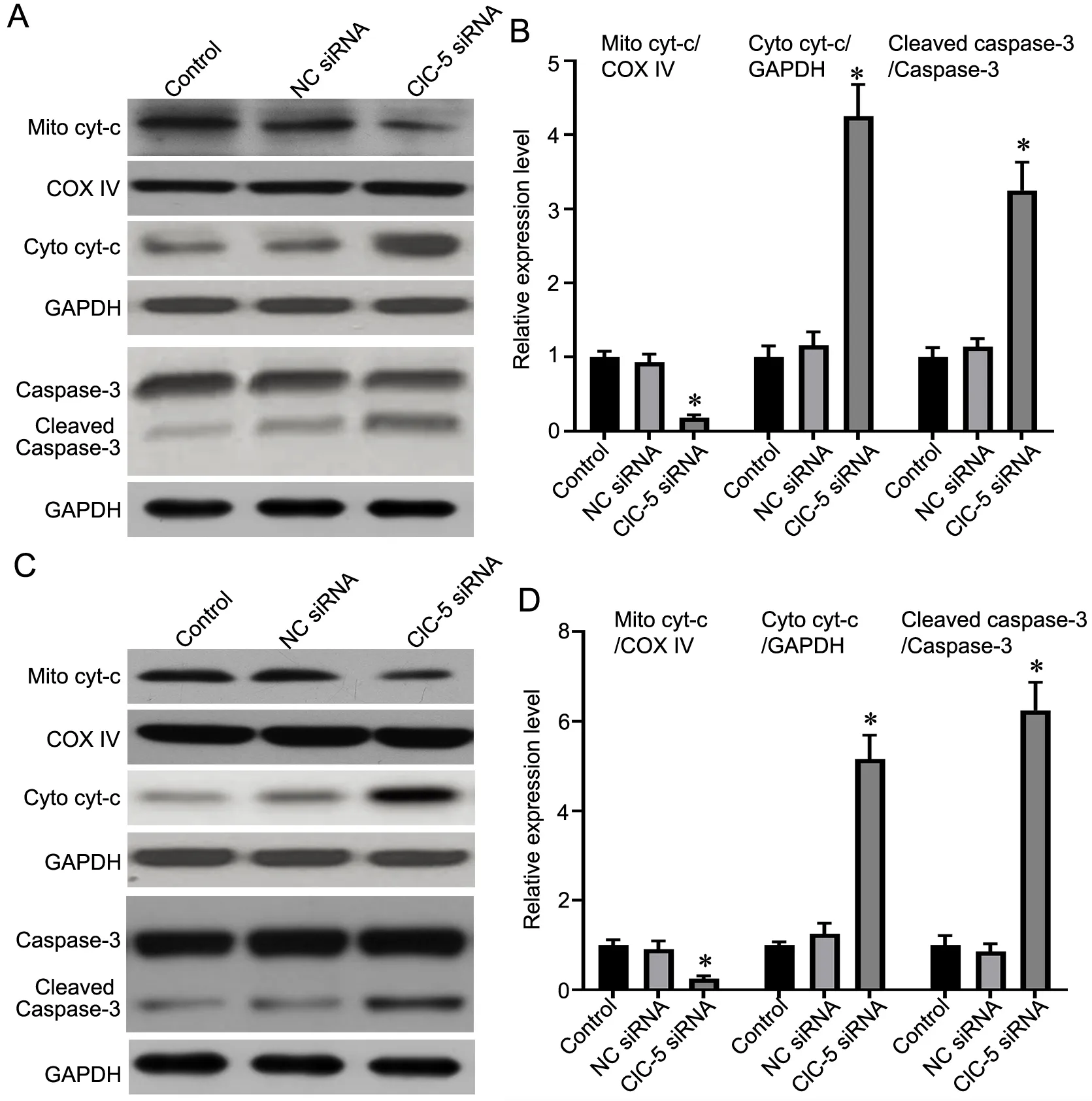
图5 敲降ClC-5对MM细胞cyt-c释放和Cleaved Caspase-3表达的影响。A,U266细胞cyt-c释放和Cleaved Caspase-3表达的Western blot检测;B,U266细胞cyt-c释放和Cleaved Caspase-3水平的统计学分析。C,ARH77细胞cyt-c释放和Cleaved Caspase-3表达的Western blot检测;D,ARH77细胞cyt-c释放和Cleaved Caspase-3水平的统计学分析。与对照组比较,*P<0.05,n=3Fig. 5 The effect of knocking down ClC‐5 on cyt‐c release and Cleaved Caspase‐3 expression in MM cells. A, Western blot detection for cyt‐c releaseand Cleaved Caspase-3 expression of U266 cells; B, statistical analysis for cyt-c release and Cleaved Caspase-3 level of U266 cells; C, Western blot detection for cyt-c release and Cleaved Caspase-3 expression of ARH77 cells; D, statistical analysis for cyt-c release and Cleaved Caspase-3 level of ARH77 cells. *P<0.05 vs Control group; n=3.
讨 论
目前,MM的发病和进展机制并不完全清楚,同样MM的治疗策略也不尽人意[2,3]。阐明MM的发病与进展机制有利于今后的MM的治疗策略的制定。有研究[4-6]报道,ClC通道在MM细胞的增殖和存活中发挥着重要的调节作用。ClC-5作为ClC氯通道的关键分子,其已被发现在多种肿瘤的进展中发挥重要作用[7-9]。本研究显示,ClC-5在MM细胞中呈现特异性高表达,敲降ClC-5表达能抑制MM细胞的细胞活性并促进细胞凋亡,且不影响PBMC细胞的细胞活性,提示敲降ClC-5可能是潜在且有前景的MM的治疗策略。
本研究进一步对敲降ClC-5抑制MM细胞存活的机制进行了探索。线粒体凋亡通路是细胞凋亡通路的主要途径之一。线粒体膜电位降低,引起线粒体超极化,线粒体转运孔开放,并释放cyt-c,导致细胞中caspase-3激活,最终导致凋亡的发生[10,11]。且已有文献[12]报道,敲降ClC-5能通过线粒体通路促进谷氨酸诱导的视网膜神经节细胞凋亡。本研究结果显示,敲降ClC-5能导致MM细胞株(ARH77和U266)的线粒体膜电位降低,促进线粒体中cyt-c释放到细胞质,并促进细胞中Cleaved Caspase-3升高,表明敲降ClC-5能通过线粒体凋亡途径诱导MM细胞凋亡。
综上所述,ClC-5在MM细胞中异常高表达,敲降ClC-5能抑制MM细胞增殖并诱导凋亡,且这一作用可能与其激活线粒体凋亡通路相关。
