骨髓间充质干细胞来源的外泌体诱导巨噬细胞向M1型极化
2022-09-18刘文涛王新月杨毅文诸缦李云鹏白生宾
刘文涛,王新月,杨毅*,文诸缦,李云鹏,白生宾*
(1新疆医科大学基础医学院,乌鲁木齐, 830000;2新疆医科大学公共卫生学院,乌鲁木齐 830000;3新疆医科大学第一附属医院,乌鲁木齐 830000)
骨折是指骨结构的连续性完全或部分断裂[1,2]。骨折愈合是指骨折、截骨、关节融合和骨移植术后的自然骨连接的过程[3-5]。骨髓间充质干细胞(bone mesenchymal stem cells,BMSCs)作为一种多能干细胞,是成骨细胞的体内来源,骨髓间充质干细胞的增殖能力决定成骨分化能力[6-9]。我们的前期工作在体内植入非细胞型组织工程骨后发现充斥在组织工程骨中的细胞主要是炎症细胞,其次是迁移至炎症细胞周围的BMSCs。已有研究证明,骨折后的炎症微环境中的巨噬细胞可以使BMSCs发生定向迁移运动,即归巢效应,可以促进骨折的愈合[10-13]。炎症微环境中,BMSCs 可调控巨噬细胞炎症因子的释放,以控制炎症反应[14]。巨噬细胞可分化为具有不同的生物学特征的亚型,包括经典途径活化的 M1型巨噬细胞和替代途径活化的M2 型巨噬细胞[15-17]。我们经查阅文献并结合前期实验结果发现,BMSCs调控巨噬细胞极化并不是单一通路,而呈网状调控。外泌体是由活细胞分泌的直径约为30~150 nm的小囊泡,有通讯作用,携带有多种蛋白质、RNA等重要信息,BMSCs的外泌体可能参与这一网状调控通路[18-22]。为了验证BMSCs的外泌体可诱导巨噬细胞极化,本研究利用提取的BMSCs外泌体与巨噬细胞共培养,检测不同浓度的外泌体对巨噬细胞内吞作用和极化的影响,证明BMSCs的外泌体可诱导巨噬细胞向M1型巨噬细胞极化。
材料与方法
1 主要材料
鼠源性巨噬细胞系RAW264.7与鼠骨髓间充质细胞系CP-M131均购自武汉普诺赛生命科技有限公司;DMEM/F12、胰蛋白酶购自美国Hyclon公司;胎牛血清(FBS)、青链霉素混合液(均为100 U/ml) 购自武汉博士德生物工程有限公司;RIPA裂解液、BCA蛋白定量试剂盒购自美国Abcam公司;Trizol、逆转录试剂盒、EXOSOME外泌体提取试剂盒、RNA/蛋白提取试剂盒购自上海华盈生物公司;SYBR Green Real-time PCR试剂盒购自上海索莱宝生物公司;兔抗Alix、CD63、TSG101单克隆抗体购自美国Abcam公司;辣根过氧化物酶(HRP)标记的山羊抗兔IgG购自北京中杉金桥生物有限公司;细胞质染色试剂盒、PCR引物购自上海生工;DiI染色剂购自赛默飞世尔科技(中国)有限公司)。
2 细胞培养与处理
巨噬细胞RAW264.7与骨髓间充质干细胞CPM131常规复苏,加入含完全培养基的培养皿中,置于 37 °C , 5% CO2 恒温培养箱中培养。当巨噬细胞RAW264.7与间充质干细胞CP-M131生长至70%~80%时去除培养基并用PBS洗涤,可根据情况决定是否用0.25%胰蛋白酶消化,室温条件下1000 r/min离心5 min,弃上清,完全培养基重悬细胞后进行传代。将巨噬细胞 RAW264.7 以 2×105细胞 / 孔的密度接种在 6 孔板上孵育 24 h。
3 外泌体的分离与鉴定
取适量骨髓间充质干细胞CP-M131培养上清液,3000 g离心15 min以去除细胞及细胞碎片,转移上清至新的离心管中,置于冰上,按照外泌体提取试剂盒说明书将细胞培养上清液:试剂量(2:1)4 ℃孵育过夜后4 ℃、3000 g离心60 min,弃上清液,4 ℃预冷的PBS重悬后转移到新的1.5 ml EP管中,4 ℃、10000 g离心10 min弃上清,所得沉淀用PBS重悬后4 ℃、10000 g离心5min,取上清,所得上清即为细胞培养上清外泌体的PBS重悬液,-80℃保存备用。
4 F-actin免疫荧光染色
当巨噬细胞RAW264.7达到80%的汇合时,吸去培养基,PBS清洗2次,每次5 min,使用含3%的多聚甲醛固定细胞30 min,再次使用PBS清洗2次,每次5 min,每孔加入Alexa Fluor 488标记鬼笔环肽工作液100 µL,室温避光孵育90 min,PBS清洗细胞3次,每次10 min。免疫荧光染色后,加入100 µL DAPI染色工作液对细胞核进行复染,室温避光孵育5 min,用PBS清洗2次,每次5 min,激光共聚焦显微镜(Nikon C2+)下观察。
5 外泌体透射电镜观察
取骨髓间充质干细胞外泌体10 μL滴加到碳覆膜铜网上,样品吸附3 min,用滤纸吸去多余液体后晾干,向铜网上滴加磷钨酸染色液10 μL,避光染色5 min;用滤纸吸去多余液体,晾干后透射电子显微镜下观察并拍照。
6 外泌体示踪
当巨噬细胞RAW264.7达到80%的汇合时,将提取的外泌体用DiI染色后按30 µL/孔转移到RAW264.7细胞6孔板中。按照制造商的说明对细胞进行清洗固定,加入Alexa Fluor标记鬼笔环肽工作液染色后清洗细胞,于荧光显微镜下进行荧光观察,选择Alexa FlourTM488发射滤片。空白组细胞不进行任何处理。
7 实时荧光定量PCR(RT-qPCR)
按照Trizol法从巨噬细胞RAW264.7中提取总RNA,用分光光度计检测RNA纯度与浓度。然后使用逆转录试剂盒进行逆转录,根据试剂说明书及预实验确定的反应时间与温度进行RT-PCR。在94 ℃ 5 min预变性后,进行40个周期:94 ℃变性30 s, 94℃复性5 s,60 ℃伸展30 s。以GAPDH为内参,采用2‐∆∆Ct方法分析待测基因的 mRNA相对表达水平,至少重复3次。引物序列见表1。

表1 RT-PCR引物序列Tab.1 Primer sequences for RT-PCR
8 Western blot
应用外泌体RNA/蛋白提取试剂盒按说明书方法提取外泌体中总蛋白,使用BCA蛋白质测定试剂盒测定蛋白浓度。将等量蛋白质样品通过10% SDSPAGE凝胶电泳进行蛋白分离并转移到 PVDF 膜上,然后用含5%的脱脂奶粉的PBS封闭液于室温下封闭2 h后,分别加入抗Alix(1∶1000)、CD63(1∶1000)、TSG101(1∶1000)一抗,在4 ℃摇床孵育过夜。 TBST溶液洗涤3次(10 min/次),HRP标记的二抗(1∶10000)室温孵育2 h后用TBST溶液洗涤3次(10 min/次)。ECL化学发光试剂盒显影,通过Western blot 成像分析仪(BIO RAD,美国)进行成像。
9 统计学分析
采用 Graphpad prism 8.0 软件进行统计分析,计量资料采用均数±标准差表示,多组样本时采用单因素方差分析,P<0.05认为差异具有统计学意义。
结 果
1骨髓间充质干细胞与巨噬细胞的形态学特征
荧光显微镜观察显示,培养3~5 d后,CP-M131骨髓间充质干细胞呈不规则的长梭形,RAW264.7巨噬细胞呈圆形;F-actin在CP-M131细胞胞质内呈平行排列成纤维束,在RAW264.7细胞胞质内呈点块状浓聚(图1)。

图1 骨髓间充质干细胞及巨噬细胞形态特征和F-actin分布的免疫荧光检测。比例尺, 50 µmFig.1 Immunofluorescence examination of morphology of and F‐actin distribution in bone marrow mesenchymal stem cells and macrophage. Scale bar,50 µm
2 骨髓间充质干细胞外泌体超微结构特点与特征蛋白表达
对应用聚合物沉淀法提取的CP-M131细胞外泌体进行透射电镜观察显示,外泌体呈圆形或椭圆形,大小不均匀,直径约 200 nm,有完整的膜结构(图2A、B)。 Western blot检测显示外泌体表达特异性蛋白CD63、TSG101、Alix(图2C)。

图2 骨髓间充质干细胞源性外泌体的透射电镜检测鉴定与外泌体特异性蛋白表达检测。A,外泌体形态透射电镜检测;Lower比例尺,500 nm,Higher比例尺,200 nm。B, 外泌体中TSG101、CD63和Alix表达的Western blot检测Fig. 2 Transmission electron microscopic identification of the bone marrow mesenchymal stem cell‐ derived exosomes and Western blot detection of expression of exosome specific proteins. A, transmission electron microscopic examination of morphology of the exosomes; scale bar in Lower, 500 nm; scale bar in Higher, 200 nm. B, Western blot detection of expression of TSG101, CD63 and Alix in the exosomes
3 骨髓间充质干细胞源性外泌体被巨噬细胞内吞
将用Dil染色后的不同浓度(0 µg/mL、30µg/mL、60 µg/mL、90 µg/mL)CP-M131细胞外泌体与RAW264.7细胞共培养后,检测RAW264.7细胞对外泌体的内吞作用显示,外泌体被RAW264.7细胞内吞,外泌体浓度在60 µg/mL时,RAW264.7细胞对外泌体的内吞作用最明显(图3)。
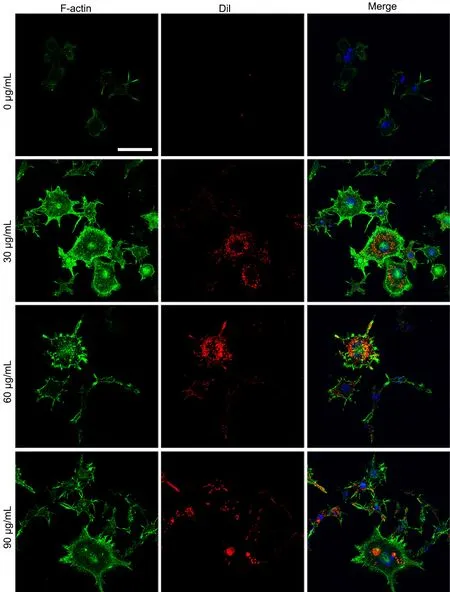
图3 不同浓度骨髓间充质干细胞源性外泌体对巨噬细胞吞噬外泌体作用的影响。F-actin染色阳性(绿色)的RAW264.7细胞胞质内可以看到多少不等的内吞的外泌体(红色)。比例尺,50 µmFig. 3 Effect of different concentrations of bone marrow mesenchymal stem cell-derived exosomes on phagocytosis of exosomes by macrophages. Different numbers of endocytic exosomes (red) seen in the cytoplasm of RAW264.7 cells with positive F-actin staining (green).Scale bar, 50 µm
4 骨髓间充质干细胞源性外泌体诱导巨噬细胞向M1型极化
应用RT-qPCR方法检测M1型巨噬细胞特异基因IL-6和iNOS与M2型巨噬细胞特异基因Arg-1和CD206的表达水平显示(图4):以不同浓度骨髓间充质干细胞源性外泌体与RAW264.7细胞共培养后,iNOS与IL-6的mRNA水平显著增加,以在外泌体浓度为60 µg/mL时增加最明显;Arg-1 mRNA表达在外泌体浓度为30 µg/mL与90 µg/mL时增加,但在外泌体浓度为60 µg/mL时降低;CD206 mRNA表达在各种浓度外泌体下均降低。
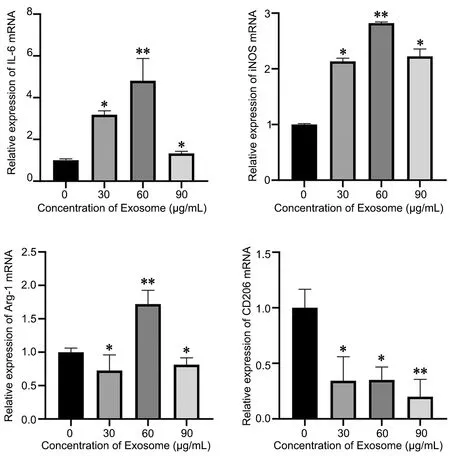
图4 不同浓度骨髓间充质干细胞源性外泌体对M1、M2型巨噬细胞特异基因表达水平影响的RT-qPCR检测。 与对照组比较:*P<0.05 ,**P<0.01Fig. 4 RT‐qPCR examination for the effect of different concentrations of bone marrow mesenchymal stem cell‐derived exosomes on specific gene expression of M1 and M2 macrophages. *P<0.05, **P<0.01, compared with control
讨 论
随着社会经济的高速发展,由各类原因引发的骨折相关疾病日益增长。骨髓间充质干细胞作为组织工程研究中最具多向分化潜能的种子细胞,近年来备受关注,成为研究热点。机体发生各种炎症反应的根本环节是巨噬细胞的激活与损伤,骨折微环境细胞中巨噬细胞起主要作用,巨噬细胞的极化参与其进展,同时又受其调控[23]。巨噬细胞在参与不同炎症的过程中,分化为具有不同生物学特征的表型。其中M1型巨噬细胞担任经典活化,可通过分泌促炎性细胞因子和趋化因子、参与正向免疫应答、发挥免疫监视的功能;而M2型巨噬细胞担任替代活化,与免疫抑制和组织修复有关,通过分泌抑制性细胞因子下调免疫应答在免疫调节中发挥重要作用[24,25]。部分研究表明,骨折微环境中骨髓间充质干细胞与巨噬细胞极化密切相关。通过表型可鉴定巨噬细胞的类型,研究巨噬细胞在不同生理和病理条件下所发挥的功能具有重要的意义[26,27]。外泌体是由活细胞分泌的直径约为30~150 nm的小囊泡,有通讯作用,携带有多种蛋白质、RNA等重要信息,可通过传递miRNA、脂质、蛋白等多种活性分子实现细胞间信息传递。经研究证实,骨髓间充质干细胞是通过旁分泌多种可溶性细胞因子而发挥免疫抑制作用,外泌体是干细胞最重要的旁分泌因子之一[28-30]。在本研究中,我们探索了骨髓间充质干细胞的外泌体对巨噬细胞极化的作用,结果表明,骨髓间充质干细胞的外泌体前期调控巨噬细胞向M1型巨噬细胞极化。
骨髓间充质干细胞的外泌体不仅有干细胞特有修复功能,而且化学性质稳定,能有效避免细胞治疗引起的免疫排斥,具有广阔的应用前景[31,32]。但关于骨髓间充质干细胞是否通过外泌体影响巨噬细胞表型仍缺乏报道。本研究首先培养了骨髓间充质干细胞与巨噬细胞,并在荧光显微镜下进行细胞形态学观察。其次,从骨髓间充质干细胞培养基中分离得到了外泌体,并通过扫描电镜、Western blot对外泌体进行鉴定。最后,观察与不同浓度骨髓间充质干细胞外泌体对巨噬细胞摄取外泌体效率的影响及巨噬细胞极化相关基因IL-6、iNOS、Arg-1、CD206表达的变化。 IL-6、iNOS是巨噬细胞向M1 型极化紧密相关的特异标志物;而Arg-1、 CD206 是广泛使用的M2型巨噬细胞特异标志物。实验结果表明:骨髓间充质干细胞外泌体处理使M1型巨噬细胞基因表达量增加, M2型巨噬细胞基因表达量总体降低。但是60 µg/mL的外泌体使M2型巨噬细胞特异基因Arg-1表达显著升高。因外泌体内包含不同的miRNA,有不同的调控作用。在我们的实验过程中,提取的外泌体内包含调控巨噬细胞由M2型极化的miRNA,因此在60 µg/ml的浓度下Arg-1表达升高。我们观察到 iNOS与IL-6表达显著增加而Arg-1、 CD206 表达减少,表明骨髓间充质干细胞的外泌体可以诱导 M1 型巨噬细胞极化并抑制 M2 型巨噬细胞极化。
综上所述,骨髓间充质干细胞的外泌体可以调控巨噬细胞向M1型巨噬细胞极化,并且抑制M2型巨噬细胞活性。本研究结果肯定了骨髓间充质干细胞的外泌体在调控巨噬细胞极化过程中的重要作用,为临床治疗骨折后炎症相关疾病提供了良好的基础,同时为巨噬细胞的表型鉴定方法提供了新的思路,具有一定的理论指导意义。
