大蒜提取物促进排便功能的研究
2022-09-16毛旭文史荣梅肖文浚张春子李新霞
毛旭文,史荣梅,肖文浚,张春子,杜 娟,李新霞
(1新疆医科大学药学院,2新疆天然药物活性组分与释药技术重点实验室,乌鲁木齐 830017,3新疆埃乐欣药业有限公司,乌鲁木齐 8300000)
便秘是指排便次数减少、排便困难、粪便干燥等。目前临床上治疗便秘常用药物有泄剂、促肠动力药(如:莫沙必利、西沙比利等)和微生态制剂(如:双歧杆菌、乳杆菌等)[1-5]。其中,泄剂包括:渗透性泄剂(如:聚乙二醇、硫酸镁等)、刺激性泄剂(如:酚酞、番泻叶等)、膨胀性泄剂(如:小麦麸皮、甲基纤维素等)和润滑性泄剂(如:甘油、石蜡油等)[6-7]。泄剂能够直接刺激结肠平滑肌,促进肠道蠕动和肠液分泌,发挥促进排便的作用。但是长期使用此类药物容易产生较大的毒副作用,导致结肠黑变、损伤肠神经系统,进一步使便秘加剧恶化[8]。大蒜自古就有对胃肠道产生有益的功效。《本草纲目》中记载大蒜“健脾胃,止霍乱,除邪祟,解瘟疫,去蛊毒,恶疮,蛇虫,溪毒”,提示大蒜具有保护胃肠道功能[9]。本研究在前期工作中发现大蒜及其主要成分蒜氨酸、大蒜辣素具有促进小鼠肠道蠕动的作用,但其促进排便的作用尚不明确。因此,本文采用洛哌丁胺建立小鼠便秘模型,研究蒜氨酸、大蒜辣素、大蒜粉的促进排便功效,分析小鼠胃激素分泌及肠神经系统递质水平变化,初步探究大蒜提取物促进排便的作用机制,为进一步开展大蒜的功效学研究提供数据支持。
1 材料
1.1 实验动物选取SPF级昆明种小鼠,雄性,体重为(20±2)g,购买于新疆医科大学动物中心。SPF级实验动物使用许可证号SYXK(新)2016-0002,每天光照12 h、黑暗12 h,温度21℃±2℃,湿度40%~45%。动物经过新疆医科大学实验动物中心伦理委员会批准。
1.2 仪器与试药电子分析天平(型号:BSA124S,北京赛多利斯天平有限公司);微量加样器(型号:VS-1300L-U,芬兰Thermo公司生产);盐酸洛哌丁胺(批号:2018120221,西安杨森制药有限公司);阿拉伯树胶(批号:2018092756,天津致远化学试剂有限公司);活性炭(批号:2018021636,天津致远化学试剂有限公司)。ELISA试剂盒:一氧化氮检测试剂盒(批号:AE90883Mu)、乙酰胆碱检测试剂盒(批号:AE90529 Hu)、P物质检测试剂盒(批号:AE90561Mu)、血管活性肽检测试剂盒(批号:AE91548Mu)、胃泌素检测试剂盒(批号:AE91392Mu)均购于上海联硕生物科技有限公司。胃动力素检测试剂盒(批号:CEP154Ma)、促胆囊收缩素检测试剂盒(批号:CEA802Ra)均购于上海桥杜生物科技有限公司。蒜氨酸(批号:20090101,蒜氨酸含量84.88%)、蒜酶(批号:201801003)、冻干蒜粉(批号:Y201811001):新疆埃乐欣药业有限公司生产。
2 方法
2.1 模型的建立给受试样品15 d后,各组小鼠禁食不禁水16 h。模型对照组、受试样品组灌胃给予盐酸洛哌丁胺悬浊液(浓度为0.5 mg/mL),空白对照组给蒸馏水。模型组与正常组相比首便时间明显增加、6 h排便粒数明显减少、6 h粪重明显减少,表明便秘模型小鼠建立成功。
2.2 动物分组及给药将220只小鼠在实验环境下适应性喂养5 d后,依据体重随机分为I、II两个大组,每大组110只小鼠,I组开展小肠运动实验,II组开展排便实验。再将I、II组小鼠分别随机分成11组:空白对照组;模型组;蒜氨酸低剂量(0.004 3 mg/g)、中剂量(0.008 6 mg/g)和高剂量组(0.017 2 mg/g);大蒜辣素低剂量(0.001 9 mg/g)、中剂量(0.003 9 mg/g)和高剂量组(0.007 8 mg/g);大蒜粉低剂量(0.110 8 mg/g)、中剂量(0.221 6 mg/g)和高剂量组(0.443 2 mg/g)。各组动物每天按体重10 g 0.1mL灌胃给药1次,连续灌胃15 d。
2.3 体重检测药物干预期间每天测量并记录小鼠体重。
2.4 小肠运动试验小肠运动实验前,小鼠禁食不禁水16 h,于测定当天各实验组、空白及模型组再给予一次受试样品或无菌水,30 min后各实验组和模型组给予盐酸洛哌丁胺(浓度为0.5 mg/mL),空白对照组给予蒸馏水,30 min后各组再给予指示剂,用5%炭粉加10%阿拉伯树胶作为指示剂。25 min后麻醉状态下颈椎脱臼处死小鼠,打开腹腔分离肠系膜,剪取幽门至回盲部的肠管,置于托盘上拉直,测量肠管长度为“小肠总长度”,测量幽门至墨汁前沿为“墨汁推进长度”。按下式计算:墨汁推进率(P)=(墨汁推进长度/小肠总长度)×100%。
2.5 排便实验
2.5.1 排便时间、粪便粒数和粪便重量测定II组动物给予盐酸洛哌丁胺30 min后,受试样品组分别给予含受试样品的墨汁灌胃后,每只小鼠均单笼饲养,正常饮食进水。从给予墨汁开始计时,观察记录每只小鼠排出首粒黑便时间、6 h内黑便粒数及重量。
2.5.2 粪便含水量的测定收集II组动物便秘模型建模后收集6 h内的新鲜粪便,立即称量,随后105℃烘干至恒重,称量其干重。计算粪便含水量。计算如式下:粪便含水量%=(粪便湿重-粪便干重)/粪便湿重×100%。
2.5.3 结肠含水率测定II组小鼠处死后,距盲肠2 cm处剪取结肠2 cm生理盐水清洗干净,滤纸吸干水分,置于EP管内称重,恒温干燥箱内,50°C干燥24 h后自然冷却,再次称重,计算结肠含水率。结肠含水量%=(结肠湿重-结肠干重)/结肠湿重×100%
2.5.4 胃肠神经递质及激素指标的测定 小鼠摘除眼球取血1.5 mL,加入含肝素试管中混匀,4℃,3 000 r/min离心15 min后,取上清液,置于-20℃冰箱中保存。复融后轻轻摇匀,4℃,3 000 r/min离心15 min后,取上清液进行测定。根据ELISA试剂盒说明书操作,测定小鼠血清一氧化氮、乙酰胆碱、P物质、血管活性肽、胃泌素、胃动力素和促胆囊收缩素含量。
2.6 统计学处理采用GraphPad软件分析,计数资料以均值±标准差(±s)表示,多组间比较采用单因素方差分析,两组间比较采用t检验,以P<0.05为差异有统计学意义。
3 结果
3.1 大蒜提取物对小鼠体重的影响实验结束后各组小鼠的体重比初始体重均呈显著增加,与空白组比较,各实验组小鼠初始体重、实验结束体重分别均无明显差异(P>0.05),见表1。
表1 大蒜提取物对小鼠体重的影响(±s ,n=10)

表1 大蒜提取物对小鼠体重的影响(±s ,n=10)
注:与空白对照组比较*P<0.05,**P<0.01。
组别空白对照组模型组蒜氨酸低剂量组蒜氨酸中剂量组蒜氨酸高剂量组大蒜辣素低剂量组大蒜辣素中剂量组大蒜辣素高剂量组大蒜粉低剂量组大蒜粉中剂量组大蒜粉高剂量组小肠运动实验初始体重/g 20.44±0.92 20.40±1.29 19.63±0.90 19.84±1.37 20.18±1.15 20.54±1.02 20.18±1.37 20.15±1.72 19.81±1.49 20.29±0.86 20.30±1.24最终体重/g 37.79±3.43 38.18±3.09 37.63±2.85 39.15±2.68 37.68±2.46 38.93±2.41 37.42±2.70 38.35±2.60 38.66±3.02 37.29±2.47 37.51±2.75排便实验初始体重/g 19.52±1.20 19.97±1.06 19.43±1.39 19.79±1.29 20.20±1.38 19.89±1.04 19.86±1.42 19.43±1.49 19.62±0.93 20.04±1.02 20.01±1.20结束体重/g 39.15±3.02 38.80±2.64 38.00±3.22 39.62±2.94 36.84±3.44 38.89±2.23 37.75±2.51 38.88±3.32 37.96±2.56 37.16±2.23 37.72±3.18
3.2 大蒜提取物对小鼠小肠推进功能的影响与空白对照组比较,模型组墨汁推进率显著降低,差异有统计学意义(P<0.01),表明小鼠给予盐酸洛哌丁胺后,便秘模型造模成功。与模型组比较,蒜氨酸(低、中、高剂量)组、大蒜辣素(低、中、高剂量)组、大蒜粉(低、中、高剂量)组小肠墨汁推进率明显增高,差异有统计学意义(P<0.01),见表2。
表2 大蒜提取物对小鼠小肠推进功能的影响(±s ,n=10)
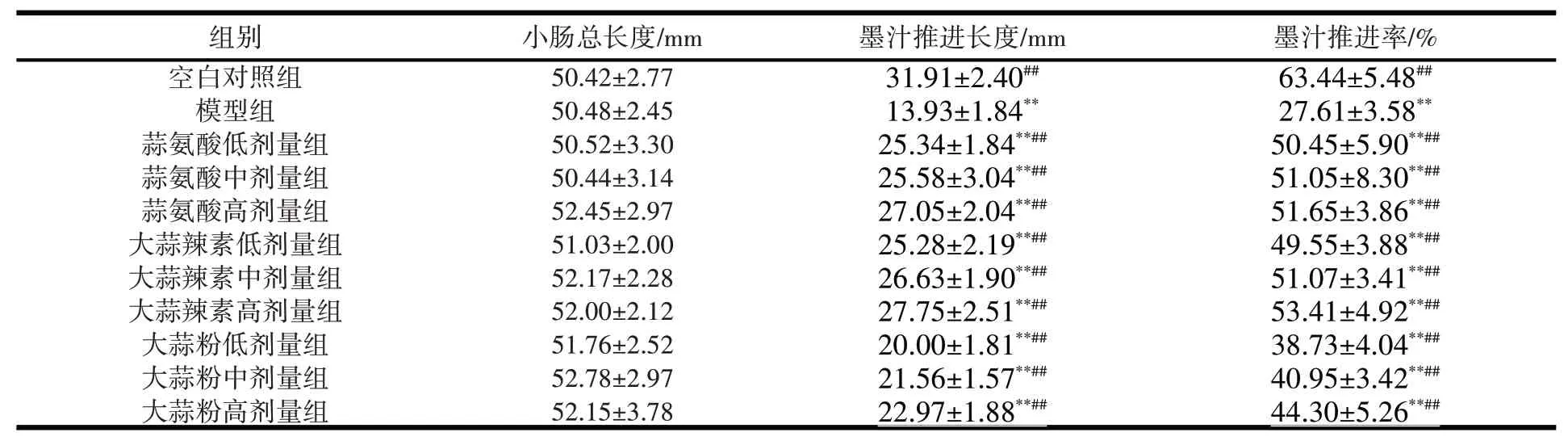
表2 大蒜提取物对小鼠小肠推进功能的影响(±s ,n=10)
注:与空白对照组比较,*P<0.05,**P<0.01;与模型组比较#P<0.05,##P<0.01。
组别空白对照组模型组蒜氨酸低剂量组蒜氨酸中剂量组蒜氨酸高剂量组大蒜辣素低剂量组大蒜辣素中剂量组大蒜辣素高剂量组大蒜粉低剂量组大蒜粉中剂量组大蒜粉高剂量组小肠总长度/mm 50.42±2.77 50.48±2.45 50.52±3.30 50.44±3.14 52.45±2.97 51.03±2.00 52.17±2.28 52.00±2.12 51.76±2.52 52.78±2.97 52.15±3.78墨汁推进长度/mm 31.91±2.40##13.93±1.84**25.34±1.84**##25.58±3.04**##27.05±2.04**##25.28±2.19**##26.63±1.90**##27.75±2.51**##20.00±1.81**##21.56±1.57**##22.97±1.88**##墨汁推进率/%63.44±5.48##27.61±3.58**50.45±5.90**##51.05±8.30**##51.65±3.86**##49.55±3.88**##51.07±3.41**##53.41±4.92**##38.73±4.04**##40.95±3.42**##44.30±5.26**##
3.3 大蒜提取物对小鼠通便功能影响与对照组相比,模型组小鼠首便时间明显延长,差异有统计学意义(P<0.01);6 h排便粒数明显减少,差异有统计学意义(P<0.01);6 h粪重明显减少,差异有统计学意义(P<0.01);表明便秘模型建立P功。与模型组比较,蒜氨酸(低、中、高剂量)组、大蒜辣素(低、中、高剂量)组、大蒜粉(低、中、高剂量)组小鼠的首便时间均明显缩短,差异有统计学意义(P<0.01);6 h排便粒数均明显增加,差异有统计学意义(P<0.01);6 h粪重明显增加,差异有统计学意义(P<0.01);说明蒜氨酸、大蒜辣素、大蒜粉能缩短便秘模型小鼠的首便时间,明显增加便秘小鼠6 h排便量和粪重,见表3。
3.4 大蒜提取物对小鼠结肠含水量影响与对照组相比,模型组粪便含水量、结肠含水量明显降低,差异有统计学意义(P<0.01);与模型组比较,蒜氨酸(低、中、高剂量)组、大蒜辣素(低、中、高剂量)组、大蒜粉(低、中、高剂量)组小鼠粪便含水量明显增加,差异有统计学意义(P<0.01);结肠含水量明显增加,差异有统计
学意义(P<0.01);说明蒜氨酸、大蒜辣素、大蒜粉能增加便秘小鼠的粪便含水量和结肠含水量,见表4。
3.5 大蒜提取物对小鼠神经递质影响与对照组比较,模型组小鼠血清中一氧化氮浓度明显升高,差异有统计学意义(P<0.01);血管活性肠肽浓度明显升高,差异有统计学意义(P<0.01);P物质浓度明显降低,差异有统计学意义(P<0.01);乙酰胆碱浓度明显降低,差异有统计学意义(P<0.01);与模型组比较,蒜氨酸(低、中、P高剂量)组、大蒜辣素(低、中、高剂量)组、大蒜粉(中、高剂量)组小鼠血清中一氧化氮浓度均下降,差异有统计学意义(P<0.01);蒜氨酸(中、高剂量)组、大蒜辣素(中、高剂量)VIP浓度均明显下降,差异有统计学意义(P<0.05);蒜氨酸(高剂量)组、大蒜辣素(高剂量)组小鼠血清中SP浓度明显升高,差异有统计学意义(P<0.05);蒜氨酸(低、中、高剂量)组、大蒜辣素(低、中、高剂量)组、大蒜粉(中、高剂量)组Ach浓均升高,差异有统计学意义(P<0.05),见表5。
表3 大蒜提取物对小鼠通便功能的影响(±s ,n=10)

表3 大蒜提取物对小鼠通便功能的影响(±s ,n=10)
注:与空白对照组比较*P<0.05,**P<0.01;与模型组比较#P<0.05,##P<0.01。
组别空白对照组模型组蒜氨酸低剂量组蒜氨酸中剂量组蒜氨酸高剂量组大蒜辣素低剂量组大蒜辣素中剂量组大蒜辣素高剂量组大蒜粉低剂量组大蒜粉中剂量组大蒜粉高剂量组首便时间/min 163.8±6.12 293.7±18.35**231.4±15.23**##213.8±22.57**##200.5±12.33**##224.9±20.55**##212.8±22.50**##201.4±14.08**##243.3±17.78**##230.1±9.09**##220.9±15.23**##6 h排便粒数/粒22.2±3.26 9.2±2.57**13.8±2.30**##17.7±1.49**##19.5±1.35*##14.4±2.07**##16.7±1.89**##19.6±1.51*##12.3±1.49**##13.2±1.48**##13.8±2.20**##6 h粪重/g 0.611±0.09 0.253±0.07**0.380±0.06**##0.487±0.04**##0.536±0.04**##0.396±0.06**##0.459±0.05**##0.539±0.04**##0.338±0.04**##0.363±0.04**##0.380±0.06**##
表4 大蒜提取物对小鼠粪便性状的影响(±s,n=10)
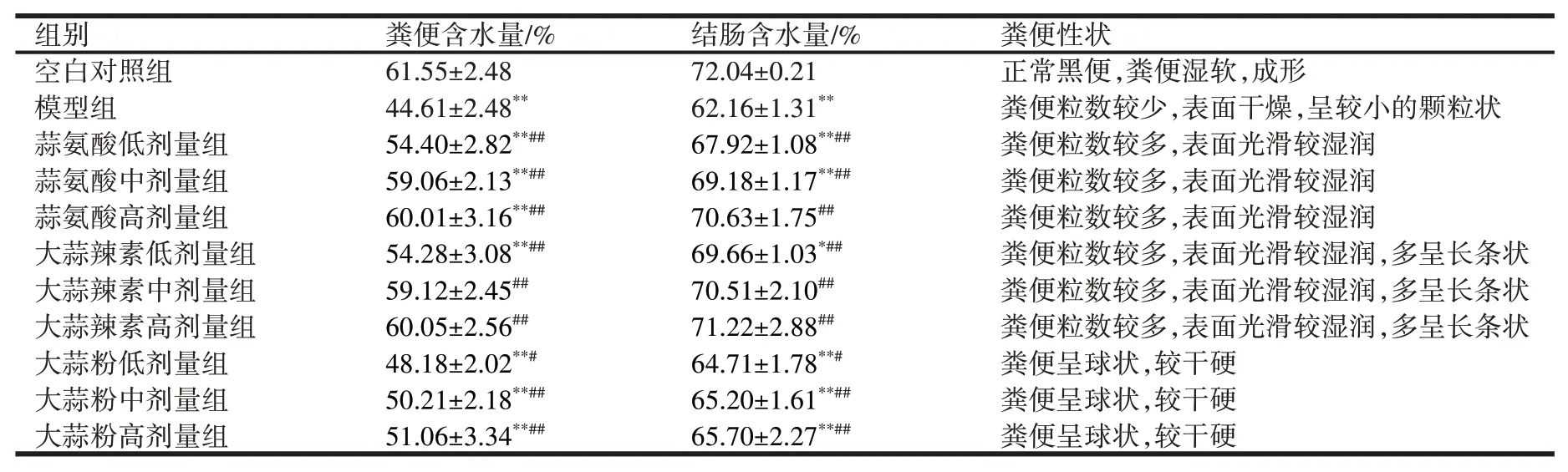
表4 大蒜提取物对小鼠粪便性状的影响(±s,n=10)
注:与空白对照组比较*P<0.05,**P<0.01;与模型组比较#P<0.05,##P<0.01。
组别空白对照组模型组蒜氨酸低剂量组蒜氨酸中剂量组蒜氨酸高剂量组大蒜辣素低剂量组大蒜辣素中剂量组大蒜辣素高剂量组大蒜粉低剂量组大蒜粉中剂量组大蒜粉高剂量组粪便含水量/%61.55±2.48 44.61±2.48**54.40±2.82**##59.06±2.13**##60.01±3.16**##54.28±3.08**##59.12±2.45##60.05±2.56##48.18±2.02**#50.21±2.18**##51.06±3.34**##结肠含水量/%72.04±0.21 62.16±1.31**67.92±1.08**##69.18±1.17**##70.63±1.75##69.66±1.03*##70.51±2.10##71.22±2.88##64.71±1.78**#65.20±1.61**##65.70±2.27**##粪便性状正常黑便,粪便湿软,成形粪便粒数较少,表面干燥,呈较小的颗粒状粪便粒数较多,表面光滑较湿润粪便粒数较多,表面光滑较湿润粪便粒数较多,表面光滑较湿润粪便粒数较多,表面光滑较湿润,多呈长条状粪便粒数较多,表面光滑较湿润,多呈长条状粪便粒数较多,表面光滑较湿润,多呈长条状粪便呈球状,较干硬粪便呈球状,较干硬粪便呈球状,较干硬
表5 大蒜提取物对小鼠神经递质的影响(±s,n=10)

表5 大蒜提取物对小鼠神经递质的影响(±s,n=10)
注:与空白对照组比较*P<0.05,**P<0.01;与模型组比较#P<0.05,##P<0.01。
组别空白对照组模型组蒜氨酸低剂量组蒜氨酸中剂量组蒜氨酸高剂量组大蒜辣素低剂量组大蒜辣素中剂量组大蒜辣素高剂量组大蒜粉低剂量组大蒜粉中剂量组大蒜粉高剂量组NO含量/(ng/L)89.92±5.61 107.49±6.03**95.65±7.26##94.39±7.67##92.76±7.15##94.96±5.82##94.04±7.89##93.18±5.07##97.94±3.49 96.72±4.03#95.13±8.11##VIP含量/(ng/L)80.09±6.61 100.81±6.68**95.54±10.99**91.29±5.89**#87.21±7.81##94.31±4.29**90.71±3.27**#86.15±4.83##98.93±5.11**97.13±4.64**96.85±5.51**SP含量/(ng/L)382.50±36.79 285.63±33.88**307.07±15.23**311.77±29.93**333.30±21.30**#315.68±18.51**327.08±18.38**357.59±40.05##294.35±20.28**309.05±27.06**324.10±34.30**Ach含量/(ng/L)84.24±5.38 65.39±5.68**76.61±7.01##80.38±7.02##81.65±5.65##74.37±4.45*#79.95±7.04##81.47±6.84##74.04±3.45**#76.16±5.28##79.60±4.19##
3.6 大蒜提取物对小鼠胃泌素、胃动力素和促胆囊收缩素的影响与对照组比较,模型组小鼠血清中胃泌素、胃动力素和促胆囊收缩素均显著降低,差异有统计学意义(P<0.01);与模型组比较,蒜氨酸(低、中、高剂量)、大蒜辣素(低、中、高剂量)、大蒜粉(低、中、高剂量)小鼠胃泌素、胃动力素和促胆囊收缩素均显著升高,差异有统计学意义(P<0.01),见表6。
表6 大蒜提取物对大鼠胃泌素、胃动力素和促胆囊收缩素的影响(±s,n=10)
注:与空白对照组比较*P<0.05,**P<0.01。
组别空白对照组模型组蒜氨酸低剂量组蒜氨酸中剂量组蒜氨酸高剂量组大蒜辣素低剂量组大蒜辣素中剂量组大蒜辣素高剂量组大蒜粉低剂量组大蒜粉中剂量组大蒜粉高剂量组胃泌素/(ng/L)8.72±0.67 5.28±0.31**6.69±0.31**##6.72±0.38**##6.86±0.43**##6.59±0.33**##6.67±0.40**##6.88±0.38**##6.55±0.36**##6.65±0.42**##6.66±0.35**##胃动力素/(ng/L)108.83±10.31 60.67±4.17**73.33±4.57**##76.33±5.05**##77.15±5.53**##74.74±7.25**##76.92±4.63**##78.23±4.91**##72.55±7.07**##75.47±3.42**##76.82±4.33**##促胆囊收缩素/(ng/L)57.10±3.73 31.90±4.01**40.56±3.59**##41.41±2.47**##42.95±3.07**##41.43±3.95**##42.08±2.95**##43.12±2.53**##40.04±2.56**##41.21±1.49**##42.01±2.41**##
4 讨论
根据《保健食品检验与评价技术规范》中通便功能检验方法要求进行试验[10],在便秘模型成立的前提下,受试样品组小鼠的首粒排便时间明显短于模型对照组,即可判定该项指标结果阳性;6 h内排便粒数明显高于模型对照组,可判定该项目指标结果阳性;6 h内排便重量明显高于模型对照组,可判定该项目指标结果阳性。6 h内黑便粒数或6 h内黑便重量任一项结果阳性,同时小肠运动实验和首粒排黑便时间任一项结果阳性,可判定该项实验结果阳性。本实验给予小鼠盐酸洛哌丁胺灌胃后,与对照组比较,模型组小鼠小肠墨汁推进率显著降低,首粒黑便时间显著延长,排粪便粒数减少,粪便重量降低,说明便秘模型造模成功。经灌胃给予小鼠不同剂量的蒜氨酸、大蒜辣素、大蒜粉后,均明显增加小肠墨汁推进率,缩短其首粒黑便时间,同时增加其6 h内粪便粒数、粪重量、粪便含水量、结肠含水量。实验结果说明大蒜提取物蒜氨酸、大蒜辣素可以促进小鼠肠道蠕动,增加便秘小鼠排便量,提高排便频率,改善粪便性状,使粪便水分增多,呈光滑软便。实验过程中,未对小鼠的正常生长造成影响。
便秘的发病机制尚不明确,可能是结肠壁神经递质异常引起。肠神经递质主要包括兴奋性和抑制性两类神经递质。兴奋性神经递质主要包括:乙酰胆碱(acetylcholine,Ach)、P物质(substance P,SP)等;抑制性神经递质主要包括:一氧化氮(nitric oxide,NO)、血管活性肠肽(vasoactive intestinal peptide,VIP)等[11-13]。Ach激动胃肠道细胞M受体,兴奋平滑肌,增加胃肠道蠕动[14]。P物质最早发现其有降血压作用,现在研究发现P物质通过抑制胃酸分泌,刺激胃蛋白酶分泌,促进胃肠道环形肌和纵形肌收缩,刺激肠道蠕动[15]。VIP通过直接作用于胃肠道平滑肌VIP受体,减少胃肠黏膜分泌液体,抑制胃肠道平滑肌收缩,减缓胃肠运动[16]。NO主要参与调节肠道动力、肠黏膜血流分布及肠液分泌,松弛肠道平滑肌,减少结肠运动节律[17]。本实验结果表明蒜氨酸(低、中、高剂量)、大蒜辣素(低、中、高剂量)和大蒜粉(中、高剂量)可以降低便秘小鼠血清中NO、VIP浓度,增加Ach、SP浓度,通过调节肠神经递质兴奋胃肠道平滑肌,加快胃肠道蠕动速度,改善粪便性状,促进排便。
胃泌素(Gastrin,GAS)由胃窦部和小肠上部G细胞分泌的重要胃肠道激素,通过刺激胃酸和胃蛋白酶分泌,增加胃血流量,刺激胃肠运动,促进胃排空[18]。胃动力素(motilin,MTL)能够促进胃肠道运动,与特异性受体结合后,在消化期Ⅲ相时,可提高胃肠道平滑肌、胆道以及小肠收缩力,促进胃排空[19]。促胆囊收缩素(cholecystokinin,CCK)能够促进胆囊收缩、抑制胃酸分泌,促进胃及空肠蠕动,增加结肠动力[20]。本实验结果表明便秘小鼠灌胃蒜氨酸、大蒜辣素、大蒜粉15 d后,与模型组比较,蒜氨酸(低、中、高剂量)、大蒜辣素(低、中、高剂量)和大蒜粉(低、中、高剂量)的胃泌素、胃动力素和促胆囊收缩素均显著升高(P<0.01),说明蒜氨酸、大蒜辣素和大蒜粉通过增加胃泌素、胃动力素及促胆囊收缩素的分泌,促进消化液分泌,增强胃肠蠕动。
