解偶联蛋白2在七氟醚后处理心肌保护作用中的机制研究
2022-09-16雷彦燕刘欣蕊吴建江
蒋 进,雷彦燕,陈 宇,刘欣蕊,吴建江
(新疆医科大学第一附属医院麻醉科,乌鲁木齐830054)
缺血再灌注损伤(Ischemia-reperfusion injury,I/R)分为缺血和再灌注两个过程:在长时间的缺血后,细胞的代谢产物蓄积,引起代谢性酸中毒;当血供重新建立时,局部炎症和活性氧自由基(Reactive oxygen species,ROS)的产生增加,导致更加严重的继发性损伤,它与紧急的临床表现相关,包括心肌抑制和急性心力衰竭[1]。七氟醚后处理(Sevoflurane postconditionning,SPostC)在早期研究中具有明确的心肌保护作用,特别是在缺血缺氧状态下,可以稳定线粒体质子流来对抗缺血再灌注损伤[2]。解偶联蛋白2(Uncoupling protein 2,UCP2)是存在于线粒体内膜部分的一种线粒体转运蛋白,被认为是稳定线粒体质子流的关键调节因子[3]。近期研究表明,UCP2可以防止线粒体超极化和活性氧自由基形成[4]。研究也证实UCP2通过抑制线粒体活性氧的产生而在代谢性疾病和脓毒血症中起到保护作用[5],但是UCP2能否保护在体心肌I/R损伤,目前尚不明确。本研究通过建立在体小鼠缺血再灌注损伤模型,探讨UCP2在小鼠SPostC心肌I/R损伤中的作用及影响。
1 材料与方法
1.1 主要实验药品、试剂、抗体和仪器设备2%戊巴比妥钠(泰瑞尔生物技术有限公司)、TTC染色液(Sigma,美国)、伊文思蓝(Evans blue)染色剂(中科瑞泰生物有限公司,北京)、吸入麻醉剂七氟醚(Maruishi Pharmaceutical公司,日本),活性氧试剂盒(南京建成,中国),山羊抗小鼠IgG H&L(HRP),Abcam,ab205719。山羊抗兔IgG H&L(HRP),Abcam,ab205718。beta-actin Loading Control antibody Mouse MAb,义翘神州,100166-MM10。UCP2(D1O5V)Rabbit mAb#89326,CST,89326S。H-600型透射电镜(日立公司,日本),小动物超声成像系统,Vevo 3100 Imaging System和超声数据图形软件购自日本Fujifilm Visualsonics有限公司。所有药品、试剂、抗体在有效期内,按操作说明进行。
1.2 实验动物及分组选取45只健康C57B/L6雄性小鼠,体重平均(25±5)g,8周龄;实验动物由新疆医科大学动物实验中心提供,饲养和操作遵守动物伦理委员会有关动物实验的规定。按照随机数字表法分成3组,假手术组即sham组、缺血再灌注组即I/R组、缺血再灌注+七氟醚后处理组即I/R+SPostC组,各15只。手术前后均在动物实验中心按标准流程饲养,在温度控制的动物房进行12 h光照、12 h的黑暗循环。
1.3 动物模型制备小鼠手术前8 h禁食、禁饮,手术前剃毛备皮后转运到动物操作平台经腹腔注射2%戊巴比妥钠40 mg/kg。I/R组小鼠麻醉后固定于实验台,行经口气管插管,后接小动物专用呼吸机。沿胸骨左缘2~3 mm切口分离胸肌后,经第4肋间离断肋骨,充分暴露小鼠心脏。撕开心包,以无创小圆针穿6-0丝线,在左心耳下2 mm处进针,穿过冠脉左降支下方的心肌层,用缝线将两端引出硅胶套管,收紧结扎线,接着持续缺血30 min,松开结扎线,即为再灌注,再灌注时间为1 h。而I/R+SPostC组小鼠再灌注开始时给予1MAC(最低肺泡有效浓度)即2.4%浓度的七氟醚,持续15 min后,继续再灌注45 min。sham组戊巴比妥钠麻醉后仅切皮缝合处理。
1.4 心功能指标检测利用小动物超声成像系统Vevo 3100 Imaging System对心功能进行评估,采用M-型超声连续扫描收集图像,通过Vevo LAB软件分析图像获取心功能指标,手术前及手术后24 h主动脉内径(Aortic diameter,AoD)和左室射血分数(Left ventricular ejection fractions,LVEF)%,分别计算手术前后主动脉内径变化率和左室射血分数变化率,(术前数据-术后数据)/术前数据×100%,结果为变化率。
1.5 TTC+Evans Blue染色法测定心肌梗死面积从每组中随机取5个小鼠心脏,冠脉注射Evans blue染色液,蓝色染色区域为正常心肌,未染色区域为缺血梗死区域,经过TTC染色、固定拍照后采用ImagePro-Plus6.0软件进行分析,测定并计算梗死面积,心肌缺血面积=缺血面积(AAR)/左心室面积(LV),用AAR/LV%表示;心肌梗死面积=梗死面积(IS)/缺血面积(AAR),用IS/AAR%表示。
1.6 HE染色从每组中随机选取5个小鼠心脏,对新鲜心脏组织进行切块、固定、脱水、包埋、切片。将切片放入苏木精水溶液中染色,酸水及氨水中分色,酒精脱水,然后酒精伊红染色液染色,最后进行脱水透明和封固。显微镜(×40、×100、×200、×400)观察心肌组织结构。
1.7 透射电镜观察线粒体结构从每组中随机选取5个小鼠心脏,每个心脏取1 mm×1 mm×1 mm的左心室,经固定、冲洗、脱水、包埋、染色、切片后在透射电镜下(×10 000)观察心肌线粒体结构。
1.8 ROS测定收集3组小鼠心肌组织上清培养液,检测各组上清培养液中ROS产生率,步骤均完全按照试剂盒和仪器说明书进行。
1.9 蛋白质印迹法(Western blot)分析提取30μg蛋白样品,十二烷基硫酸钠-聚丙烯酰胺凝胶(SDSPAGE)电泳后转膜,采用恒压转膜。一抗使用UCP2(D1O5V)Rabbit mAb #89326及beta-Actin Loading Control antibody Mouse MAb抗体,稀释比例为1∶1 000,4℃孵育过夜。二抗使用山羊抗小鼠IgG H&L(HRP)、山羊抗兔IgG H&L(HRP),稀释比例分别为1∶15 000和1∶5 000。室温孵育1 h,漂洗显色,用ChemiScope mini化学发光仪检测、拍照。
1.1 0统计学分析应用SPSS 26.0软件对数据进行统计学分析,计量资料以(±s)表示,组间比较采用两独立样本t检验,多组间数据比较采用单因素方差分析,P<0.05为差异有统计学意义。
2 结果
2.1 3组小鼠心功能指标比较sham组小鼠手术前后主动脉内径(AoD)变化率和左室射血分数(LVEF)变化率明显小于I/R组和I/R+SPostC组(P<0.05),I/R+SPostC组主动脉内径变化率和左室射血分数变化率低于I/R组(P<0.05)。见表1。
表1 3组小鼠心功能指标比较(±s,%)

表1 3组小鼠心功能指标比较(±s,%)
注:与sham组比较,*P<0.05;与I/R组比较,△P<0.05。
指标AoD变化率LVEF变化率sham组14.55±1.05 13.35±0.98 I/R组26.99±1.64*33.80±2.11*I/R+SPostC组19.76±1.01*△27.52±1.74*△F 53.48 234.79 P 0.000 0.000
2.2 3组小鼠心肌梗死面积比较sham组的心肌缺血面积(AAR/LV%),心肌梗死面积(IS/AAR%)均低于I/R组,差异有统计学意义(P<0.05)。I/R+SPostC组AAR/LV%和IS/AAR %低于I/R组,差异有统计学意义(P<0.05)。见表2。
2.3 3组小鼠显微镜下心肌组织结构比较sham组小鼠心肌组织排列较规整,局灶紊乱,少量心肌细胞肿胀,心肌纤维断裂。I/R组小鼠心肌组织排列紊乱,心肌细胞肿胀,空泡变性,部分心肌纤维断裂,少量慢性炎细胞浸润。I/R+SPostC组与I/R组比较,小鼠心肌组织排列紊乱、心肌细胞肿胀、心肌纤维断裂及炎细胞浸润程度均减轻。见图1。
表2 3组小鼠心肌缺血梗死面积比较(±s,%)
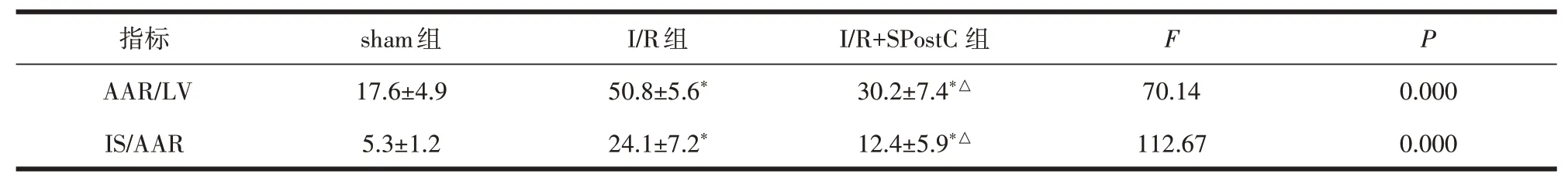
表2 3组小鼠心肌缺血梗死面积比较(±s,%)
注:与sham组比较,*P<0.05;与I/R组比较,△P<0.05。
指标AAR/LV IS/AAR sham组17.6±4.9 5.3±1.2 I/R组50.8±5.6*24.1±7.2*I/R+SPostC组30.2±7.4*△12.4±5.9*△F 70.14 112.67 P 0.000 0.000
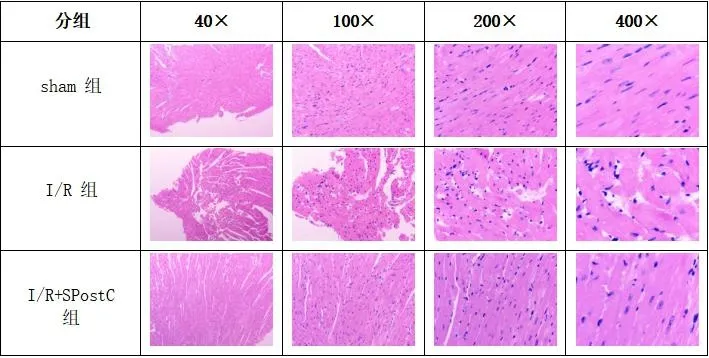
图1 3组小鼠显微镜下心肌组织结构
2.4 3组小鼠透射电镜下线粒体结构比较sham组线粒体嵴膜、肌丝完整,基质均匀,内质网呈管状排列;I/R组线粒体肿胀,肌丝断裂溶解,嵴膜间隙范围扩大,肌浆网高度扩张;I/R+SPostC组线粒体形态基本完整,轻度肿胀,肌丝少量溶解。见图2。
2.5 3组小鼠ROS生成水平比较I/R组ROS产生率(12.60±1.87)u·s-1·mg-1高于sham组(6.47±0.78)u·s-1·mg-1,差异有统计学意义(P<0.05)。I/R+SPostC组ROS产生率(7.11±0.71)u·s-1·mg-1低于I/R组,差异有统计学意义(P<0.05)。
2.6 3组小鼠UCP2蛋白表达水平比较sham组的UCP2表达水平(0.387±0.058)低于I/R组的(0.481±0.031)和I/R+SPostC组(0.618±0.013),差异有统计学意义(P<0.05);与I/R组相比,I/R+SPostC组UCP2表达进一步增高,差异有统计学意义(P<0.05)。
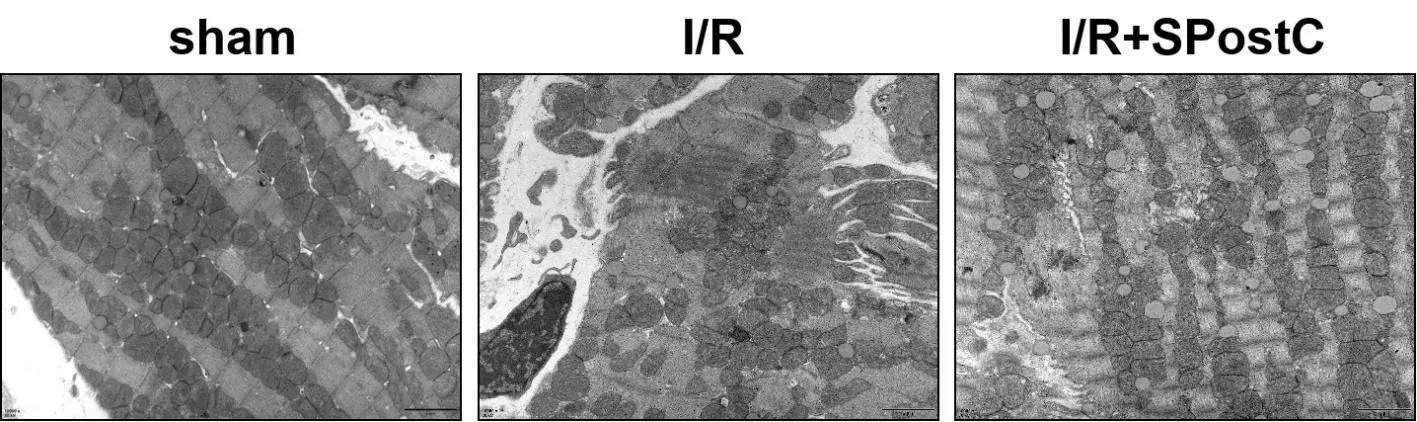
图2 3组小鼠透射电镜下线粒体结构图(×10 000)
3 讨论
本课题组前期研究表明,七氟醚后处理通过上调缺氧诱导因子-1α/巨噬细胞移动抑制因子(HIF-1α/MIF)信号轴减轻了心肌细胞的缺氧/复氧损伤[6],通过调节缺氧诱导因子-1α/Bcl-2/E1B-19kDa相互作用蛋白3(HIF-1α/BNIP3)信号通路促进线粒体自噬[7],减轻心肌细胞I/R损伤,基于细胞实验和离体实验的结论,本次实验考虑使用更加接近生理状态的在体实验,为下一步开展基础和临床研究提供更加准确的信息。本实验结果显示,I/R组的小鼠心功能大幅降低,心肌缺血和梗死面积明显增加,细胞和线粒体结构破坏严重,证实小鼠在体I/R心脏模型的制备是成功的,sham组作为对照组,明显优于I/R组,符合预期结果,I/R+SPostC组较I/R组明显改善,证明使用1MAC即2.4%的七氟醚后处理15 min的小鼠心肌缺血再灌注损伤减轻。
在本实验中,I/R组小鼠模型的细胞和线粒体结构明显破坏,细胞和线粒体肿胀,符合之前关于缺血再灌注损伤的研究结果。研究表明,长时间缺血后再灌注有可能在缺血组织中诱发后续的组织和细胞损伤,动脉血流的阻塞会导致缺氧,腺嘌呤核苷三磷酸(ATP)的产生减少,能量供应不足,会导致无氧代谢和乳酸堆积,再灌注阶段是动态的,可能持续数天。无氧代谢导致细胞中抗氧化剂水平降低,从而加快ROS的产生,ROS引起氧化应激,内皮细胞功能障碍,导致细胞结构受损和死亡[8]。这可能是再灌注损伤往往比缺血本身损伤更严重的一个重要原因,而且再灌注损伤程度和缺血时间长短呈正相关。本实验中经过七氟醚后处理的I/R+SPostC组,从宏观上看,心功能、心肌缺血和梗死面积明显改善,在微观上细胞和线粒体结构破坏也减轻,ROS的产生也减少,和研究团队之前的细胞和离体动物模型一样,在体小鼠模型中七氟醚也产生了正向的作用,但具体原因仍未完全阐明,在一项志愿者试验中发现七氟醚具有血管舒张特性,已知可降低冠状动脉血管阻力,从而产生心肌保护作用[9]。但通过本实验研究者提出了一个新的看法,SPostC发挥心肌保护作用可能是因为稳定了线粒体膜电位从而减少ROS的产生。
UCP2是一种位于线粒体内膜的离子/阴离子转运蛋白,具有重要的线粒体功能调控作用。UCP2的解偶联在线粒体/细胞水平上的表现为:(1)降低线粒体膜电位;(2)加速线粒体呼吸;(3)导致细胞的氧化状态降低;(4)减少了线粒体活性氧的产生[10]。UCP2在多种组织中表达,抑制线粒体活性氧簇ROS的产生,从而产生心肌保护作用,被认为是一种抗氧化剂[11]。Ding等[12]发现UCP2可通过改善线粒体功能障碍、抗炎和抗氧化活性,保护脂多糖诱导的急性肾损伤,最终抑制小管上皮细胞凋亡,增加线粒体中UCP2的含量是脓毒性急性肾损伤新的治疗途径。之前的研究都证实UCP2在代谢性疾病、脓毒血症、急性肾损伤、心肌抗氧化方面的保护作用,但是没有明确UCP2在在体动物I/R损伤中的作用,本实验中,I/R组UCP2蛋白表达增加,以往的研究也证实缺血缺氧会导致ROS的升高,激活UCP2的表达上调[13],这和本实验的研究结果一致,但是本实验中I/R+SPostC组UCP2表达进一步增高,结合之前已经证明的七氟醚的心肌保护作用,和本实验中对心功能和线粒体结构的改善以及ROS产生的减少,可以得出结论:UCP2可能在七氟醚后处理的心肌保护中发挥了重要的正向作用。以往的多项研究表明UCP2在线粒体ROS形成减少、β细胞胰岛素分泌负调节和游离脂肪酸代谢调节中起重要作用,开发调节UCP2活性的药物可能成为治疗心肌缺血再灌注的一种策略[14-15]。本实验作为SPostC调控糖尿病心肌线粒体质子流的分子机制研究的一项前瞻性研究,下一步计划进一步阐明UCP2的表达在糖尿病患者心肌保护中的作用。
综上所述,UCP2在缺血再灌注的小鼠中使用七氟醚后处理后表达量明显上升,UCP2是线粒体质子流相关蛋白的重要一种,七氟醚通过增加UCP2的表达,调控线粒体质子流,继而抑制ROS的产生,促进了对小鼠缺血再灌注心肌的保护,这是七氟醚后处理产生心肌缺血再灌注损伤保护作用的一种线粒体质子流相关蛋白的分子机制,为围术期的心肌保护提供了一种策略和科学依据。
