香茅挥发油提取工艺优化及抗氧化、抑真菌活性研究
2022-09-15王佳丽张晓南熊婷婷牛亚倩张英迪
王佳丽 张晓南 熊婷婷 牛亚倩 张英迪 徐 福
(东北农业大学,黑龙江 哈尔滨 150030)
香茅草[Cymbopogoncitratus(DC.) Stapf],别名包茅或柠檬草,是多年生禾本科香茅属草本植物[1]。香茅草常被作为调味料出现在亚洲人的餐桌上[2]。此外,香茅草也被广泛用于民间偏方,中国云南傣族人将香茅草烘干代茶饮,健胃消脂,治疗腹泻[3];美国和巴西等国家利用香茅草驱蚊、治疗发热和焦虑症以及清热解毒等[4]。现代研究证实,香茅草中具有多种大分子活性物质,其中挥发油在临床具有多种药理活性,含有丰富的活性成分,特别是橙花醛和香叶醛,它们具有很好的抗菌功效,对真菌的生长均有抑制作用[5-6];一些烯烃类、酯类和醛类物质具有抗氧化效果[7],可以作为天然抗氧化剂添加到食品中[8];此外,从香茅挥发油中检测出了波旁烯和榄香烯两种活性成分,已证实该成分具有抗肿瘤的效果[9-10]。
近年比较常见的天然植物挥发油提取方法包括水蒸气蒸馏法[11]、超临界CO2萃取法[12]、索氏提取法[13]、微波辅助法[14]等。但这些传统方法都有一定的缺陷:水蒸气蒸馏法使用设备简单,但提取率很低[15];索氏提取法的提取率高,但要加入挥发性有毒试剂,具有污染性和潜在危害[15];超临界CO2萃取法能保护有效成分,但需要高压设备,投资大[16]。而微波辅助提取法可以利用微波在极短的时间内提高热能的传递性,缩减加热梯度,具有提取时间短、节能、操作简单等优点[14]。近年来,已有学者[17]将微波法用于辅助香茅草挥发油提取,但是由于单因素水平选取差异,使得试验条件和结果达不到预期效果,出现最佳微波时间和液料比过大的问题,造成了能源的浪费。
研究拟采用微波辅助水蒸馏法提取香茅挥发油,利用GC-MS对香茅挥发油富含的化学成分进行分析,并对香茅挥发油的抗氧化及抑制假尾孢真菌活性进行探究,以期为挥发油产业的开发提供新思路。
1 材料与方法
1.1 材料与仪器
香茅草:采购于广西壮族自治区的玉林山农户;
去离子水:东北农业大学;
正己烷:色谱纯,天津市光复科技发展有限公司;
无水硫酸钠:纯度≥99%,天津市福晨化学试剂厂;
假尾孢菌:东北农业大学张晓南老师团队于水果表皮中分离鉴定;
电子天平:JA2003型:上海浦春计量仪器有限公司;
酶标仪:SpectraMax i3x型,东北农业大学;
气相色谱质谱联用仪:Agilent 7890A-5975C型,安捷伦科技有限公司;
精密量具游标卡尺:GREENER型,烟台市绿林工具有限公司;
循环水多用真空泵:SHB-D-Ⅲ型,河南省泰斯特仪器有限公司;
电热恒温鼓风干燥箱:DHG-9240A型,上海一恒科技有限公司;
旋转蒸发仪:RE52CS型,上海亚荣生化仪器厂;
微波炉:M1-L213B型(180~700 W),广东美的厨房电器制造有限公司;
恒温水浴锅:B-220型,上海亚荣生化仪器厂。
1.2 试验方法
1.2.1 香茅挥发油的制备 将50 g的干香茅条和一定量的去离子水混合于装置中加热,初始温度为25 ℃,大约30 min后产生挥发油。每隔一定时间记录一次挥发油读数,测定挥发油含量,使用无水硫酸钠干燥挥发油,4 ℃保存备用,采用GC-MS测定并统计挥发油的化学成分。
1.2.2 挥发油提取工艺优化 根据前期预试验结果,以液料比、微波功率和提取时间为自变量,以挥发油得率为响应值,采用Design-Expert 8.0软件对挥发油提取工艺条件进行优化。因子编码及水平见表1。
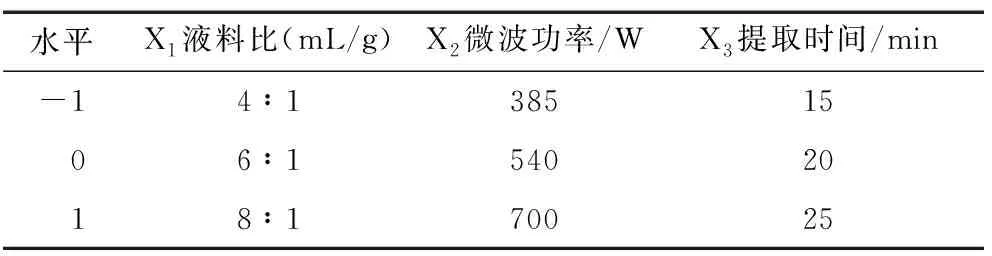
表1 响应面试验设计因素和水平Table 1 Factor and levels in response surface analysis
1.2.3 香茅挥发油成分分析 采用气相色谱—质谱联用(GC-MS)法[18]。检测前,挥发油用正己烷稀释50倍。采用Agilent 7890A气相色谱Agilent MSD5975C质谱检测器,使用HP-5MS色谱柱(30 m×0.25 mm,0.25 μm),样品注入量1 μL,喷射器温度250 ℃,电子电离能70 eV,质量范围40~400(m/z)。从60 ℃ 以3 ℃/min的速度升温到250 ℃,持续10 min。采用色谱结合火焰离子化检测器(GC-FID),载气为氮气(恒定流量1 mL/min,纯度99.999%),进样器和检测器温度均为250 ℃,采用单个峰面积除以所有峰总面积计算相对比例,不考虑响应因子;只包括超过0.1%的化合物。小于0.1%的峰值未计算在内。
1.2.4 抗氧化活性研究
(1) DPPH自由基清除能力:配制0.05 mg/mL的紫色DPPH无水乙醇溶液,根据紫色褪色程度判定挥发油中氢原子或电子得失能力,测定挥发油对DPPH自由基的影响。每个浓度样品溶液与DPPH乙醇溶液1∶1混合均匀,室温避光静置30 min,在517 nm处测定吸光度,上述试验重复3次取均值;将样品溶液替换为等量乙醇溶液作为空白对照;以与样品溶液同浓度梯度VC溶液作为阳性对照[19]。按式(1)计算DPPH自由基清除率。
(1)
式中:
C——DPPH自由基清除率,%;
A0——DPPH与乙醇混合溶液吸光度值;
A1——DPPH与样品混合溶液吸光度值;
A2——乙醇与样品混合溶液吸光度。
(2) ABTS自由基清除能力:ABTS无水乙醇溶液呈天蓝色,其褪色程度可判断挥发油的抗氧化能力,抗氧化能力越强则最大吸收波长734 nm处测得的吸光度值越小。将溶液与ABTS溶液以1∶9混合避光静置10 min进行测定Ai;将溶液替换为乙醇作为空白对照A0;以与样品溶液同浓度梯度VC溶液为阳性对照。按式(2)计算ABTS自由基清除率。
(2)
式中:
C——ABTS自由基清除率,%;
A0——乙醇与样品混合溶液吸光度值;
A1——ABTS与样品混合溶液吸光度值;
A2——ABTS与乙醇混合溶液吸光度值。
(3)β-胡萝卜素漂白试验:将0.2 mg 的β-胡萝卜素、20 μL亚油酸和200 μL吐温-20依次溶解于200 μL氯仿溶液中并混合均匀,在40 ℃旋转蒸发去除氯仿,再加入50 mL无水乙醇溶解即得到β-胡萝卜素—亚油酸体系;样品与β-胡萝卜素—亚油酸溶液按1∶4混合均匀,水浴一定时间,在470 nm处测定抗氧化活性;以同浓度梯度的BHT溶液代替样品溶液测得阳性对照结果[20]。按式(3)计算自由基清除率。
(3)
式中:
C——亚油酸氧化抑制率,%;
A样品,0、A对照组,0——t=0时样品溶液和对照组的吸光度值;
A样品,2 h、A对照组,2 h——t=2 h时样品溶液和对照组的吸光度值。
1.2.5 假尾孢菌菌株分离及培养 操作过程在超净工作台中进行,使用超净工作台前需用75%酒精棉擦拭工作台,并用紫外灯照射30 min,准备酒精灯并将试验用具灭菌放入超净工作台内。将冷冻的番石榴上的腐烂部位切割成块状(10 mm×10 mm)研磨,加入到生理盐水中震荡30 s,梯度稀释至105~107CFU/mL,取样品100 μL均匀涂抹到固体培养基中,密封置于26 ℃恒温培养箱中培养48 h,显微镜下观测真菌形态。
1.2.6 MIC和MBC的测定 根据文献[21],修改如下:将不同浓度的挥发油溶液加入到含培养基的平板中,使得培养基中所含挥发油最终质量浓度分别为3.0,2.5,2.0,1.5,1.0,0.5 μg/mL,混匀注入培养皿中,待培养基凝固后,使用打孔器将培养好的菌饼切割成直径为4 mm的圆饼,放置在培养基中心位置,26 ℃下培养1~5 d,观察菌体生长情况。对挥发油的每一浓度梯度做3组平行试验,从无菌生长的培养基中找到挥发油浓度最小的培养基,即为该挥发油的最低抑菌浓度,以0.1%的吐温-80水溶液作为对照。参考最低抑菌浓度试验结果,制备浓度大于MIC的挥发油加入到液体培养基中,26 ℃培养3 d,对澄清和较为澄清的试管进行涂板,26 ℃培养2~5 d,以无菌落生长的挥发油浓度为最低杀菌浓度。
2 结果与分析
2.1 挥发油提取工艺优化
根据因素水平设计L9(34)试验见表2。利用Box-Behnken设计原理并采用Design-Expert 8.0软件对表2试验数据进行多元回归拟合,得到各因子对响应值的二次多项回归模型:
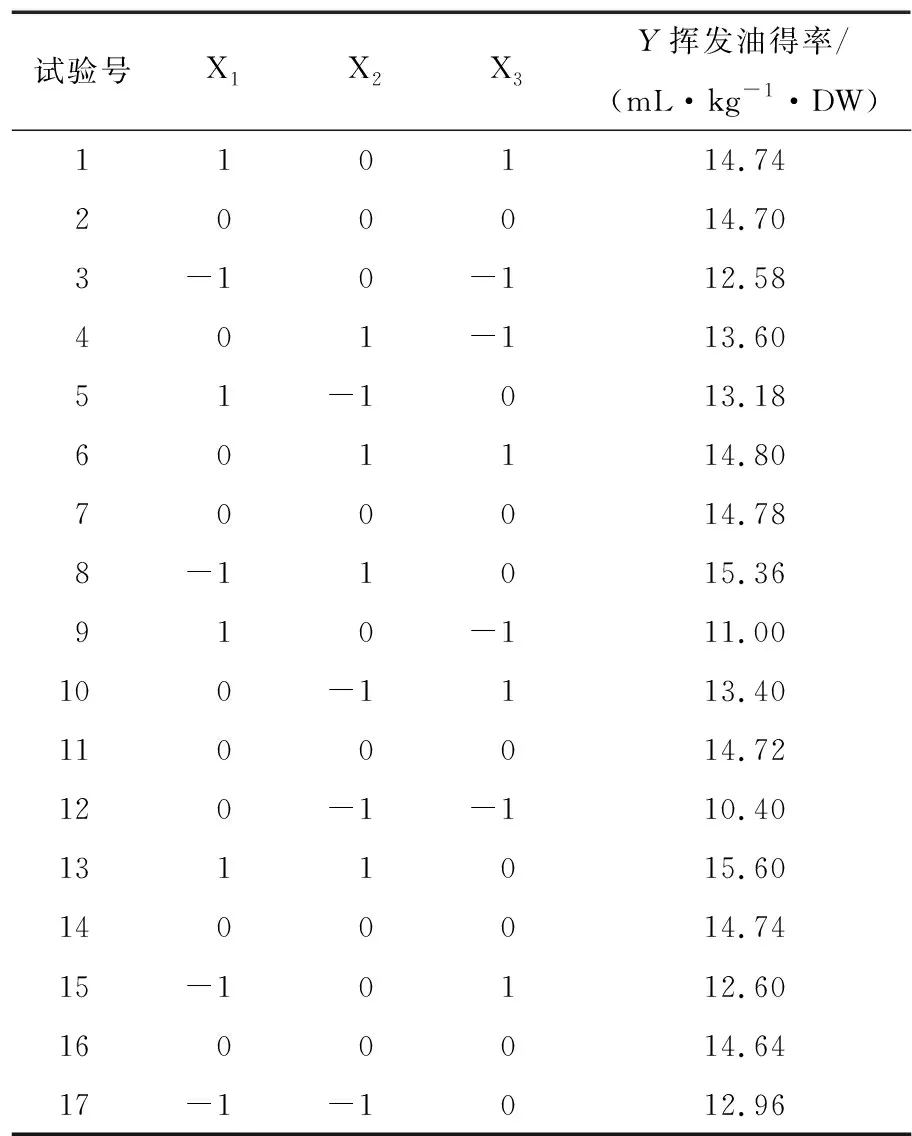
表2 响应面法试验设计及结果 Table 2 Response surface methodology tests and results
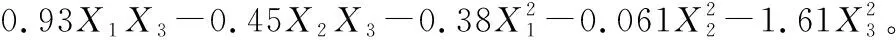
(4)
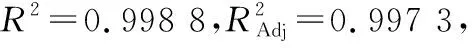
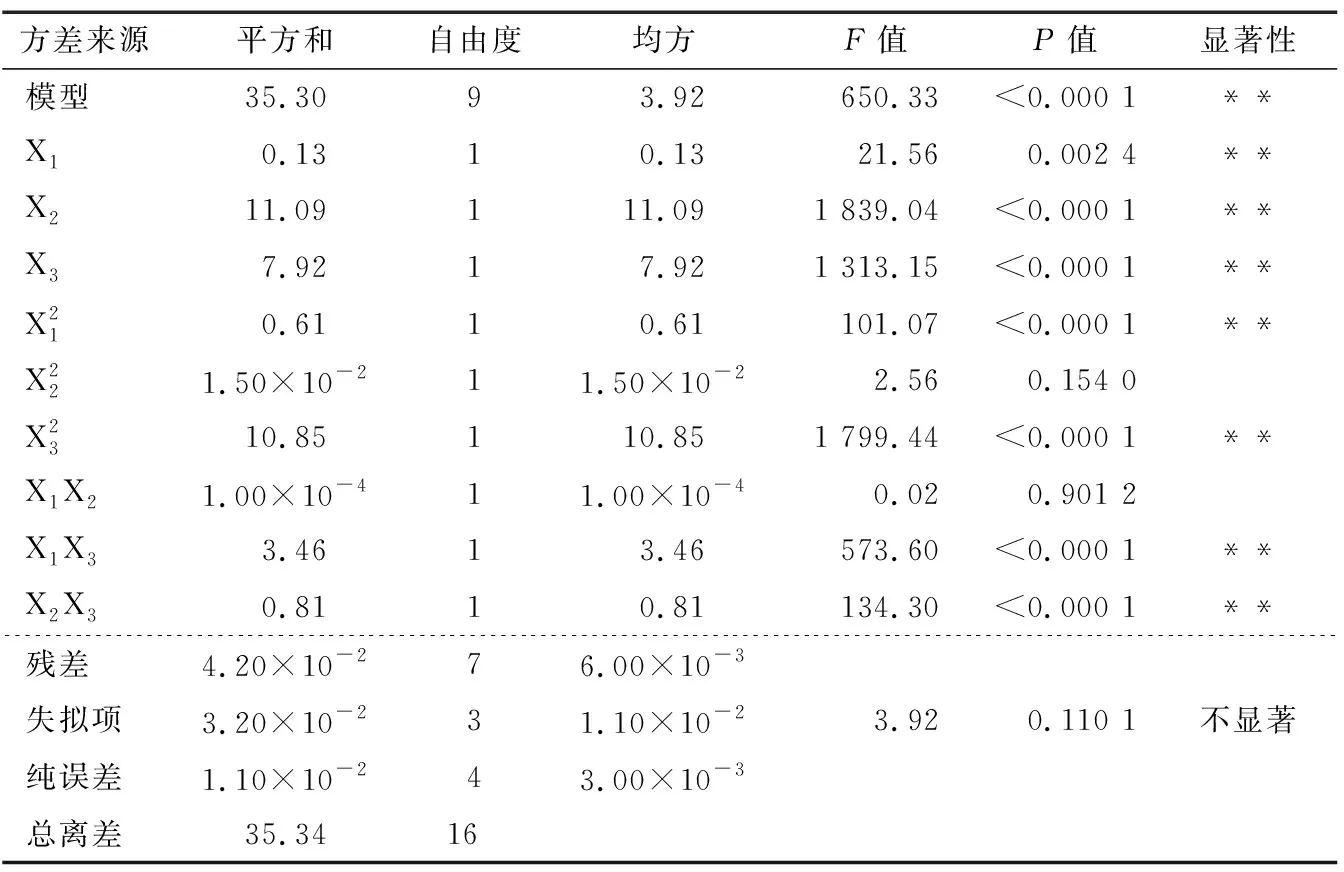
表3 响应面试验各因素方差分析† Table 3 Analysis of variance for each factor
由图1(a)可以看出,随着液料比从6∶1 (mL/g)增加到10∶1 (mL/g),微波功率从385 W增加到700 W,挥发油得率也相应地增加,较高的液料比有利于得到更多的提取物,较高的微波功率可以快速破坏植物细胞壁结构,微波处理越强烈,越有利于挥发成分的流出。当液料比和微波功率同时增高时,挥发油得率也增大。图1(b)显示挥发油得率随液料比的增大而升高,当液料比为7∶1 (mL/g)、微波时间为22 min时,挥发油的得率趋于平缓,可能是由于当水溶液体积过大,挥发油溶解在水中不容易挥发出来,再延长提取时间并不能增加得率。图1(c)中,香茅挥发油的得率也是随着微波功率、微波时间的增加而增加,但过长的时间并不能增加挥发油得率,当功率达到600 W左右,挥发油得率趋于平缓,过大的功率会导致能耗加。经响应面分析得出微波提取最佳条件为料液比7.185∶1 (mL/g),功率700 W,时间21.707 min,此时挥发油得率为15.965 mL/kg·DW。在最佳提取条件下再次进行挥发油的提取验证实验,重复3次,挥发油得率平均值为16.000 mL/kg·DW,此挥发油得率大于响应面试验中的数值,说明上述组合条件为挥发油提取最佳条件。
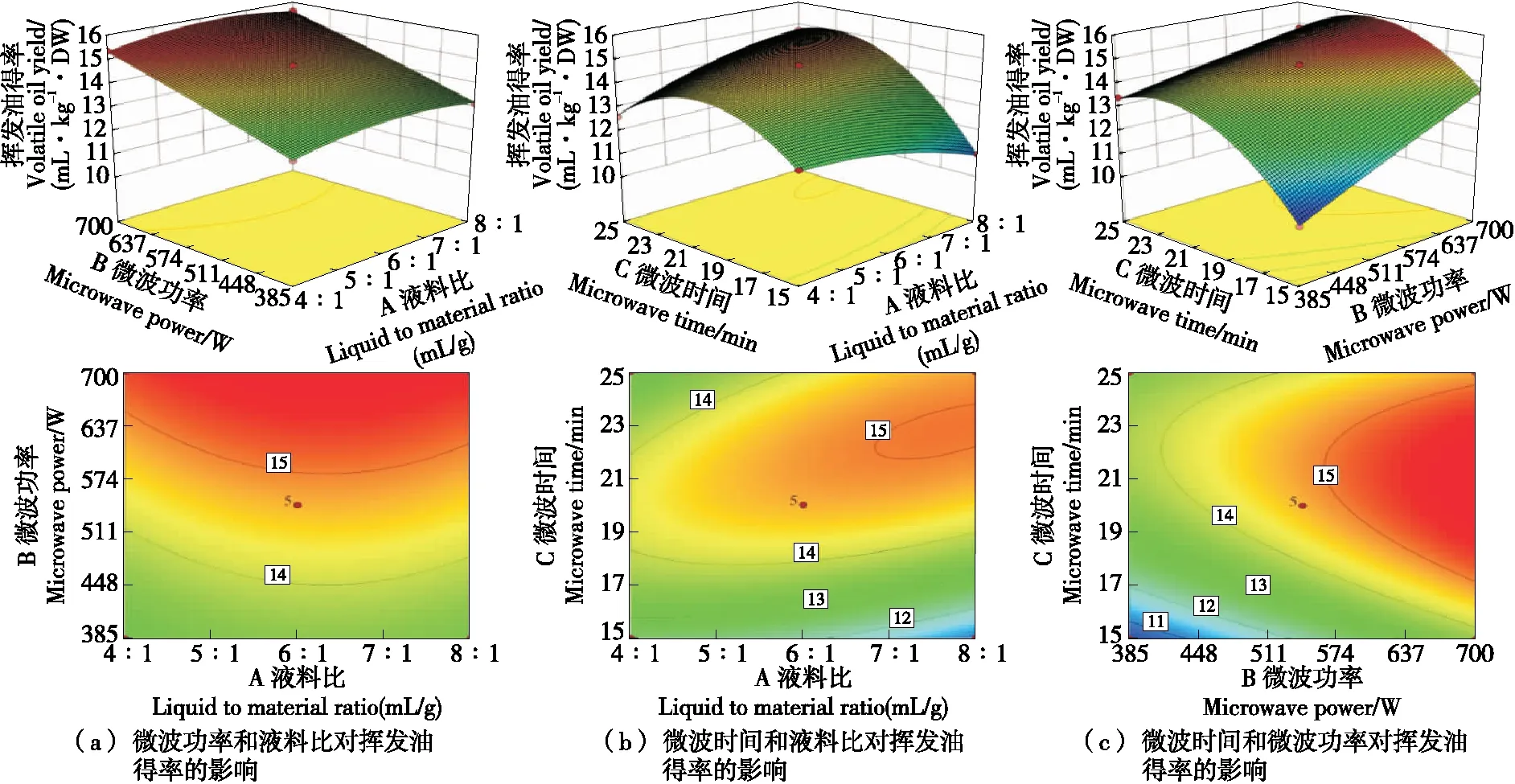
图1 各因素对挥发油得率影响的响应面图Figure 1 Response surface diagram of the influence of various factors on the yield of essential oil
2.2 挥发油成分分析
微波辅助提取法和加热套提取法所得香茅挥发油的离子流色谱图分别见图2和图3,微波辅助提取法中共得到46个峰,共检出39种成分,占所提挥发油总量的98.63%;加热套提取法中共得到57个峰,共检出43种成分,占所提挥发油总量的96.74%。各成分及其相对含量见表4。总体而言,这两种方法提取的挥发油中的主要成分均为香茅醛和香茅醇,但相对含量存在差异,加热套提取法的相对含量明显小于微波辅助提取法的,微波辅助提取法所得到的挥发油中功能成分含量普遍高于加热套提取的挥发油,两种工艺都有各自的特点,提取成分种类的不同主要与提取工艺密切相关,挥发油成分含量也存在一定差异。微波加热会使食品内部分子振动摩擦并迅速产热,引起食品温度升高,从而达到快速加热的目的。与传统加热方法相比,微波加热不仅具有加热速度快、加热均匀、对产品的机械损伤小、提取效率高,耗能低等优点,也更是一种符合绿色发展观念的挥发油提取法。
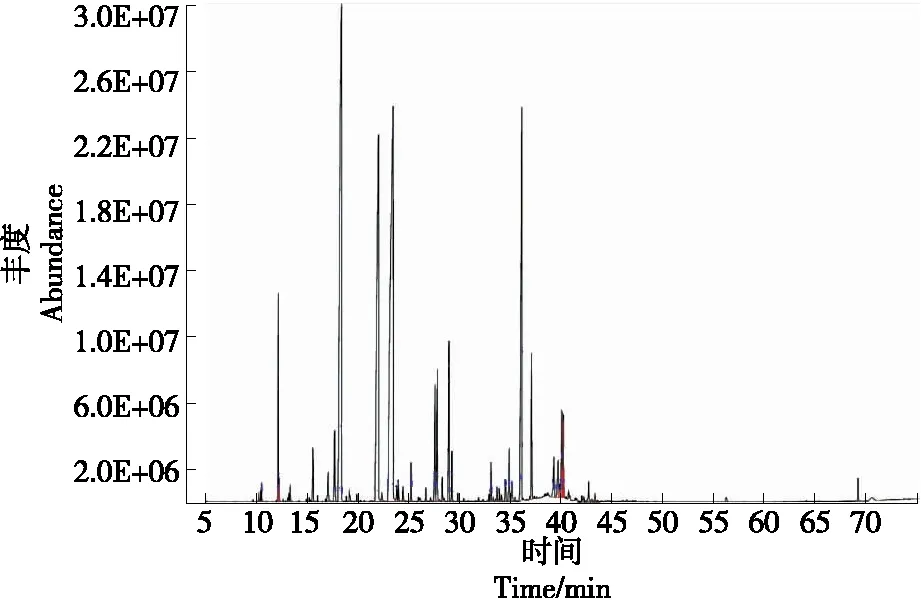
图2 微波辅助提取法所得香茅挥发油总离子流图Figure 2 Total ion flow diagram of citronella volatile oil obtained by microwave-assisted extraction method
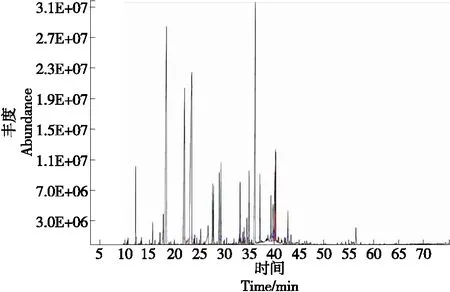
图3 加热套提取法所得香茅挥发油总离子流图Figure 3 Total ion flow diagram of citronella volatile oil obtained by heating mantle extraction method
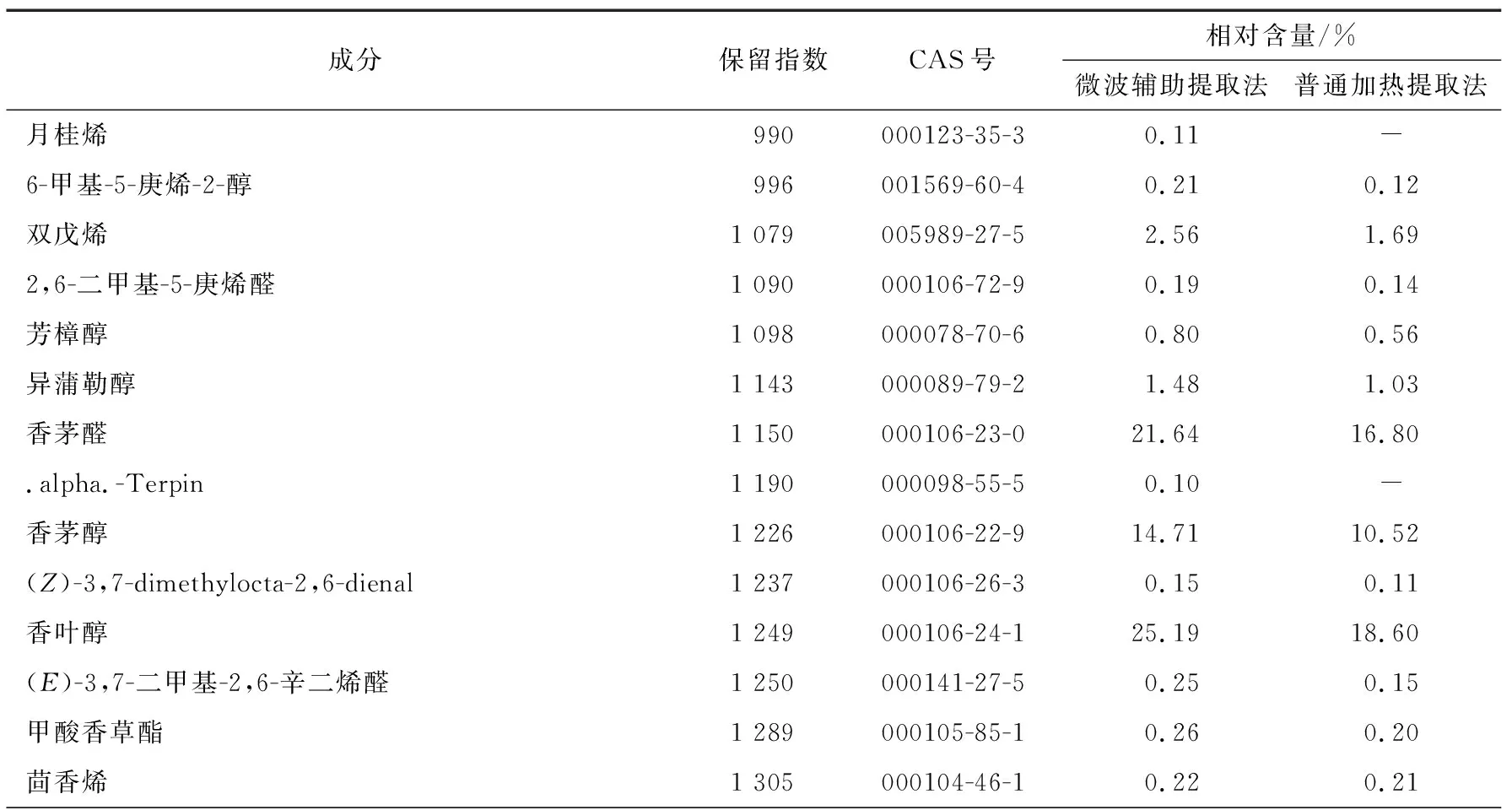
表4 香茅挥发油化学成分的气相色谱—质谱分析结果Table 4 Gas chromatography-mass spectrometry results for the chemical compositions of citronella essential oil
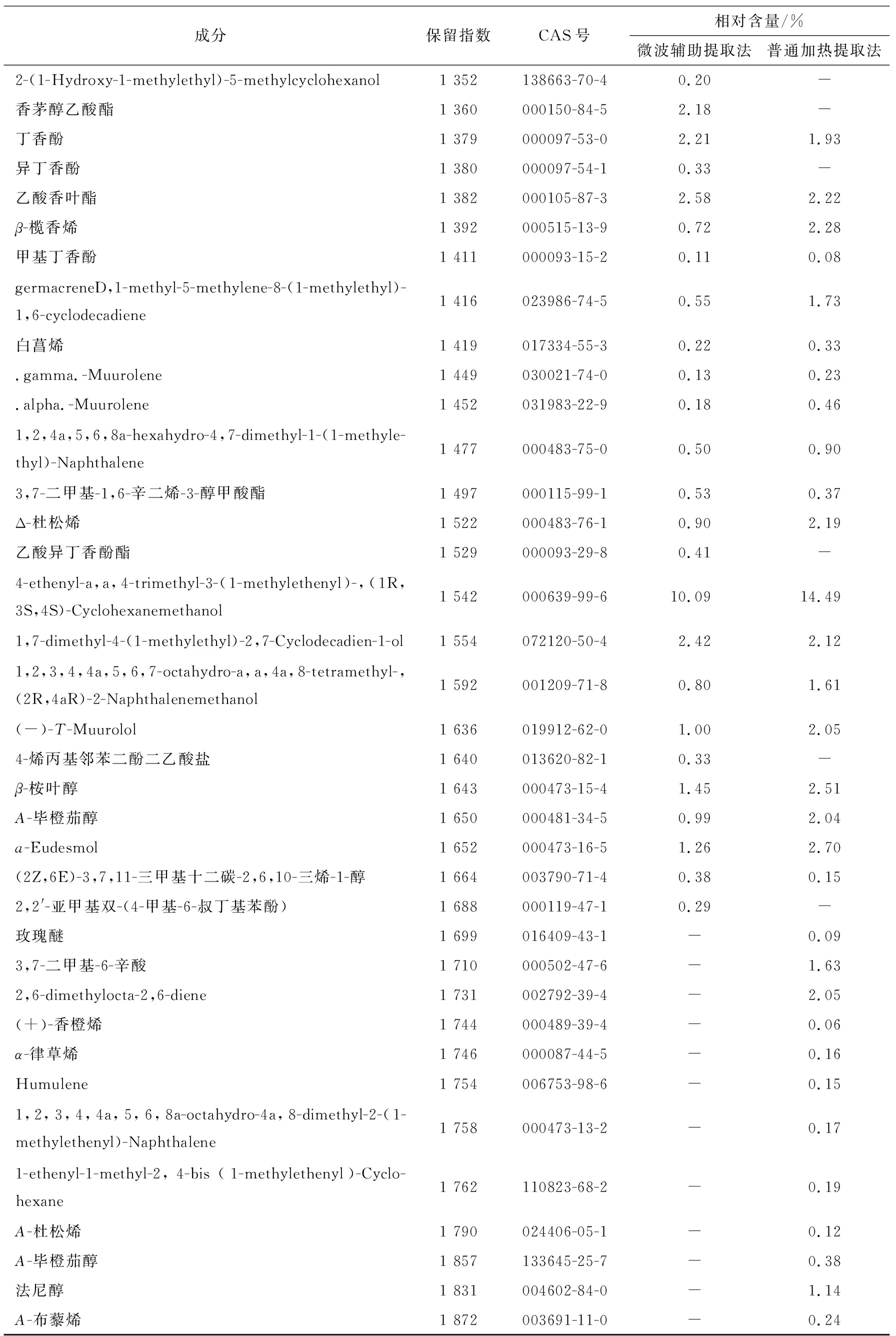
续表4
2.3 抗氧化活性
香茅挥发油对DPPH自由基和ABTS自由基的IC50值分别为0.546,1.694 mg/mL,均高于BHT(0.017,0.081 mg/mL),表明香茅挥发油具有很好的自由基清除能力(表5)。根据表5中数据显示,香茅挥发油对DPPH自由基、ABTS自由基的清除效率均低于VC与BHT,而抗氧化能力的大小取决于抗氧化剂的浓度及其供氢能力,香茅挥发油是天然抗氧化活性物质,由多种化合物构成;在β-胡萝卜素漂白试验中,香茅挥发油抗氧化IC50值为0.145 mg/mL,低于BHT的抗氧化能力0.02 mg/mL,与DPPH自由基和ABTS自由基清除试验结果一致。以上结论表明香茅挥发油属于天然抗氧化物,具有安全性、无毒副作用的特点,可用于各类抗氧化产品开发之中,保护生物体免受自由基氧化,因此具有良好的应用前景。
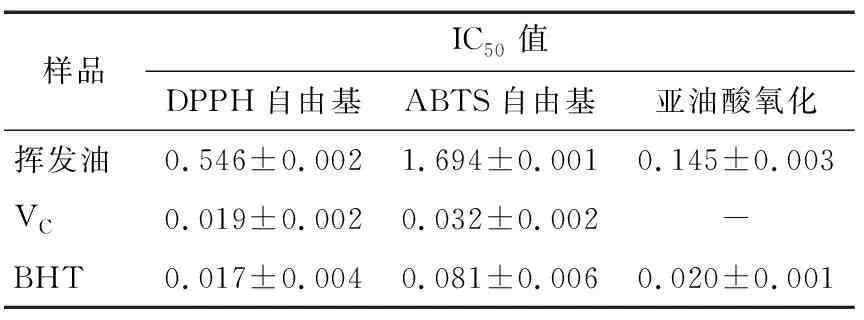
表5 香茅挥发油的抗氧化能力Table 5 Antioxidant capacity of the essential oil from the leaves of citronella mg/mL
2.4 抑真菌试验
假尾孢真菌包括有上千个品种,从腐败番石榴中分离的假尾孢真菌是座囊菌纲、球腔菌科下的微生物,广泛存在于番石榴属果实表面[22],为了验证香茅挥发油对真菌的抑制性,从冷冻的番石榴变质部位进行假尾孢菌分离。假尾孢真菌于26 ℃恒温培养箱中培养48 h后,经革兰氏染色,采用电子显微镜观测表面结构如图4所示,其呈现出丝状缠绕的状态,无序排列,未经染色的假尾孢真菌头部呈黑褐色,尾孢呈乳白色,在生长过程中占空间较大,当假尾孢真菌繁殖到一定数量时,肉眼可见黑褐色头部覆盖住尾孢,最终呈片状分布在培养皿中。
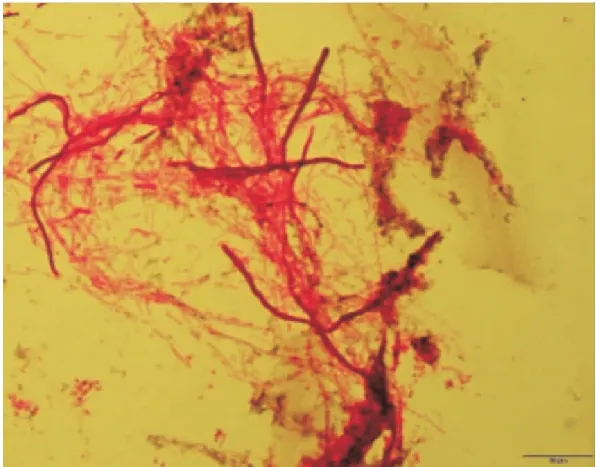
图4 经革兰氏染色的显微镜下200倍的假尾孢菌Figure 4 Pseudotail bacteria 200 times under the microscope after gram staining
采用琼脂打孔法[23]测定香茅挥发油的抗真菌能力。
假尾孢菌是无性型真菌属,生长速度缓慢,因此菌株生长情况观察总时长为120 h。在24 h时,各培养皿中菌株均无明显生长,随时间推移,陆续出现菌落,随挥发油抑菌液浓度的增大菌落数越少。当挥发油抑菌液的质量浓度为2.0 μg/mL时,对假尾孢真菌的抑制作用不明显,菌落呈放射状生长,但当挥发油抑菌液质量浓度为2.5~3.0 μg/mL时,对假尾孢真菌具有较好的抑制效果,但假尾孢真菌在2.5 μg/mL的抑菌液中持续120 h后仍然有一点生长;因此可以得出:在相同时间条件下,随着香茅挥发油浓度的不断增大,菌落生长直径越来越小;该结果表明在单位时间恒定的情况下,挥发油对假尾孢菌的抑制强度与挥发油浓度呈正比例关系,且判断MIC为2.5 μg/mL,MBC为3.0 μg/mL,由图5可知,菌株在72 h时的观察效果已经很明显,在挥发油质量浓度为2.5 μg/mL 的培养皿中,并未观察到菌株生长,但是随时间推移,直到120 h时琼脂块周围出现白色菌落状物,推测是因为时间的增加使培养皿中挥发油量逐渐减少,抑制作用逐渐消失,可能再延长培养时间,菌落数会越来越多,因此在培养前期就可以确定其MIC值,随时间推移反而会影响试验结果的准确性,挥发油浓度的增大抑菌效果也显著增加。童周[24]研究表明α-松油醇、香茅醇和香茅醛等活性成分具有良好的抑真菌效果,由于香茅挥发油中也富含这几种成分,因此推测对抑制假尾孢真菌起到了很大作用。这也有利于挥发油抑制真菌以及香茅挥发油对其他真菌方面的研究。
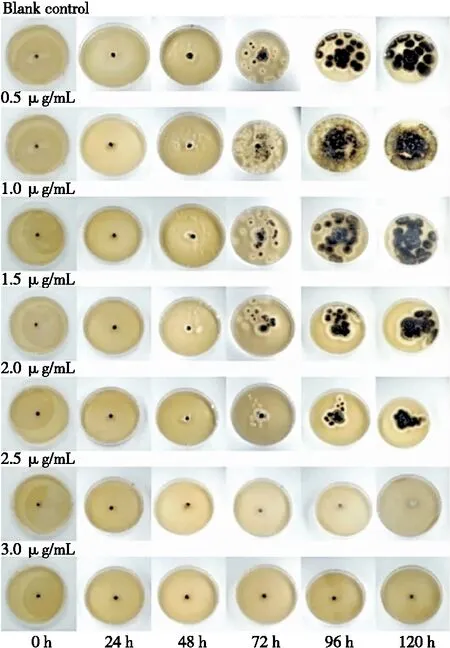
图5 不同质量浓度香茅挥发油对假尾孢真菌的抑制情况Figure 5 Inhibitory effects of citronella essential oil at different mass concentrations on pseudosporomycetes
3 结论
微波辅助提取香茅挥发油的最佳工艺参数为微波功率700 W、微波时间21.707 min、液料比7.185∶1 (mL/g),挥发油得率为15.965 mL/kg·DW。GC-MS分析鉴定出39种化合物成分,主要成分为烯类、倍半萜烯类及其含氧衍生物等,这些药用成分的百分含量比加热套提取法所得挥发油多。通过DPPH自由基、ABTS自由基以及亚油酸氧化的抑制率评估香茅挥发油的抗氧化性能,分别为92.49%,92.46%,82.23%,且香茅挥发油抑菌液对假尾孢菌的抑制MIC值为2.5 μg/mL,MBC值为3.0 μg/mL。但是微生物种类繁多,香茅挥发油对更多菌种的抑制作用还有待研究。
