高效液相色谱法同时测定保健食品中6种黄酮类化合物
2022-09-15伍依琪梁志森陈玉珍林晓君
伍依琪 梁志森 陈玉珍 周 睿 林晓君
(1. 广州检验检测认证集团有限公司,广东 广州 511447;2. 国家加工食品质量检验检测中心〔广东〕,广东 广州 511447)
黄酮类化合物广泛分布在自然界中,是植物在长期自然选择过程中产生的一类次生代谢产物[1]。其中,4’-羟基汉黄岑素、去甲汉黄岑素、黄岑素、汉黄岑素和汉黄岑苷是黄岑等植物提取物的主要活性成分,具有护肝[2]、抗氧化[3-4]、抗糖尿病[5]、抗炎、保护神经[6]、抗纤维化[7]、抗病毒、抗癌[8]等作用。白杨素又称白杨黄素,具有多种药理作用,如抗肿瘤活性[9]、改善体重和脂质代谢作用[10]、抗抑郁作用[11]、神经保护作用[12]、治疗皮肤病[13]等。由于黄岑素类化合物对预防各类疾病的功效优异,因此容易被不法商家用作保健食品的虚假功效宣传。另一方面,随着黄酮类化合物在保健食品中的开发和利用,过量摄入相关成分对人体的危害尚未明确,这些产品可能会带来潜在健康风险,因而对黄芩素含量的测定研究对保健食品价值的评价具有重要意义[14]。
目前黄岑素类化合物测定的方法主要集中在高效液相色谱(high performance liquid chromatography,HPLC)法[15-18],其分离效能高,灵敏度高,应用范围广,检测成本低,操作简单,适用于常规的日常检测工作。黄酮类化合物的提取方法中,较多使用超声提取法,该方法较常规提取方法具有温度低、效率高、能耗低、节省溶剂等优点[19],但往往提取杂质较多,严重影响分析结果。研究拟采用HPLC技术,建立对汉黄岑苷、4’-羟基汉黄岑素、去甲汉黄岑素、黄岑素、汉黄岑素、白杨素6种黄酮类化合物含量同时测定的方法,并验证上述6种黄酮类成分在不同类别保健食品中的方法学数据,以期为后续保健食品中黄酮类化合物的分析研究提供参考依据。
1 材料与方法
1.1 材料与仪器
1.1.1 材料与试剂
保健食品(维生素片和胶原钙片各5份):市售;
4’-羟基汉黄岑素(CAS 57096-02-3)、去甲汉黄岑素(CAS 4443-09-8)、汉黄岑素(CAS 632-85-9):纯度≥98%,武汉天植生物技术有限公司;
黄岑素(CAS 491-67-8):纯度≥98%,上海源叶生物科技有限公司;
白杨素(CAS 480-40-0)、汉黄岑苷(CAS 51059-44-0):纯度≥98%,上海吉至生化科技有限公司;
乙腈、甲醇、丙酮:色谱纯,上海安谱实验科技股份有限公司;
甲酸、乙酸:分析纯,美国Sigma Aldrich公司;
二甲亚砜:分析纯,广州化学试剂厂;
C18固相萃取小柱(60 mg,3 mL):上海安谱实验科技股份有限公司;
Atiantis T3(150 mm×4.6 mm,5 μm):沃特世科技(上海)有限公司;
Thermo C18(250 mm×4.6 mm,5 μm):赛默飞世尔科技有限公司;
Phenomenex Luna C18(250 mm×4.6 mm,5 μm):美国飞诺美公司。
1.1.2 主要仪器设备
高效液相色谱仪:Waters Alliance E2695型,沃特世科技(上海)有限公司;
超纯水系统:Milli-Q Advantage A10型,法国Merck Millipore公司;
超声波清洗器:KQ3200V型,昆山市超声仪器有限公司;
离心机:4k-15型,美国西格玛公司;
涡旋混匀器:IKA Vortex4型,德国IKA公司。
1.2 方法
1.2.1 样品的前处理 样品经粉碎机粉碎、混匀,分装于洁净盛样袋中待用。称取样品2.00 g于50 mL离心管中,加入10 mL丙酮,涡旋混匀,超声提取10 min,涡旋,8 000 r/min离心,取2 mL样液加入10 mL纯化水,混匀后全部移入C18固相萃取小柱,再用5 mL丙酮洗脱,收集流出液,40 ℃氮吹近干,用丙酮复溶,并准确定容至1 mL,过0.22 μm尼龙膜,待测。
1.2.2 标准溶液的配制 准确称取黄岑素、汉黄岑素、汉黄岑苷、白杨素标准物质于10 mL棕色容量瓶,用甲醇溶解并稀释至刻度,准确称取4’-羟基汉黄岑素、去甲汉黄岑素标准物质于10 mL棕色容量瓶,用二甲亚砜溶解并稀释至刻度,均配制成质量浓度为1 mg/mL的标准储备溶液,于4 ℃下避光保存,有效期1个月。分别移取1 mL上述6种目标物的标准储备液至10 mL容量瓶中,用50%乙腈水溶液配制成100 mg/L的混合标准溶液。选取不含6种目标化合物的保健食品(维生素片和胶原钙片),按照1.2.1的方法制备样品空白基质溶液。取混合标准溶液,用维生素片和胶原钙片样品空白基质溶液分别配制质量浓度为0.0,1.0,2.0,4.0,8.0,12,20 mg/L的混合标准工作溶液,现配现用。
1.2.3 色谱条件 色谱柱为Phenomenex Luna C18(250 mm×4.6 mm,5 μm)。流动相A为乙腈,流动相B为2%乙酸溶液。梯度洗脱程序:0~2 min,20% A;2~5 min,20%~40% A;5~11 min,40% A;11~28 min,40%~43% A;28~30 min,20% A。流速为1.0 mL/min,柱温为30 ℃,进样量为20 μL;检测波长为280 nm。
1.2.4 回收率的计算 按照1.2.1的方法,称取均匀后的样品,在样品中添加3个水平的混合标准溶液,进行加标回收试验,每个添加水平平行测定3次计算平均回收率。
1.2.5 精密度的计算 按照1.2.1的方法,进行加标回收试验,在24 h内,每个水平测定6个平行样。所得结果计算相对标准偏差。
1.2.6 数据处理 测量数据采用仪器分析软件进行采集和处理,使用Origin 8.0进行作图。
2 结果与分析
2.1 色谱条件优化
2.1.1 流动相的优化 考察了乙腈、甲醇、0.5%甲酸水溶液、2%甲酸水溶液、0.5%乙酸水溶液、2%乙酸水溶液等不同流动相体系及不同流动相的配比对目标物色谱峰形的影响。结果表明,需要较大比例的甲醇才能将目标物洗脱出来,乙腈比甲醇的洗脱能力更强。因此,用乙腈作为有机相可使溶剂消耗更小,有利于节省有机溶剂的成本,2%乙酸水溶液作为水相比甲酸水溶液体系的目标物色谱峰形的分离度更高。
2.1.2 色谱柱的选择 考察了Atiantis T3(150 mm×4.6 mm,5 μm)、Thermo C18(250 mm×4.6 mm,5 μm)、Phenomenex Luna C18(250 mm×4.6 mm,5 μm)3种色谱柱对目标物色谱峰形的影响。结果表明,Atiantis T3色谱柱虽然目标物出峰时间快,但是去甲汉黄岑素、黄岑素的目标峰有部分重叠难分开,基线波动大,Thermo C18色谱柱目标物的峰形比Phenomenex Luna C18色谱柱的差,Phenomenex Luna C18色谱柱的分离效果较为理想,基线平稳,因此,采用Phenomenex Luna C18色谱柱进行测定。
以维生素片和胶原钙片作为空白基质溶液,6种目标化合物质量浓度均为10 mg/L,根据上述最优色谱条件进行测定,结果显示各峰分离情况良好,如图1、图2所示。

1. 汉黄岑苷 2. 4’-羟基汉黄岑素 3. 去甲汉黄岑素 4. 黄岑素5. 汉黄岑素 6. 白杨素图1 维生素片基质中6种黄酮类化合物色谱图Figure 1 Chromatogram of 6 flavonoids in vitamin tablet matrix

1. 汉黄岑苷 2. 4’-羟基汉黄岑素 3. 去甲汉黄岑素 4. 黄岑素5. 汉黄岑素 6. 白杨素图2 胶原钙片基质中6种黄酮类化合物色谱图Figure 2 Chromatographic diagram of 6 flavonoids in collagen calcium tablet matrix
2.2 方法的验证
以目标物的浓度(X)为横坐标,对应的峰面积(Y)为纵坐标,进行线性回归,绘制标准曲线。维生素片、胶原钙片基质中汉黄岑苷、4’-羟基汉黄岑素、去甲汉黄岑素、黄岑素、汉黄岑素、白杨素的线性方程见表1。结果表明,维生素片和胶原钙片基质中汉黄岑苷、4’-羟基汉黄岑素、去甲汉黄岑素、黄岑素、汉黄岑素、白杨素在0~20 mg/L的质量浓度范围内均有良好的线性关系。同时,按照1.2.2 的方法配制目标物的基质标准溶液,以外标法进行定量。选用阴性样品进行低浓度加标,根据仪器的信噪比3倍(S/N=3)和10倍(S/N=10)的标准确定方法检出限(LOD)和方法定量限(LOQ)[20],维生素片、胶原钙片基质中汉黄岑苷、4’-羟基汉黄岑素、去甲汉黄岑素、黄岑素、汉黄岑素、白杨素的LOD和LOQ见表1。

表1 空白基质中6中目标物的线性关系、检出限和定量限Table 1 Linear relationship, limit of detection and limit of quantification of 6 targets in blank matrix
2.3 仪器测定精密度试验
分别吸取维生素片和胶原钙片基质的混合标准溶液,质量浓度为10 mg/L,按1.2.3仪器条件进行连续进样6次的测定,结果表明,维生素片基质中汉黄岑苷、4’-羟基汉黄岑素、去甲汉黄岑素、黄岑素、汉黄岑素、白杨素的精密度分别为1.38%,0.59%,1.06%,0.80%,0.79%,1.17%,胶原钙片基质中汉黄岑苷、4’-羟基汉黄岑素、去甲汉黄岑素、黄岑素、汉黄岑素、白杨素的精密度分别为1.27%,1.31%,0.74%,0.54%,1.53%,0.42%,表明此方法的精密度良好。
2.4 空白基质的混合标准溶液稳定性试验
分别吸取维生素片和胶原钙片基质的混合标准溶液,质量浓度为10 mg/L,按1.2.3仪器条件于0,6,12,24,48 h进样测定,结果表明,维生素片基质中汉黄岑苷、4’-羟基汉黄岑素、去甲汉黄岑素、黄岑素、汉黄岑素、白杨素的RSD分别为1.82%,2.95%,1.77%,0.56%,3.08%,3.05%,胶原钙片基质中汉黄岑苷、4’-羟基汉黄岑素、去甲汉黄岑素、黄岑素、汉黄岑素、白杨素的RSD分别为1.27%,1.31%,0.74%,0.54%,1.53%,0.42%,表明这两种基质的混合标准溶液在48 h内的稳定性良好。
2.5 空白基质的混合标准溶液加标回收试验
由于保健食品中6种黄酮类化合物含量差异较大,虽然有较多的样品呈阴性,但为了贴合实际测定,选择经1.2.1处理测定后,汉黄岑素本底含量分别为1.95 mg/kg的维生素片和本底含量为1.88 mg/kg的胶原钙片样品进行加标试验。采用外加法,分别向样品中添加3个水平的标准物质,添加量分别为本底值的0.5,1.0,5.0倍,即1.00,2.00,10.00 mg/kg,每个水平在同等条件下进行3个平行样品测定,回收率及精密度试验结果见表2、表3。结果表明,上述两种基质的加标回收率在83%~100%,精密度RSD在1.06%~4.63%,该方法的回收率高,稳定性好。
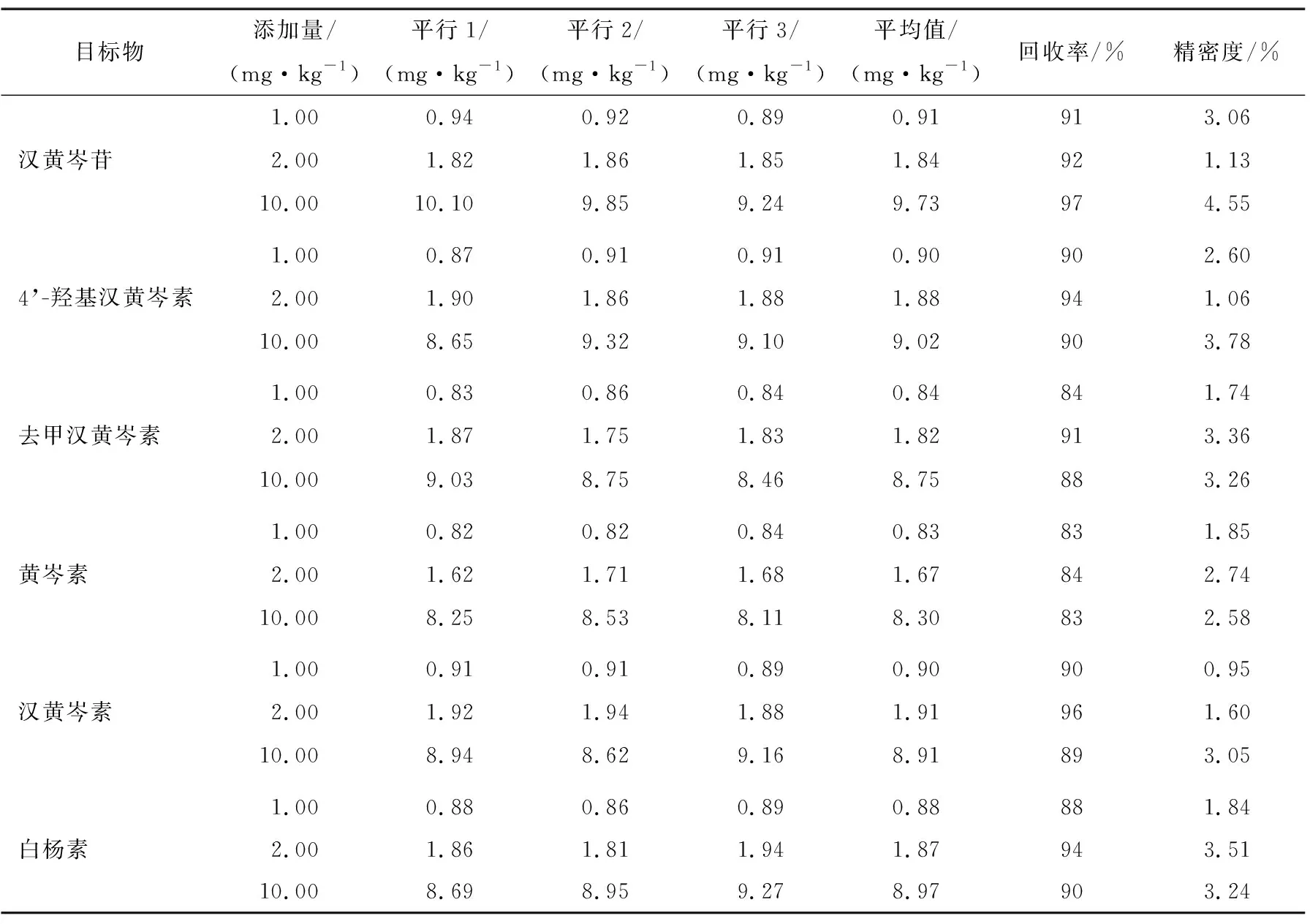
表2 维生素片基质中6种黄酮类化合物的回收率和精密度Table 2 Recovery and precision of six flavonoids in vitamin tablet matrix

表3 胶原钙片基质中6种黄酮类化合物的回收率和精密度Table 3 Recovery and precision of 6 flavonoids from collagen calcium tablet matrix
2.6 实际样品测定
根据优化后的方法对市售8个样品进行测定,8个样品中有2个样品检出汉黄岑苷,含量分别为882,651 mg/kg,2个样品检出黄岑素,含量分别为436,138 mg/kg,2个样品检出汉黄岑素,含量分别为125,51 mg/kg。4’-羟基汉黄岑素、去甲汉黄岑素、白杨素均未检出。图3为维生素片阴性样品的色谱图,图4为维生素片阳性样品色谱图,其中汉黄岑素检出值为51 mg/kg。
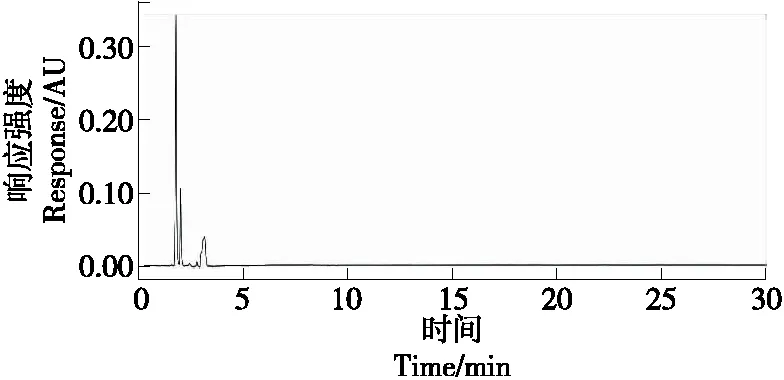
图3 维生素片阴性样品色谱图Figure 3 Chromatograms of vitamin tablet-negative samples

图4 维生素片阳性样品色谱图Figure 4 Chromatograms of vitamin tablet-positive samples
3 结论
试验建立了同时测定保健食品中汉黄岑苷、4’-羟基汉黄岑素、去甲汉黄岑素、黄岑素、汉黄岑素、白杨素的高效液相色谱的分析方法,通过优化流动相体系、梯度洗脱程序和色谱柱等色谱条件,使6种黄酮类化合物在30 min内完全出峰,且分离度和峰形均良好;通过维生素片和胶原钙片这两种基质考察了该方法的精密度、稳定性以及不同浓度的加标试验,回收率和标准偏差,结果表明该方法能满足日常检测的要求且操作简单,回收率高,重现性好,经济成本较低,方便高效,适用于保健食品中汉黄岑苷、4’-羟基汉黄岑素、去甲汉黄岑素、黄岑素、汉黄岑素、白杨素6种黄酮类化合物的检测分析。
