自体月经血来源的干细胞在宫腔粘连中的临床应用
2022-09-15马海兰陆兰英王巍刘梦婷何梅李美玲
马海兰,陆兰英,王巍,刘梦婷,何梅,李美玲
1.桂平市人民医院生殖医学中心,广西桂平 537200;2.武汉汉密顿生物科技股份有限公司,湖北武汉 430000
宫腔粘连(intrauterine adhesion,IUA)是子宫内膜基底层损伤后功能层再生修复障碍、纤维瘢痕组织形成导致宫腔部分或完全封闭。主要症状为月经量少,甚至闭经、不孕等[1]。目前临床治疗IUA以手术为主,辅以子宫内膜再生修复和增加子宫内膜血流等综合管理。对中重度粘连患者来说,术后粘连复发、内膜再生障碍等仍不能有效避免,宫腔粘连术后总体复发率为3.1%~23.5%,其中重度粘连高达62.5%[2]。本课题旨在探究2018年4月—2021年4月于桂平市人民医院就诊的因宫腔粘连导致不孕的50例患者,经自体月经血来源的干细胞移植后的临床应用效果。现报道如下。
1 资料与方法
1.1 一般资料
本研究获医院伦理委员会批准。所有参与者在充分了解细节、失败可能性和程序风险后签署知情同意书。选取于本院就诊的50例不孕患者为研究对象。
1.2 纳入与排除标准
纳入标准:①年龄22~40岁;②接受“试管婴儿”助孕治疗、移植2次以上失败;③2次宫腔镜证实为宫腔中、重度粘连[按照欧洲妇科内镜协会IUA分类标 准(european society of gynecological endoscopy,ESGE)];④传统治疗手段后内膜厚度<6 mm(B超检查评估)。排除标准:①合并泌尿生殖系急性炎症患者;②合并活动性生殖器结核患者。
1.3 IUA分类标准
Ⅰ度:宫腔内多处有纤细膜样粘连带,两侧宫角及输卵管开口正常;Ⅱ度:子宫前后壁间有致密的纤维束粘连,两侧宫角及输卵管开口可见;Ⅲ度:纤维索状粘连致部分宫腔及一侧宫角闭锁;Ⅳ度:纤维索状粘连致部分宫腔及两侧宫角闭锁;Ⅴa度:粘连带瘢痕化致宫腔极度变形及狭窄;Ⅴb:粘连带瘢痕化致宫腔完全消失。其中,Ⅰ~Ⅱ度为轻度粘连,Ⅲ度为中度粘连,Ⅳ~Ⅴ度为重度粘连[3]。
1.4 方法
1.4.1 常规治疗 宫腔镜术后予常规雌孕激素序贯疗法,于月经第5日开始服用戊酸雌二醇片(国药准字号J20130009,1 mg/片),2次/d,2片/次,连服22 d,于最后10 d加用地屈孕酮片(注册证号H20130110,10 mg/片)治疗,2次/d,10 mg/次。重复3个周期。
1.4.2 自体月经血来源的干细胞治疗 在常规治疗后采用自体月经血来源的干细胞进行宫腔内局部移植治疗。具体方法如下。
(1)月经血收集。患者于月经前检查阴道、宫颈分泌物,无细菌、真菌、支原体、衣原体感染;月经期第2天碘伏消毒外阴、阴道,用肝素钠润洗月经杯,并置于阴道内穹隆扣住子宫颈,收集12 h内月经血3~10 mL,将经血与磷酸盐缓冲液(phosphate buffered saline,PBS)(含antibiotic-antimycotic)等体积稀释后,送至武汉汉密顿生物科技股份有限公司分离培养内膜干细胞并冷冻保存,择期送回本院胚胎培养室继续冷冻保存。
(2)经血来源的干细胞(menstrual blood-derived stem cells,MenSCs)的收集与分离。将稀释后的血液沿着盛有1/2体积的Ficoll(GE Healthcare)分离液的离心管上管壁缓慢加入,室温900×g,离心30 min。无菌巴氏吸管缓慢吸取中间层细胞,置于约2倍体积的PBS溶液中,室温300×g,离心10 min。弃上清,PBS再次清洗2次,留取细胞沉淀。
(3)MenSCs的培养与扩增。①原代培养:细胞随后放于含antibiotic-antimycotic的无血清培养基中培养。24 h后PBS溶液洗涤除去未贴壁细胞,贴壁细胞记做P0代。
②传代培养与冻存建库:每隔3~5 d更换培养基,细胞融合度达到80%~90%时消化传代。弃培养液,PBS清洗细胞一遍,加入0.25%的胰酶,37℃孵育3 min,待细胞变圆,轻轻拍打瓶身使MenSCs全部脱落,加入全培养基终止消化,收集细胞,1 000 r/min,离心5 min,收集沉淀用新鲜培养液重悬细胞至所需细胞浓度,移至新的培养瓶,置于37℃、5%CO2细胞培养箱传代培养。重复上述操作,将细胞培养传代至P4代,收集后建立工作细胞库,冻存待用。
(4)MenSCs的检测与鉴定。①微生物检测:细胞上清液进行细菌、真菌、支原体、内毒素检测。一旦检测到有微生物污染,细胞应立即丢弃。
②MenSCs的表面标志物鉴定:取生长状态良好的细胞,将细胞消化分散成单个细胞,并平均分成7份置于流式管,每份1×106个细胞,按要求分别加入以下流式抗体:CD73、CD90、CD105、CD44、CD34、CD45、CD19、HLA-DR,室温避光孵育30 min,按要求上样及使用流式细胞仪。
③MenSCs诱导分化:取生长状态良好的细胞,将细胞消化分散成单个细胞悬液,按1×106/孔,均匀铺在6孔板。细胞贴壁后更换成脂、成骨、成软骨诱导培养基。每3~4天更换培养基。培养2~3周后分别进行油红O(Oil Red O)、茜素红(Alizarin Red)、阿利新蓝(Alcian blue)染色鉴定MenSCs的分化潜能。见图1。
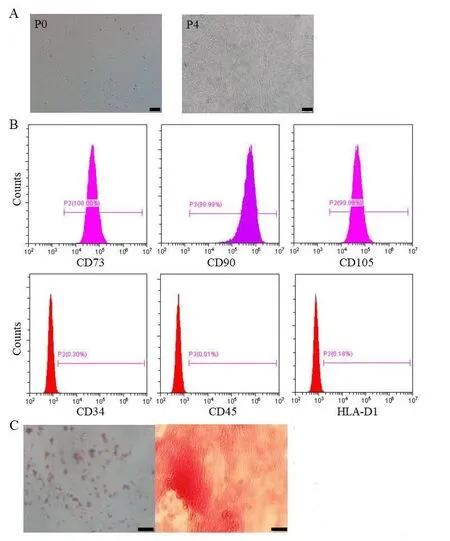
图1 MenSCs特征。A是P0及P4的图像(scale bar=50 μm);B是流式细胞测定MenSCs的阳性表面标志物CD73,CD105和CD90,以及阴性表面标志物CD34,CD45和HLA-D1;C分别是油红O(左)、茜素红(右)染色鉴定的成脂、成骨诱导分化的MenSCs。MenSCs为月经血干细胞
(5)MenSCs解冻。月经期第2天,通知患者准备移植干细胞。核对患者信息后,将已冻存的干细胞在37℃水浴中复苏2 min,吸到8 mL生理盐水中,120 g,离心5 min;用3 mL生理盐水重悬细胞,细胞计数后调整浓度至(3~4)×106/mL,用3支1 mL注射器分别吸取1 mL备用。
(6)MenSCs移植。患者取截石位,碘伏常规消毒外阴及阴道,无菌纱布擦干阴道、宫颈及阴道穹隆部,移植前轻微地搔刮子宫腔清除子宫腔内残留的内膜层凝血块。在腹部B超引导下,经宫颈管插入胚胎移植管达子宫内膜基底层下0.5 cm,取出管芯,接5 mL装生理盐水注射器,加压推注有阻力,再接装有1 mL干细胞悬液的注射器,缓慢注射细胞悬液0.5 mL,缓慢撤回移植管,同时继续注射剩余的0.5 mL细胞悬液直到尖端退出子宫内膜外。选取另外两个位点,重复移植操作2次。术后患者屈膝平躺2 h,术中静脉输注250 mL生理盐水+间苯三酚(40 mg/支,国药准字H20046766)40 mg抑制子宫收缩。
(7)激素疗法。采用激素替代疗法刺激子宫内膜生长,患者于干细胞移植日开始口服芬吗通(红片为雌二醇片2 mg/片;黄片为雌二醇地屈孕酮片,每片含雌二醇2 mg和地屈孕酮10 mg)。先服芬吗通红片,1片/次,3次/d,连服14 d后给予芬吗通黄片口服,1片/次,3次/d,服14 d停药。待撤退性出血第3天,重复第2周期激素疗法。于服用芬吗通红片后第12天行B超检查子宫内膜厚度及形态,若子宫内膜厚度<7 mm则予芬吗通黄片口服,1片/次,3次/d,服14 d停药,于撤退性出血后再重复第3个周期激素疗法。如子宫内膜厚度仍<7 mm,则考虑进行第二轮MenSCs移植治疗。在第2周期激素疗法过程中,若子宫内膜厚度>7 mm,且内膜形态为A型或B型说明达到预期效果,继续口服芬吗通红片,1片/次,3次/d,连续3 d,抽血查性激素雌二醇>200 pg/mL,孕酮<1.0 ng/mL,即予黄体酮肌内注射,60 mg/d(20 mg/支,国药准字H33020828),持续注射4 d,予移植D3胚胎或注射6 d,予移植D5、D6囊胚。
1.4.3 胚胎移植 移植后继续予口服芬吗通红片2 mg,3次/d,雪诺同90 mg塞阴道作为黄体支持,移植后10~14 d回院验孕。
1.5 观察指标
①月经情况[4]:患者在干细胞治疗前后,于经期自行通过月经杯收集经血,记录1~2个月的月经持续时间及经量。②子宫内膜厚度及形态:采用ALOKA超声诊断仪F31检查子宫内膜形态,探头频率约是4~9 MHz。子宫内膜厚度测量范围为:距子宫底1 cm处一侧的子宫内膜回声起始处至另一侧子宫内膜回声起始处。子宫内膜形态分型标准[5]:强回声区在外层与中央区域出现,低回声区或暗区在外层与宫腔中线之间,呈现“三线征”为A型;均一的中等强回声,宫腔强回声中线断续不清,属于B型;无宫腔中线回声,且出现均质强回声区属于C型。达到A和B型,则认为治疗效果良好,可以进行冻融胚胎移植治疗。③妊娠结局:于胚胎移植后第10~14天抽血查人绒毛膜促性腺激素(human chorionic gonadotrophin,HCG),HCG>25 U/L则诊断为生化妊娠。于胚胎移植后28 d行阴道B超检查,查见宫腔内孕囊及原始心管搏动,则诊断为临床妊娠,即为妊娠成功。
1.6 统计方法
采用SPSS 19.0统计学软件处理数据,符合正态分布的计量资料以(xˉ±s)表示,组间差异比较采用t检验;计数资料以[n(%)]表示,组间差异比较采用χ2检验。P<0.05为差异有统计学意义。
2 结果
2.1 患者治疗前后经期、经量、内膜厚度比较
治疗后,患者经期、经量及内膜厚度明显高于治疗前,差异有统计学意义(P<0.05)。见表1。
表1 患者治疗前后经期、经量、内膜厚度比较(±s)

表1 患者治疗前后经期、经量、内膜厚度比较(±s)
项目经量(mL)内膜厚度(mm)经期(d)治疗前11.76±6.93 4.86±0.74 3.22±1.83治疗后32.28±13.84 7.45±0.87 4.34±1.28 t值14.49 31.27 7.89 P值<0.001<0.001<0.001
2.2 患者治疗前后子宫内膜厚度及形态比较
患者治疗后子宫内膜形态较治疗前明显改善,差异有统计学意义(P<0.05)。见表2。

表2 患者治疗前后子宫内膜形态比较
2.3 患者治疗后妊娠结局
治疗后,有27例仍未妊娠,23例临床妊娠(妊娠率46%),其中3例双胎妊娠,余为单胎妊娠。
3 讨论
IUA由Asherman首次对该疾病进行命名并作详细描述,因此也称Ashmen's综合征[6]。IUA是继发性不孕患者常见的病因,占不孕症发病原因的8%[7]。有学者提出,IUA的发生与子宫内膜干细胞减少、缺失、功能缺陷有关[8]。
强大的再生修复能力是子宫内膜的主要特点。子宫内膜基底层受损是子宫内膜再生修复障碍主要原因。相关研究表明,子宫内膜再生修复的来源主要是子宫内膜干细胞存在于子宫内膜基底层[9]。2004年,Chan等[10]首次利用细胞克隆技术从子宫内膜组织单细胞悬液中培养出上皮细胞和间质细胞克隆,证实子宫内膜中存在干细胞。胡嘉[11]研究关于从健康生育年龄女性的月经血分离得到内膜干细胞,并证明该细胞具有超强的增殖能力,认为此细胞在内膜的再生中有重要作用。当严重的内膜损伤如子宫内膜电切术、产后刮宫创伤、子宫内膜炎等均可以导致子宫内膜干细胞数量减少或功能受损,内膜无法完全再生并瘢痕化,最终导致IUA。
干细胞分为胚胎干细胞和成体干细胞,不同来源的干细胞如骨髓干细胞、胚胎干细胞、脐带血干细胞和月经血来源干细胞等都有用于治疗IUA的研究报道。Santamaria等[12]研究自体移植CD133阳性的骨髓来源干细胞在治疗难治性IUA和子宫内膜萎缩中的疗效,16位患者中,15个恢复了月经,其中2名分娩足月儿。Cao等[13]将加载人脐带血间充质干细胞的可降解胶原支架移植到IUA复发者的宫腔,患者子宫内膜平均厚度增加,妊娠率约为40%(10/26)。前期,临床治疗IUA的应用中以骨髓来源的干细胞为主,但骨髓干细胞的收集具有侵入性,细胞的增殖能力随年龄增长而下降,患者接受性差等缺陷限制其在临床中的应用。
MenSCs和骨髓间充质干细胞相比,有相似的表型和特性,如呈长梭形旋涡状生长,细胞表面分子和三胚层分化能力。MenSCs表达间充质干细胞表面分子CD105、CD73、CD90、CD29,不表达造血干细胞表面分子CD34、CD45和CD133。然而,有研究报道MenSCs表达其他来源间充质干细胞不表达的多能胚胎干细胞表面标记分子,如SSEA-4、Nanog、Oct-4[14]。研究证实,MenSCs经体外诱导培养,可以向脂肪、成骨、内皮、心肌、神经、呼吸上皮、肝脏等细胞分化[15]。MenSCs还具有免疫调节作用。在溃疡性肠炎小鼠中,MenSCs减少炎症细胞,如巨噬细胞、NK细胞的浸润,降低炎症因子IL-2和TNF-α的含量而升高IL-4及IL-10的含量[16]。有学者在电损伤致小鼠IUA模型中静脉注射人来源的MenSCs,MenSCs能够显著增加内膜厚度,促进血管生成,怀孕率和胚胎数 量 显 著 升高[17]。Tan等[18]利 用CD44、CD73、CD90和CD105阳性的月经血干细胞治疗7名重度宫腔粘连的患者,所有患者子宫内膜均增厚,1名自然怀孕,2名经胚胎移植后成功怀孕。
本研究结果显示,50例患者,宫腔移植CD73、CD105和CD90阳性的MenSCs后,经期、经量均较治疗前有不同程度的增加;子宫内膜厚度较治疗前增厚[(4.86±0.75)mm vs(7.45±0.87)mm)];子宫内膜形态较治疗前明显好转(P<0.001)。相关学者利用含有CD73、CD90和CD105阳性的月经血干细胞治疗重度宫腔粘连患者,所有患者子宫内膜均增厚的研究结果一致[19]。本研究50例患者中有23例临床妊娠(妊娠率46%),其中3例双胎妊娠,余为单胎妊娠。本研究的局限性在于妊娠结局不理想,可能与移植后子宫内膜中植入的MenSCs数量较少有关。移植后的干细胞聚集在受损的子宫内膜区域,自我复制并分化成为新的细胞亚群,增加子宫内膜腺体的数量,减少纤维化形成。研究表明,MenSCs在体内移植部位并没有大量的植入或分化,而是通过旁分泌机制增强组织修复或限制组织破坏[20]。基于此在后续的研究中,可以尝试联合使用细胞因子,如粒细胞集落刺激因子(granulocyte colony stimulating factor,G-CSF),通过细胞因子的促进血管生产、抗细胞凋亡、抑制炎症反应、免疫调节等作用,增加子宫内膜厚度,改善子宫内膜容受性。黄伟媚等[20]通过盆底功能障碍治疗仪结合G-CSF宫腔灌注治疗60例患者,改善患者子宫内膜容受性,增加内膜厚度,同时还需区分非整倍体胚胎引起的妊娠丢失。
IUA的发生是多因素相互作用的结果,治疗与预防该病的复发仍然是当前面临的一个巨大的医学挑战,而基于干细胞治疗的再生医学为其创造条件,特别是MenSCs,来源广泛,其可从女性月经血中直接获取,易于收集、高增殖能力、多向分化潜能、低免疫原性,且不涉及伦理道德问题等优点,还可分泌多种抗炎细胞因子,具有更多的应用前景。但是目前干细胞治疗IUA的研究还处在初级阶段,研究数据有限,对干细胞治疗的安全性及如何提高干细胞治疗技术中移植细胞的归巢率及存活率尚不能明确,需要大样本的临床数据进一步验证。相信随着研究的进一步深入,基于间充质干细胞的子宫内膜修复和治疗将会更准确、有效。
综上所述,经血干细胞治疗IUA的安全性,并且可以促进内膜再生,增加IUA不孕患者的怀孕概率。
