肺炎支原体检验方法在医学检验中的应用价值探析
2022-09-15肖远
肖远
罗田县人民医院检验科,湖北黄冈 438600
呼吸系统类感染疾病是目前世界公认影响人类健康的主要疾病之一,据有关调查提示,全球每年死于呼吸系统感染疾病的人数占总死亡人数的1/3[1]。从临床对引发肺炎的病原体调查情况来看,近几年来以肺炎支原体(mycoplasma pneumoniae,MP)为代表的病原体其占据的位置越来越重要,也有报道指出MP就是导致社区获得性肺炎的主要致病原[2]。人类本身就对MP具有易感性,因此MP在全球范围内均有流行,因感染MP而发病的人数也有逐年升高趋势,加上支原体肺炎临床症状严重、诊治困难等特点,因此成为目前临床最为关注的公共卫生问题之一[3]。为了提高临床对MP的检出率,本文就LAMP、PCR两种检验方法的应用价值展开研究分析,以2020年1月—2021年3月期间罗田县人民医院诊治并确诊为支原体肺炎的500例患者为例,现报道如下。
1 资料与方法
1.1 一般资料
选取到本院内儿科接受诊治并确诊为支原体肺炎的患者,其中男335例,女165例;年龄7~62岁,平均(28.6±7.4)岁。由本院相关专业护士采用一次性咽拭子采集管对所有患者的咽拭子标本进行采集,采集完毕后所有咽拭子标本均送入本院检验科保存于-80℃的冰箱内。由检验科人员将患者咽拭子标本中MP的DNA提取出,并对其进行LAMP、PCR检验。本次研究经本院伦理委员会批准,并取得患者及其家属同意。
1.2 方法
所有患者的咽拭子标本均由专用的一次性咽拭子收集管进行收集,对患者的分泌物进行收集后将其置入2 mL的塑料离心管(eppendorf,EP)管内,随即在其中加入300µl的磷酸盐缓冲液(phosphate buffered saline,PBS),将溶液与患者分泌物进行漩涡处理(10 min),处理完成后取试管上清物300 µl备用[4]。首先对所有患者的咽拭子标本进行DNA提取,再将其装入MP-DNA的专用试剂盒内,DNA提取步骤详细操作如下所示。
利用提前准备好的GD缓冲液和PW缓冲液加入无水乙醇进行融合混合处理,然后在已经开始发生沉淀的液体中缓缓加入GA缓冲液,完毕后使用振荡器将其充分震荡直至彻底悬浮为止[5]。将之前与患者分泌物充分融合的PBS溶液拿出并取出其中经漩涡处理后悬浮的沉淀物1 mL,对这些沉淀物进行离心处理(1 000 rpm,1 min),注意取液时一定要尽量将上清液吸取干净[6]。将蛋白酶K放入温水中进行温热,时间为2 min,温浴完毕后加入到之前放入EP管的分泌物中,加入量为20µl,并将蛋白酶K与其充分混合,直到完全均匀为止[7]。再向混合均匀的EP管内逐渐加入缓冲液GB,震荡EP管20 s左右,然后将其放在47℃的环境内进行保存,放置时间为20 min左右,肉眼可见EP管内的溶液变得清亮即可,再将因离心操作而在管内壁上形成的水珠擦拭干净[8]。将上一步得到了溶液全部注入吸附柱CB3中,对其进行离心处理(12 000 rpm,10 s),完成后将里面的废液倒掉,最后再将其放入收集管内[9]。在试剂盒内的吸附柱CB3中加入缓冲液GD 500µl,再对其进行离心处理(12 000 rpm,30 s),结束后,倒掉其中的废液,再将其放入收集管。将上步操作所得CB3内加入PW缓冲液700 µl,之后进行离心处理(12 000 rpm,30 s),倒掉废液收回收集管。将上步所得CB3加入PW缓冲液500µl,离心处理(12 000 rpm,30 s),倒掉废液放回收集管。将上一步所得CB3放回收集管后10 min左右,将产生的吸附材料全部清理掉,并将残余的清洗液体晾干,再进行离心处理(12 000 rpm,10 min),处理完毕后将其中的废液倒掉,打开吸附柱CB3的盖子并将其放在室温下静置[10]。准备一个干净的离心管,并将吸附柱CB3转入其中,在其吸附膜的中间悬空位置滴入TE洗脱液(100µl),在室温下静置5 min,静置完毕后进行离心处理(12 000 rpm,2 min),最后将所有离心处理后的溶液进行收集存放[11]。
两种不同检验方法的具体实施内容如下:①PCR检验。在标本内加入纯水至25 mL,PCR检验方法需要在94℃的高温下进行预热,再将温度调至55℃进行退火,最后在68℃下进行延伸。将上述步骤循环30次,待标本充分反应后收集所得产物,对其实施琼脂糖凝胶电泳(2%)[12]。为了保证PCR反应充分,本次研究中将退火温度设置为55~58℃之间,以求标本可以在最适宜的退火温度下进行。PCR检验所需药品及用量:10*buffer(2.5 µl)、dNTP(2.0µl)、上引物(2.0µl)、下引物(1.0µl)、DNA模板(4.0µl)、酶(0.15µl)[13]。
②LAMP检验。以25 µl的总体积标本液对其进行加热处理,加热时间为2 min,此操作主要是为了让MP的DNA充分解链,然后再将标本液置入冰水中进行浸泡,时间为3 min,随即向其中加入8 U BstDNA聚合酶[14]。在62℃的恒温环境下让其进行充分反应(60 min),反应结束后再将温度调整到80℃,并对其进行加热处理(3 min),让聚合酶彻底变性,对反应后剩余的产物进行观察分析。为了优化LAMP反应,本次操作中设定了58℃、60℃、62℃以及64℃4个温度梯度。LAMP反应所需药品有AMpbuffer(2.5 µl)、dNTP(4 µl)、Mg2+(6 µl)、Betaine(4.5µl)、Loop(1µl)、LIP(1µl)、F3(1µl)、BIP(1µl)、B3(1µl)。
特异性检测:为了保证本次实验的特异性检出准确度,在实验完成后再选取院内其他几种常见的呼吸道疾病致病原进行检测,对其实施扩增反应,并利用琼脂糖凝胶电泳(2%)进行鉴定,对最后的凝胶成像系统进行扫描并通过计算机扫描计算检验标本的片断跑胶情况。
灵敏度检测:选取同样数量的阳性病例作为检测的母本,并将咽拭子中的MP-DNA按上述方式提取出,利用分光光度对其进行检测计算,得出该阳性模板的DNA浓度,再将其稀释10倍,随后进行琼脂糖凝胶电泳(2%),观察最后的跑胶结果,若在10-1、10-2、10-3各个梯度上都没能够对其进行扩增反应,那么即可判定其为该梯度上一级为LAMP反应的极限梯度。
1.3 统计方法
采用SPSS 21.0统计学软件进行数据处理,计数资料以频数或率(%)表示,采用χ2检验,P<0.05为差异有统计学意义。
2 结果
2.1 两种检验方式检出阳性率对比
两种检验方法的阳性检出率比较,差异有统计学意义(P<0.05)。见表1。
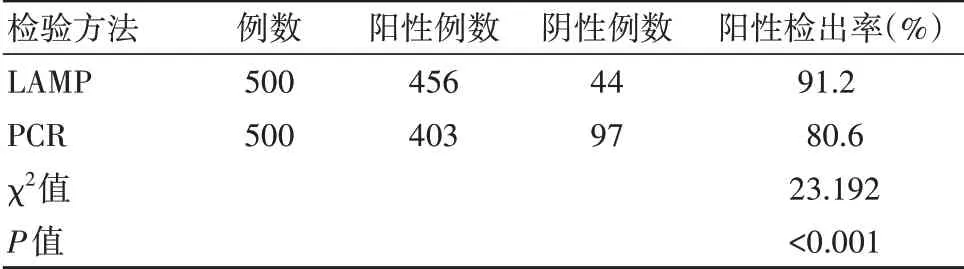
表1 两种检验方法检出阳性率情况对比
2.2 两种检验方法特异性对比
对肺炎常见病原体(大肠埃希菌、铜绿假单胞菌、粪肠杆菌、肺炎支原体等)DNA进行荧光PCR检测。检测结果见图1,大肠埃希菌、铜绿假单胞菌及粪肠杆菌在0~100 min内均未发生显著的荧光富集,这说明本方法在等温条件下肺炎支原体的检测特异性较高,可以进行推广应用。见图1。

图1 两种检验方法的特异性结果
2.3 两种检验方法灵敏度对比
为了考察本检测方法的灵敏度,将肺炎支原体DNA进行梯度稀释。在10-1、10-2、10-3各个梯度1稀释区间,产生扩增信号的时间随着浓度降低逐渐推移,呈现很好变化趋势。因此利用靶标浓度的负对数和其扩增荧光信号的Cq作一次函数,并得出其对应的数学函数公式为Cq=60147-6881gA(mol)(A表示检测靶标的物质的量,R²=0.971 4),其线性范围跨度3个数量级,检测范围宽。
3 讨论
MP可在各个年龄段人群内发生感染,因此对于各个年龄阶段的人群来说其都是一个非常重要的病原体,有大概率会引发人体发生严重的呼吸道疾病。据临床有关调查数据显示,社区获得性肺炎中因MP所引起的支原体肺炎(mycoplasma pneumonia,MPP)占所有肺炎发病患者数量的20%~45%之间,且近年来此占比还有不断上升的趋势[15]。除了临床常见的呼吸道感染疾病之外,人体感染MP之后可能还会进一步诱发人体的多个器官发生肺外并发症,临床中最常见的并发症就有溶血性贫血、肾炎,症状严重且未能得到有效治疗的患者还会有致死风险。MP的传播途径主要为口鼻飞沫,且儿童感染的概率会比青年人和老年人更大,且春夏秋冬都可发作,没有地域性差异,以秋冬季节为主要发病时期,每3年左右就会流行一次[16]。MP好发于人口密集场所,比如学校、医院等人口密集的场所发生MP感染的情况要明显多于其他人口稀疏的场所。如果MPP早期未得到有效检出,那么其除了可引发患者肺部损伤之外,还可能会继发损害患者体内的其他系统,常见的受损系统有中枢神经系统、心血管系统以及血液系统[17]。
目前MP检测的金标准为分离培养,MP分离培养虽然可以极大程度地检测出MP,但培养的条件非常苛刻,且MP本身的生长速度缓慢,因此一般需要进行3 d左右的分离培养操作才能显现出MP典型的菌落群形状,因此并不适用于临床快速检验MP。PCR和LAMP是目前临床实验室中较常见的检验方法,其中PCR研究发展最为成熟,通过合理设计引物进行PCR反应来判断患者是否被MP感染,以此能有效地检出MP,但PCR所需设备比较昂贵,对检验人员的技术要求也非常高,虽然其检验的准确性得到了广泛认可,但却并没有得到推广。LAMP是目前临床新发展的一种检验方法,临床有医学研究对当地1 702例肺炎患者的数据进行分析,可见这些患者通过LAMP检测的阳性率(91.37%)要高于通过PCR检测的阳性率(79.53%)[18]。从本次研究的结果来看,LAMP检验阳性检出率91.2%高于PCR检验阳性检出率80.6%(P<0.05),与其他临床对LAMP和PCR检验方法的研究结果基本一致,LAMP只需要恒温水浴锅即可满足检验要求,其反应产生物更是可以直接用肉眼观察判断,省去了PCR反应后还需要继续进行跑胶的步骤,进一步加快了检验的速度。
综上所述,本研究中,发现LAMP检验方法较PCR特异性、敏感度都更高,因此得出结论:LAMP检验方法检测MP更加敏感,且其只需要进行很短的实验时间,因此有较理想的发展应用前景。但不可忽视的是其反应所需温度环境要求较高,因此还需要临床不断进行研究和探索,克服其存在的这些问题。
