蛇葡萄素对人膀胱癌J82细胞增殖和凋亡的影响及相关作用机制探讨
2022-09-15赵新吴勇杰闫抗抗龙强
赵新,吴勇杰,闫抗抗,龙强
西北大学附属医院·西安市第三医院1药剂科,3泌尿外科,西安 710018 2兰州大学药理研究所,兰州 730000
膀胱癌是男性常见的泌尿生殖系统肿瘤,患者主要表现为血尿、尿频、排尿困难等症状,明显影响患者的生活质量[1]。经尿道膀胱肿瘤电切术(transurethral resection of bladder tumor,TURBT)是目前治疗非肌层浸润性膀胱癌的主要方法,临床一般与化疗联合应用,以降低肿瘤复发率,但化疗可导致明显的不良反应,部分患者的耐受性较差[2]。因此,研制出膀胱癌治疗效果好、不良反应小、价格低廉的化疗药物有重要意义。蛇葡萄素(ampelopsin,AMP)属于黄酮类化合物,具有抑制细菌生长、降低血糖、提高疼痛阈值、抗氧化等作用[3-4]。近年来,关于AMP抗肿瘤的研究逐渐增多,有研究表明AMP可以抑制小鼠黑色素瘤细胞的侵袭和转移、下调B细胞淋巴瘤/白血病-2(B cell lymphoma/leukemia-2,Bcl-2)的表达、激活caspase 3通路,且对人肺癌GLC-82裸鼠移植瘤及人肝癌Bel-7402细胞均有明显的抑制作用[5-8]。既往研究发现,对小鼠注射AMP钠盐(AMP-Na)后,AMP-Na在小鼠前列腺、膀胱组织及尿液中的药物浓度均较高,且持续时间长,主要以有活性的原型药物形式进行排泄[9]。据此推断AMP可能对膀胱肿瘤有治疗优势,因此本研究选择人膀胱癌J82细胞株进行研究,旨在探讨AMP对人膀胱癌J82细胞增殖和凋亡的影响及相关作用机制,为AMP的临床应用提供依据,现报道如下。
1 材料与方法
1.1 细胞、主要试剂和仪器
人膀胱癌细胞株J82购自中科院上海细胞生物研究所细胞库。AMP冻干剂购自广东泰禾医药科技有限公司,顺铂购自齐鲁制药有限公司。RPMI1640培养基购自美国Gibco公司,噻唑蓝(methyl thiazolyl terazolium,MTT)购自美国Sigma公司,p-Bcl-2(Ser70)购自美国 Santa公司,p-Bad(Ser136)、人抗兔免疫球蛋白G(immunoglobulin G,IgG)、辣根过氧化物酶(horseradish peroxidase,HRP)-连接抗体均购自美国Cell Sign Technology公司。CO2培养箱购自美国Shellab公司,ELX800型酶联免疫检测仪购自美国Bio-Tek公司,Epics XL型流式细胞仪购自美国Beckman-Coulter公司,JY-SCZ2+型垂直电泳槽购自北京君意东方有限公司。
1.2 实验方法
1.2.1 细胞培养 取对数生长期的人膀胱癌J82细胞,置于RPMI1640培养液中充分混匀后,放入37℃、5% CO2培养箱中培养。定期观察,每2~3天传代1次。
1.2.2 MTT比色法检测细胞抑制情况 取对数生长期的人膀胱癌J82细胞,调整细胞浓度至8×104/L,接种于96孔培养板中,每孔90µl,将96孔培养板移入培养箱中,37℃、5% CO2培养24 h。向细胞悬液中加入10 µl不同浓度(分别为40.00、44.74、50.04、55.96、62.59、70.00 μg/ml)的AMP,以细胞悬液+药物溶媒为阴性对照、完全培养液+药物溶媒为空白对照、完全培养液+不同浓度的AMP为颜色对照,每个浓度和对照组均设置3个复孔。AMP作用48、72 h后,每孔加入10 µl的MTT(浓度为5 mg/ml)继续孵育4 h,加入10%的十二烷基硫酸钠(sodium dodecylsulfate,SDS),终止培养。微量振荡器振荡使结晶物充分溶解,使用酶联免疫检测仪检测570 nm处的光密度(optical density,OD)值。计算抑制率(inhibition rate,IR),IR=(阴性对照OD均值-受试药OD均值)/阴性对照OD均值×100%,其中阴性对照OD均值=阴性对照OD均值-空白对照OD均值,受试药OD均值=受试药OD均值-颜色对照OD均值。采用Curve Expert 1.3软件计算半数抑制浓度(half inhibitory concentration,IC50)。
1.2.3 流式细胞术检测细胞凋亡情况 取对数生长期的人膀胱癌J82细胞,调整细胞浓度至8×104/L,每100 ml培养瓶加入9 ml细胞悬液后移入培养箱,继续培养24 h,使其贴壁。分别向细胞悬液中加入 1 ml 40.00、50.04、62.59 μg/ml的 AMP,分别作为 40.00 μg/ml AMP 组、50.04 μg/ml AMP 组、62.59 μg/ml AMP组,向细胞悬液中加入1 ml 2.00 μg/ml的顺铂,作为阳性对照组,以细胞悬液+1 ml药物溶媒为阴性对照组。将培养瓶移入培养箱中,加入膜联蛋白V(Annexin V)-异硫氰酸荧光素(fluorescein isothiocyanate,FITC)/碘 化 丙 啶(propidium iodide,PI)继续培养48 h后离心收集细胞,使用流式细胞仪检测细胞凋亡率。
1.2.4 透射电镜观察细胞形态 取对数生长期的人膀胱癌J82细胞,调整细胞浓度为8×104/L,每100 ml培养瓶加入9 ml细胞悬液,将培养瓶移入培养箱中,继续培养24 h使其贴壁。向细胞悬液中加入 1 ml浓 度 为 40.00 μg/ml的 AMP,作为40.00 μg/ml AMP组,向细胞悬液中加入1 ml浓度为2.00 μg/ml的顺铂,作为阳性对照组,以细胞悬液+药物溶媒为阴性对照组。将培养瓶移至培养箱中继续培养48 h后离心收集细胞后,磷酸盐缓冲液(phosphate buffered solution,PBS)冲洗2次,3%戊二醛固定过夜,使用透射电镜观察细胞。
1.2.5 蛋白质印迹法(Western blot)检测细胞Bcl-2、Bad蛋白的表达 取对数生长期的人膀胱癌J82细胞,调整细胞浓度为8×104/L。每500 ml培养瓶中加入细胞悬液36 ml,培养24 h,使其贴壁。随后分别加入 4 ml浓度为 0、40.00、50.04、62.59、70.00 μg/ml的AMP,然后将浓度为0、40.00、50.04、62.59 μg/ml的细胞移入培养箱继续培养48 h,浓度为70.00 μg/ml的细胞移入培养箱中分别培养12、24、48 h。用预冷的PBS冲洗培养瓶底的贴壁细胞,用细胞刮刀将培养瓶底的贴壁细胞轻轻刮下,离心收集细胞,并将其与培养基里收集的细胞合并。冰上裂解30 min,离心吸取上清,即为所提取的蛋白。二喹啉甲酸(bicinchoninic acid,BCA)法测定蛋白浓度,十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(sodium dodecylsulfate-polyacrylamide gel electrophoresis,SDS-PAGE)分离蛋白样品,脱脂奶粉封闭聚偏二氟乙烯(polyvinylidene fluoride,PVDF)膜1 h。加入p-Bcl-2、p-Bad一抗,加入HRP标记的二抗,取出PVDF膜,洗涤3次,每次5 min。洗膜后电化学发光(electrochemiluminescence,ECL)法显色并曝光,以β-actin为内参,计算目的蛋白的相对表达量。
1.3 统计学方法
采用SPSS 23.0软件对所有数据进行统计分析,计量资料以均数±标准差(±s)表示,两组间比较采用t检验,多组间比较采用单因素方差分析,以P<0.05为差异有统计学意义。
2 结果
2.1 不同浓度的AMP对人膀胱癌J82细胞增殖能
力的影响
不同浓度AMP处理人膀胱癌J82细胞48、72 h,IR随AMP浓度升高、作用时间的延长而升高,差异均有统计学意义(P<0.01),具有明显的浓度依赖性和时间依赖性(表1)。AMP处理48 h的IC50为(57.16±1.86)μg/ml,明显高于AMP处理72 h的(45.00±3.54)μg/ml,差异有统计学意义(t=2.776,P=0.006)。
表1 不同浓度AMP处理人膀胱癌J82细胞48、72 h时IR的比较(%,±s)
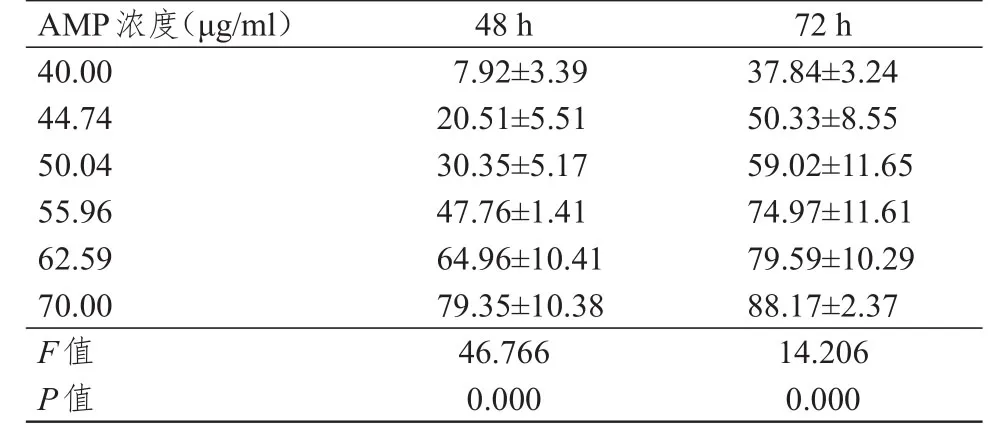
表1 不同浓度AMP处理人膀胱癌J82细胞48、72 h时IR的比较(%,±s)
A M P浓度(μ g/m l)4 0.0 0 4 4.7 4 5 0.0 4 5 5.9 6 6 2.5 9 7 0.0 0 F值P值7.9 2±3.3 9 2 0.5 1±5.5 1 3 0.3 5±5.1 7 4 7.7 6±1.4 1 6 4.9 6±1 0.4 1 7 9.3 5±1 0.3 8 4 6.7 6 6 0.0 0 0 3 7.8 4±3.2 4 5 0.3 3±8.5 5 5 9.0 2±1 1.6 5 7 4.9 7±1 1.6 1 7 9.5 9±1 0.2 9 8 8.1 7±2.3 7 1 4.2 0 6 0.0 0 0 4 8 h 7 2 h
2.2 不同浓度的AMP对人膀胱癌J82细胞凋亡情况的影响
40.00、5 0.04、62.59 μg/ml AMP 组和阳性对照组人膀胱癌J82细胞的总凋亡率均高于阴性对照组,40.00、50.04、62.59 μg/ml AMP 组人膀胱癌 J82细胞的总凋亡率均高于阳性对照组,差异均有统计学意义(P<0.05)。随着AMP浓度的增加,人膀胱癌J82细胞存活细胞率逐渐降低,早期凋亡率先上升后下降,晚期凋亡率和总凋亡率均逐渐升高。(表2、图1)
表2 不同浓度的AMP处理人膀胱癌J82细胞凋亡率的比较(%,±s)
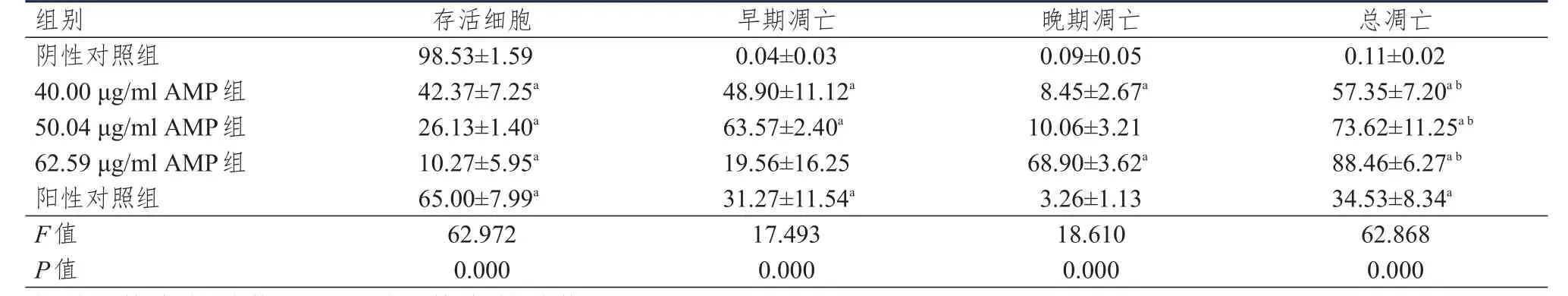
表2 不同浓度的AMP处理人膀胱癌J82细胞凋亡率的比较(%,±s)
注:a与阴性对照组比较,P<0.05;b与阳性对照组比较,P<0.05
组别阴性对照组4 0.0 0 μ g/m l A M P组5 0.0 4 μ g/m l A M P组6 2.5 9 μ g/m l A M P组阳性对照组F值P值9 8.5 3±1.5 9 4 2.3 7±7.2 5 a 2 6.1 3±1.4 0 a 1 0.2 7±5.9 5 a 6 5.0 0±7.9 9 a 6 2.9 7 2 0.0 0 0 0.0 4±0.0 3 4 8.9 0±1 1.1 2 a 6 3.5 7±2.4 0 a 1 9.5 6±1 6.2 5 3 1.2 7±1 1.5 4 a 1 7.4 9 3 0.0 0 0 0.0 9±0.0 5 8.4 5±2.6 7 a 1 0.0 6±3.2 1 6 8.9 0±3.6 2 a 3.2 6±1.1 3 1 8.6 1 0 0.0 0 0 0.1 1±0.0 2 5 7.3 5±7.2 0 a b 7 3.6 2±1 1.2 5 a b 8 8.4 6±6.2 7 a b 3 4.5 3±8.3 4 a 6 2.8 6 8 0.0 0 0存活细胞早期凋亡晚期凋亡总凋亡
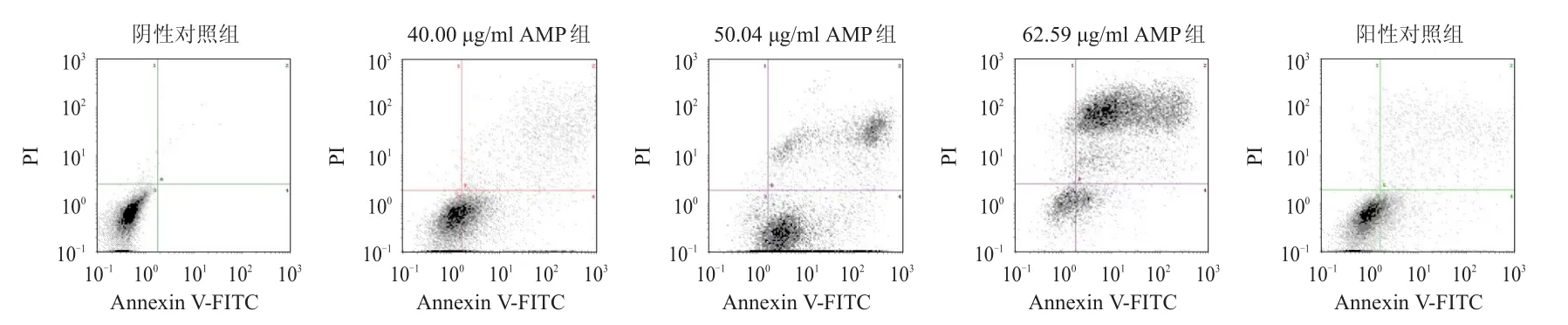
图1 不同浓度AMP对人膀胱癌J82细胞凋亡情况的影响
2.3 透射电镜观察AMP对人膀胱癌J82细胞形态的影响
40.00 µg/ml的AMP、2.00 µg/ml的顺铂作用于人膀胱癌J82细胞48 h后,透射电镜下可见凋亡细胞体积变小,细胞质浓缩,出现凋亡小体。(图2)
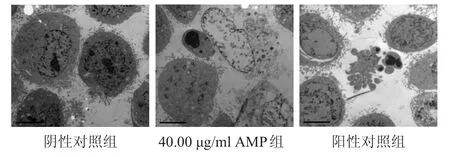
图2 透射电镜观察各组J82细胞形态(×5000)
2.4 不同浓度的AMP对人膀胱癌J82细胞凋亡抑制蛋白p-Bad、p-Bcl-2表达的影响
作用 48 h,0、40.00、50.04、62.59 μg/ml的 AMP处理的人膀胱癌J82细胞凋亡抑制蛋白p-Bad、p-Bcl-2相对表达量比较,差异均无统计学意义(P>0.05)。作用12、24、48 h,70 µg/ml的AMP处理的人膀胱癌J82细胞凋亡抑制蛋白p-Bad、p-Bcl-2相对表达量比较,差异均有统计学意义(F=6.750、7.403,P<0.05);70 µg/ml的AMP处理的人膀胱癌J82细胞处理24、48 h后,凋亡抑制蛋白p-Bad、p-Bcl-2的相对表达量均低于处理12 h时,差异均有统计学意义(P<0.05)。(表3)
表3 不同时间不同浓度AMP处理的人膀胱癌J82细胞凋亡抑制蛋白p-Bad、p-Bcl-2相对表达量的比较(±s)
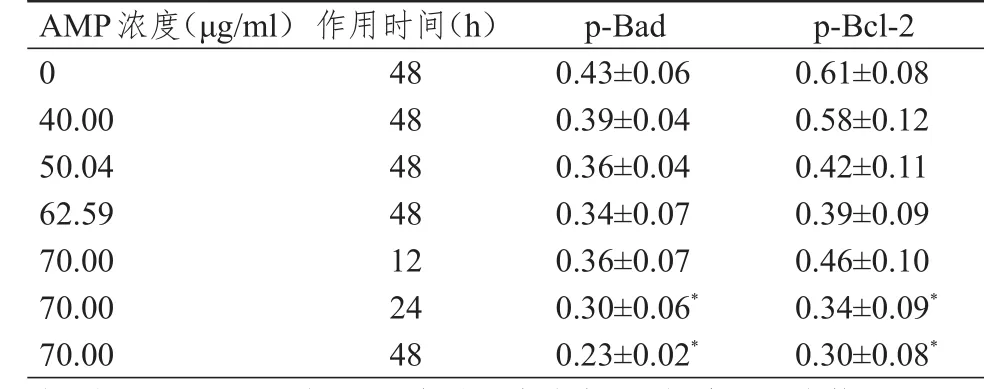
表3 不同时间不同浓度AMP处理的人膀胱癌J82细胞凋亡抑制蛋白p-Bad、p-Bcl-2相对表达量的比较(±s)
注:*与70.00 μg/ml的AMP处理人膀胱癌J82细胞12 h比较,P<0.05
A M P浓度(μ g/m l)0 4 0.0 0 5 0.0 4 6 2.5 9 7 0.0 0 7 0.0 0 7 0.0 0 4 8 4 8 4 8 4 8 1 2 2 4 4 8 0.4 3±0.0 6 0.3 9±0.0 4 0.3 6±0.0 4 0.3 4±0.0 7 0.3 6±0.0 7 0.3 0±0.0 6*0.2 3±0.0 2*0.6 1±0.0 8 0.5 8±0.1 2 0.4 2±0.1 1 0.3 9±0.0 9 0.4 6±0.1 0 0.3 4±0.0 9*0.3 0±0.0 8*作用时间(h)p-B a d p-B c l-2
3 讨论
膀胱癌发病机制复杂,目前,膀胱癌的发生主要与遗传、吸烟、致癌物接触等有关,其中氨甲蝶呤、长春新碱、表柔比星等均是常用的膀胱癌术后灌注药物,但上述药物在杀伤肿瘤细胞的同时会对正常组织细胞产生杀伤作用,且复发率高、容易产生耐药性,使临床应用受到一定限制[10]。AMP广泛存在于藤茶等植物中,是具有多种生物活性的黄酮类物质,研究认为,AMP可对肿瘤细胞产生抑制作用,但并未对正常细胞产生明显的促凋亡效果[11]。研究发现,AMP能够通过抑制新生血管生成、抑制细胞增殖、激活氧化应激等生理过程,促进乳腺癌等肿瘤细胞的凋亡[12]。明确AMP对人膀胱癌J82细胞增殖、凋亡等的影响,可为临床膀胱癌的治疗提供新的方向。
Zhao等[13]研究发现,AMP能够通过磷脂酰肌醇-3-激酶(phosphoinositide 3-kinases,PI3K)/蛋白激酶B(protein kinase B,PKB,又称AKT)信号通路抑制肾细胞癌细胞的增殖和转移,且仅对肾细胞癌细胞具有细胞毒性。Truong等[14]探讨AMP对MDA-MB-231/IR细胞的抑制作用显示,AMP可通过肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)/核因子 κB(nuclear factor-κB,NF-κB)信号通路来诱导MDA-MB-231/IR细胞凋亡,抑制其干细胞特征,并通过抑制上皮-间充质转化抑制MDA-MB-231/IR细胞的迁移能力。此外,AMP还可通过降低MDA-MB-231/IR细胞的耗氧率抑制三磷酸腺苷的产生,以明显削弱氧化磷酸化作用。Li等[15]通过培养乳腺癌MDA-MB-231和MCF-7细胞,探讨AMP抗乳腺癌的机制,结果发现,AMP诱导乳腺癌细胞的凋亡与线粒体功能障碍有关,包括线粒体膜电位的丧失、大量活性氧的产生等生理机制。
本研究结果显示,AMP可明显抑制人膀胱癌J82细胞的增殖,且其抑制效果具有浓度依赖性和时间依赖性,其中70 μg/ml的AMP作用72 h后,IR可达88.17%,提示AMP抗肿瘤效果较好。流式细胞术是检测细胞凋亡的常用方法,能够对早期凋亡、坏死细胞等进行有效区分。其中J82细胞经过离心等操作后可促使少量的细胞凋亡和坏死,加入AMP后,可见细胞凋亡率明显提高[16]。本研究中,低浓度AMP处理J82细胞时,细胞以早期凋亡为主,随着AMP浓度的增加,J82细胞的晚期凋亡率逐渐增加。由此可见,随着AMP浓度的升高,J82细胞从正常细胞向凋亡早期,进而向凋亡晚期发展。表明AMP诱导的人膀胱癌J82细胞早期凋亡和晚期凋亡均具有浓度依赖性。表明AMP发挥抗肿瘤作用的机制之一可能是诱导肿瘤细胞凋亡,并进一步促进细胞凋亡坏死[17]。
细胞凋亡下细胞形态可发生明显变化,包括染色质浓缩、凋亡小体形成等。本研究结果显示,透射电镜下可见凋亡小体和细胞质浓缩,进一步表明AMP可诱导J82细胞凋亡。细胞凋亡的发生机理复杂,生理状态下,p-Bad可与14-3-3蛋白结合形成稳定的复合物,稳定存在于细胞中发挥抗凋亡效应。研究显示,Bad去磷酸化后可发挥促进细胞凋亡的效应[18-19],Bcl-2发生磷酸化会增强其抗凋亡活性[20],本研究选取的是70位点磷酸化的p-Bcl-2。本研究为探索AMP诱导J82细胞凋亡的机制,检测了抗细胞凋亡相关蛋白p-Bcl-2、p-Bad的相对表达量,结果显示,AMP能够下调抗细胞凋亡相关蛋白p-Bcl-2、p-Bad的相对表达量。表明AMP诱导细胞凋亡的可能的发生机制。本研究中,p-Bcl-2、p-Bad的相对表达量随AMP浓度升高、给药时间的延长而逐渐降低。表明AMP可能通过下调抗细胞凋亡蛋白p-Bcl-2、p-Bad的表达促进人膀胱癌J28细胞的凋亡。
综上所述,AMP可有效抑制人膀胱癌J82细胞的增殖,促进其凋亡,其诱导机制可能与其能够下调抗细胞凋亡蛋白p-Bad、p-Bcl-2的表达有关,但AMP对膀胱癌细胞的作用机制复杂,仍需要深入探讨。
