血清糖类抗原125、糖类抗原19-9、血清铁蛋白在宫颈癌诊断及预后评估中的临床意义
2022-09-15周明付玉兰雷磊许昭孟菲
周明,付玉兰,雷磊,许昭,孟菲
1陕西省肿瘤医院妇瘤三病区,西安 710061
2陕西中医药大学第二附属医院产科,陕西 咸阳 710000
流行病学调查显示,全球每年新增宫颈癌病例达50万例,其中中国宫颈癌病例占30%[1]。人乳头瘤病毒(human papilloma virus,HPV)感染是引发宫颈癌的重要原因。病理活检穿刺是临床诊断宫颈癌、评估治疗效果及预后的重要方法,但由于存在创伤性,患者接受度较低,难以在临床中推广[2]。研究表明,血清肿瘤标志物在恶性肿瘤的诊断和预后评估中发挥重要作用,具有接受程度高、操作方便等优点[3]。研究证实,糖类抗原125(carbohydrate antigen 125,CA125)、糖类抗原19-9(carbohydrate antigen 19-9,CA19-9)在宫颈癌患者中高表达[4]。血清铁蛋白(serum ferritin,SF)是临床诊断缺铁性贫血的常用指标,近年来发现恶性肿瘤患者中SF水平明显升高[5]。本研究探讨血清CA125、CA19-9、SF在宫颈癌诊断及预后评估中的临床意义,现报道如下。
1 资料与方法
1.1 一般资料
选取2018年1月至2020年1月陕西省肿瘤医院收治的宫颈癌患者。纳入标准:①符合《宫颈癌及癌前病变规范化诊疗指南(试行)》[6]中宫颈癌的诊断标准;②年龄为30~80岁;③有性生活史;④精神正常、意识清楚。排除标准:①接受过放化疗、手术治疗;②妊娠期或哺乳期女性;③合并营养不良、贫血;④具有酒精、药物滥用史;⑤合并凝血功能障碍。依据纳入和排除标准,本研究共纳入80例宫颈癌患者,作为A组。选取同期陕西省肿瘤医院收治的80例宫颈良性肿瘤患者和80例健康体检者,分别作为B组和C组。A组患者年龄为35~72岁,平均(54.62±5.14)岁;B 组患者年龄为32~76岁,平均(54.55±5.27)岁;C 组患者年龄为35~71岁,平均(54.49±5.66)岁。3组研究对象的年龄比较,差异无统计学意义(P>0.05),具有可比性。本研究经医院伦理委员会审批通过,所有患者均知情同意并签署知情同意书。
1.2 检测方法
A组、B组在入院后第1天采集静脉血,C组在体检时采集静脉血。具体操作如下:抽取所有受检者的空腹静脉血5 ml,3500 r/min离心12 min,离心半径为8 cm,分离血清,采用电化学发光全自动免疫分析仪检测血清CA125、CA19-9、SF水平,试剂盒均购自上海博宏生物科技有限公司,所有操作均按照说明书完成。CA125正常参考值:≤35 U/ml,CA19-9正常参考值:≤37 U/ml,SF正常参考值:≤132 ng/ml[7]。
1.3 治疗方法
宫颈癌患者的治疗方法:第1天,给予135~175 mg/m2紫杉醇、60~75 mg/m2多西他赛,静脉滴注,每3周为1个疗程,共治疗1~2个疗程。然后给予腹腔镜手术治疗:患者全身麻醉,切开腹壁,牵拉子宫,处理血管及圆韧带,彻底暴露髂动脉,清除髂内、腹股沟、髂外、髂总动脉淋巴结,对腹主动脉旁淋巴结进行清扫,采用分离钳以及超声刀钝性分离腹主动脉以下部位,打开腹主动脉鞘,了解腹主动脉走形,遵循自上而下的原则将表面的淋巴结切除,然后打开输尿管隧道,对子宫颈段进行游离,进入输尿管、膀胱壁段,将主韧带、骶韧带切断3~4 cm,切除阴道旁组织,将子宫从阴道取出,缝合残端,对盆腹腔淋巴结进行清扫,置入引流管后将手术器械撤出,缝合腹腔。
1.4 观察指标及评价标准
A组、B组分别在入院后第1天评价卡氏功能状态(Karnofsky performance status,KPS)评分,C组在体检时评价KPS评分。KPS评分的总分为100分。100分:正常,无任何症状;90分:症状轻微,可以正常活动;80分:症状轻微,可勉强活动;70分:生活可自理,但无法工作;60分:生活大部分可自理,偶尔需要他人帮助;50分:经常需要他人照顾;40分:特别需要他人照顾;30分:生活严重无法自理;20分:病情危重,需给予积极对症治疗;10分:邻近死亡,病危;0分:死亡。身体状况越差,KPS评分越低[8]。
比较3组研究对象的血清CA125、CA19-9、SF水平及KPS评分,比较不同临床特征宫颈癌患者的血清CA125、CA19-9、SF水平及KPS评分。随访1年,比较死亡组、生存组宫颈癌患者的血清CA125、CA19-9、SF水平及KPS评分。分析血清CA125、CA19-9、SF水平与KPS评分的相关性。
1.5 统计学方法
采用SPSS 26.0软件对数据进行统计分析,符合正态分布的计量资料以均数±标准差(±s)表示,多组间比较采用单因素方差分析,两组间比较采用t检验;计数资料以例数和率(%)表示,组间比较采用χ2检验;采用Spearman相关分析法进行相关分析。以P<0.05为差异有统计学意义。
2 结果
2.1 3组研究对象血清CA125、CA19-9、SF水平及KPS评分的比较
3组研究对象的血清CA125、CA19-9、SF水平及KPS评分比较,差异均有统计学意义(P<0.01)。A组患者的血清CA125、CA19-9、SF水平均高于B组和C组,KPS评分低于B组和C组,B组患者的血清CA125、CA19-9、SF水平均高于C组,KPS评分低于C组,差异均有统计学意义(P<0.05)。(表1)
表1 3组研究对象血清CA125、CA19-9、SF水平及KPS评分的比较(±s)
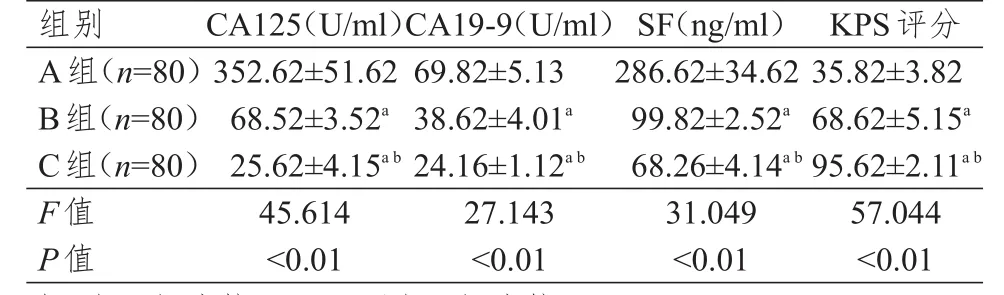
表1 3组研究对象血清CA125、CA19-9、SF水平及KPS评分的比较(±s)
注:a与A组比较,P<0.05;b与B组比较,P<0.05
组别A组(n=8 0)B组(n=8 0)C组(n=8 0)F值P值3 5 2.6 2±5 1.6 2 6 8.5 2±3.5 2 a 2 5.6 2±4.1 5 a b 4 5.6 1 4<0.0 1 6 9.8 2±5.1 3 3 8.6 2±4.0 1 a 2 4.1 6±1.1 2 a b 2 7.1 4 3<0.0 1 2 8 6.6 2±3 4.6 2 9 9.8 2±2.5 2 a 6 8.2 6±4.1 4 a b 3 1.0 4 9<0.0 1 3 5.8 2±3.8 2 6 8.6 2±5.1 5 a 9 5.6 2±2.1 1 a b 5 7.0 4 4<0.0 1 C A 1 2 5(U/m l)C A 1 9-9(U/m l)S F(n g/m l)K P S评分
2.2 不同临床特征宫颈癌患者血清CA125、CA19-9、SF水平及KPS评分的比较
Ⅲ~Ⅳ期宫颈癌患者的血清CA125、CA19-9、SF水平均明显高于Ⅰ~Ⅱ期患者,KPS评分明显低于Ⅰ~Ⅱ期患者,差异均有统计学意义(t=55.107、18.415、8.886、40.772,P<0.01);不同分化程度宫颈癌患者的血清CA125、CA19-9、SF水平及KPS评分比较,差异均有统计学意义(F=34.967、27.106、31.971、18.241,P<0.01)。不同病理类型宫颈癌患者的血清CA125、CA19-9、SF水平及KPS评分比较,差异均无统计学意义(P>0.05)。有盆腔淋巴结转移宫颈癌患者的血清CA125、CA19-9、SF水平均明显高于无盆腔淋巴结转移的患者,KPS评分明显低于无盆腔淋巴结转移的患者,差异均有统计学意义(t=89.554、101.759、55.725、13.746,P<0.01)。肿瘤直径>4 cm宫颈癌患者的血清CA125、CA19-9、SF水平均明显高于肿瘤直径≤4 cm的患者,KPS评分均明显低于肿瘤直径≤4 cm的患者,差异均有统计学 意 义(t=21.251、31.980、14.188、14.280,P<0.01)。(表2)
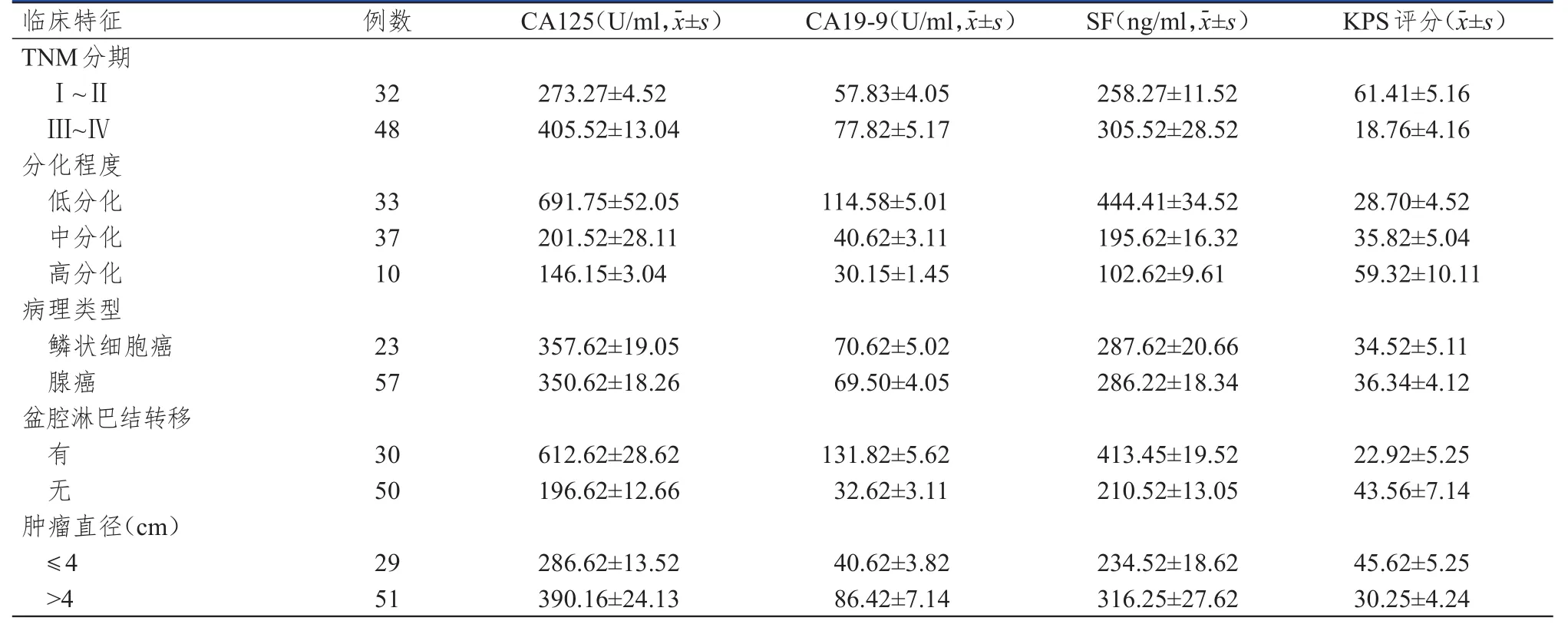
表2 不同临床特征宫颈癌患者血清CA125、CA19-9、SF水平及KPS评分
2.3 死亡组和生存组宫颈癌患者血清CA125、CA19-9、SF水平及KPS评分的比较
随访1年,41例患者生存,39例患者死亡。生存组宫颈癌患者的血清CA125、CA19-9、SF水平均明显低于死亡组,KPS评分明显高于死亡组,差异均有统计学意义(P<0.01)。(表3)
表3 死亡组和生存组宫颈癌患者血清CA125、CA19-9、SF水平及KPS评分的比较(±s)
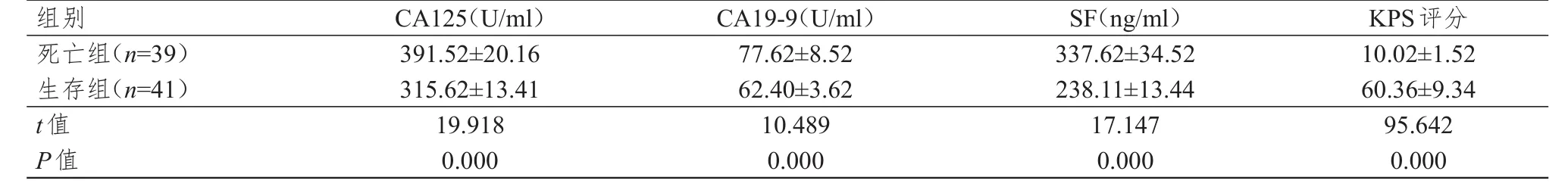
表3 死亡组和生存组宫颈癌患者血清CA125、CA19-9、SF水平及KPS评分的比较(±s)
组别死亡组(n=39)生存组(n=41)t值P值391.52±20.16 315.62±13.41 19.918 0.000 77.62±8.52 62.40±3.62 10.489 0.000 337.62±34.52 238.11±13.44 17.147 0.000 10.02±1.52 60.36±9.34 95.642 0.000 CA125(U/ml)CA19-9(U/ml)SF(ng/ml)KPS评分
2.4 血清CA125、CA19-9、SF水平与KPS评分的相关性
血清CA125、CA19-9、SF水平与KPS评分均呈负相关(r=-0.528、-0.424、-0.511,P<0.01)。
3 讨论
据调查显示,中国每年新增宫颈癌病例达13万例,死亡病例达5.3万例,宫颈癌具有极高的病死率[9]。多孕多产、吸烟、多个性伴侣、过早性行为、免疫功能减退等均是诱发宫颈癌的危险因素[10]。宫颈癌患者临床症状出现的时间在影像学改变的前3~6个月,因此CT、彩超等影像学检查存在一定的局限性[11]。近年来,血清肿瘤标志物被广泛应用于恶性肿瘤的早期诊治、疗效评估以及随访监测中,具有检测方便、可重复、创伤性小等优点,患者接受度和耐受性良好[12]。
CA19-9属于糖类蛋白肿瘤标志物,多被用于消化道肿瘤的诊断,近年来有学者发现,宫颈癌患者的血清CA19-9水平也较高[13]。CA125是一种胚胎抗原,在健康人体中基本检测不出,一旦生殖系统发生病变,血清中CA125水平会显著升高,但其特异度较低,即使是良性肿瘤也会导致血清CA125水平升高[14-15]。SF是近年来兴起的一种血清肿瘤标志物,SF升高意味着机体铁超载,诸多致癌因子会对铁代谢造成干扰,减少铁排出量,导致大量的铁元素在体内蓄积[16-17]。本研究结果显示,A组患者的血清CA125、CA19-9、SF水平均高于B组和C组,KPS评分低于B组和C组,B组患者的血清CA125、CA19-9、SF水平均高于C组,KPS评分低于C组,差异均有统计学意义(P<0.05)。表明宫颈癌患者的血清CA125、CA19-9、SF水平均高于宫颈良性肿瘤患者和健康人群。段金霞等[18]研究中,宫颈癌组患者的血清CA125水平为(54.63±5.74)U/ml,高于良性组患者的(31.05±5.35)U/ml和对照组的(29.71±5.47)U/ml,差异均有统计学意义(P<0.05),与本研究结果相似,证实了宫颈癌患者的血清CA125水平更高。
本研究结果还显示,Ⅲ~Ⅳ期、有盆腔淋巴结转移、肿瘤直径>4 cm宫颈癌患者的血清CA125、CA19-9、SF水平均明显高于Ⅰ~Ⅱ期、无盆腔淋巴结转移、肿瘤直径≤4 cm的患者,KPS评分均明显低于Ⅰ~Ⅱ期、无盆腔淋巴结转移、肿瘤直径≤4 cm的患者,差异均有统计学意义(P<0.01);不同分化程度宫颈癌患者的血清CA125、CA19-9、SF水平及KPS评分比较,差异均有统计学意义(P<0.01),分化程度越低,血清CA125、CA19-9、SF水平越高,KPS评分越低。不同病理类型宫颈癌患者的血清CA125、CA19-9、SF水平及KPS评分比较,差异均无统计学意义(P>0.05)。表明宫颈癌患者病情越严重,血清CA125、CA19-9、SF水平越高。分析原因如下:宫颈癌患者临床分期越晚、分化程度越低、肿瘤直径越大以及有盆腔淋巴结转移,表明机体肿瘤细胞越多,肿瘤标志物CA125、CA19-9水平会不断升高。大量的肿瘤细胞会合成大量的SF,直接造成组织细胞变性、损伤、坏死等,导致机体释放更多的SF,因此,病情越严重的宫颈癌患者,SF水平越高[19]。刘云等[20]研究显示,中晚期组宫颈癌患者的血清CA19-9水平为(639.32±356.19)U/ml,高于早期组患者的(23.67±23.17)U/ml(P<0.05),表明临床分期越晚,血清CA19-9水平越高。本研究结果还显示,生存组宫颈癌患者的血清CA125、CA19-9、SF水平均明显低于死亡组,KPS评分明显高于死亡组,差异均有统计学意义(P<0.01)。血清CA125、CA19-9、SF水平与KPS评分均呈负相关(P<0.01)。表明预后越差的患者,血清CA125、CA19-9、SF水平越高,临床可将血清CA125、CA19-9、SF水平升高作为预测宫颈癌患者预后不良的参考指标之一。
综上所述,宫颈癌患者随着病情恶化,血清CA125、CA19-9、SF水平会逐渐升高,临床可通过动态监测血清CA125、CA19-9、SF变化,对宫颈癌患者的病情及预后进行准确诊断与评估。
