途中调整放疗靶区范围对局部晚期宫颈癌患者疗效和不良反应的影响△
2022-09-15蓝柳陈海辉刘威赵迎喜莫玉珍
蓝柳,陈海辉,刘威,赵迎喜,莫玉珍#
1广西科技大学第二附属医院肿瘤放射治疗三病区,广西 柳州 545005
2广西医科大学第四附属医院肿瘤科,广西 柳州 545005
3广州红十字会医院肿瘤科,广州 510220
对于局部晚期宫颈癌,以铂类为基础的同步放化疗作为标准治疗方案明显提高了患者的疗效并延长了生存时间,但是其导致的放射性直肠炎及放射性膀胱炎发生率较高,严重影响了患者的生活质量和疾病预后。虽然现在已经广泛应用调强放疗(intensity modulated radiation therapy,IMRT)技术进行放疗,在一定程度上降低了直肠及膀胱受照剂量,但受到直肠、膀胱充盈状态变化和肿瘤缩退等多因素影响,直肠和膀胱在实际治疗中受照剂量仍高于初始计划,所导致的放射性直肠炎及放射性膀胱炎不容忽视[1-2]。因此,本研究收集了同时期IMRT放疗途中调整与未调整放疗靶区范围的局部晚期宫颈癌患者的病历资料,旨在分析途中调整放疗靶区范围对局部晚期宫颈癌患者疗效以及不良反应的影响,现报道如下。
1 资料与方法
1.1 一般资料
收集2011年2月至2014年1月于广西医科大学第四附属医院治疗的局部晚期宫颈癌患者的病历资料。纳入标准:国际妇产科联盟(International Federation of Gynecology and Obstetrics,FIGO)分期为ⅡA2~ⅢB期;病理诊断为宫颈鳞状细胞癌;血常规、生化指标和凝血功能正常;美国东部肿瘤协 作 组(Eastern Cooperative Oncology Group,ECOG)体力状况评分≤2分;积极配合治疗。排除标准:合并其他全身性血液性疾病或严重脏器疾病;合并其他恶性肿瘤;年龄>65岁。根据纳入、排除标准,共纳入273例局部晚期宫颈癌患者,按是否途中调整放疗靶区范围分为调整靶区组(129例)和非调整靶区组(144例),调整靶区组在15次盆腔外放疗后调整放疗计划。两组患者均在放疗开始后每周静脉注射35~40 mg/m2顺铂同步化疗。两组患者各临床特征比较,差异均无统计学意义(P>0.05)(表1),具有可比性。本研究经医院伦理委员会批准通过,所有患者均知情同意并签署知情同意书。
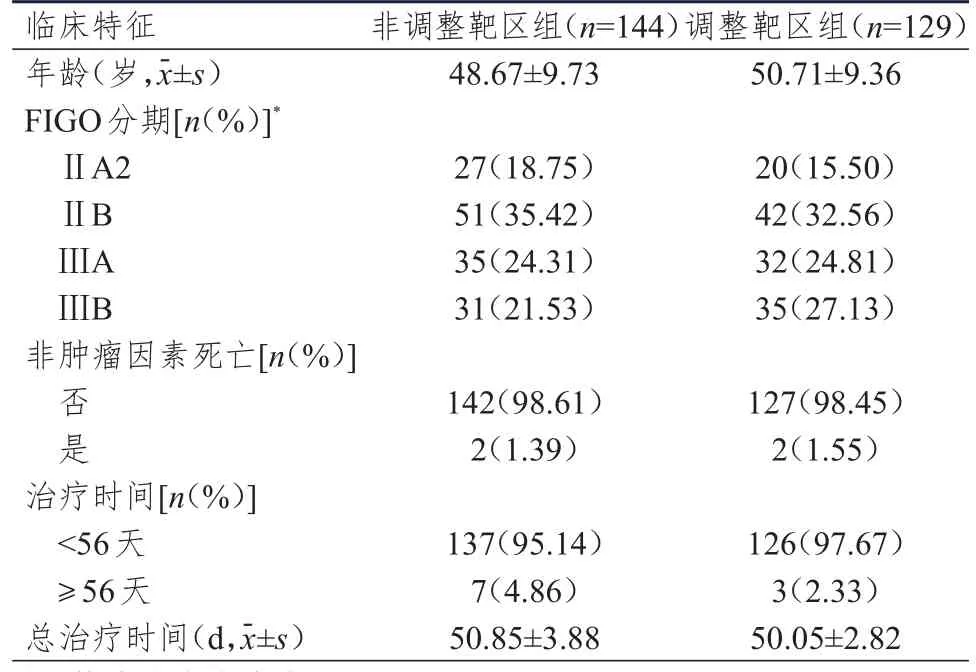
表1 两组患者的临床特征
1.2 放疗计划与实施
患者CT模拟定位前1 h排空膀胱,并服用20 ml泛影葡胺+500 ml水,让患者在骨盆基板上保持仰卧位,用热塑性塑料膜固定骨盆。以头尾方向行CT增强扫描,层厚5 mm。扫描图像上传至Oncentra 3.3放射治疗计划系统,根据ICRU83报告对靶区进行勾画:大体肿瘤靶区(gross tumor volume,GTV)、临床肿瘤靶区(clinical target volume,CTV)包括:GTV、阴道上部、宫旁组织、髂总、髂内外、闭孔和骶前组淋巴结引流区。计划靶区(planning target volume,PTV)需考虑摆位误差及膀胱、直肠充盈程度,为CTV外扩0.5~1.0 cm。危及器官包括膀胱、直肠、小肠以及股骨头等。运用Oncentra 3.3放射治疗计划系统设计逆向IMRT计划,外照射总处方剂量:肿瘤PTV 54.04 Gy,每次1.93 Gy,共28次;淋巴结PTV 59.92 Gy,每次2.14 Gy,共28次;每天照射1次,每周照射5次。危及器官剂量限定:膀胱 V40≤50%,直肠 V40≤45%,小肠 V40≤30%,股骨头 V40≤5%[3]。
调整靶区组患者在盆腔外照射15次后再重新进行CT扫描以定位,重新勾画靶区以及制订放射治疗计划,危及器官、CTV、GTV以及PTV的勾画标准与之前相同,靶区由同一名医师勾画,至少由两名副主任医师进行审核,两次计划进行叠加,放疗剂量和危及器官剂量限定与原计划一致。在外照射15次后,所有患者开始使用192Ir高剂量率后装机进行腔内后装放疗,处方剂量:A点剂量30~36 Gy,每次6 Gy,共5~6次,外照射期间每周1次,外照射结束后每周2次。
1.3 随访及观察指标
所有患者接受放疗时每周进行评估。放疗结束后1个月开始第1次随访,此后第1~2年每3个月随访1次,第3~5年每6个月随访1次。根据肿瘤放射治疗协作组(Radiation Therapy Oncology Group,RTOG)急性放射性损伤分级标准评价放射性直肠炎、放射性膀胱炎。主要观察终点为是否发生放射性肠炎、放射性膀胱炎及其严重程度分级,次要终点是3年、5年总生存率和放射区域复发(relapsed in radiation field,RFR)情况。
1.4 统计学分析
采用SPSS 23.0软件进行统计分析。计量资料以均数±标准差(±s)表示,组间比较采用t检验;计数资料以例数及率(%)表示,组间比较采用χ2检验;有序分类变量的比较采用非参数检验;采用Kaplan-Meier法绘制生存曲线,生存情况的比较采用Log-rank检验;影响因素分析采用Logistic逐步回归分析。以P<0.05为差异有统计学意义。
2 结果
2.1 生存时间的比较
273例患者随访20~85个月,中位随访时间55个月,无治疗相关死亡。非调整靶区组和调整靶区组患者的3年、5年总生存率比较,差异均无统计学意义(P>0.05)。(图1)
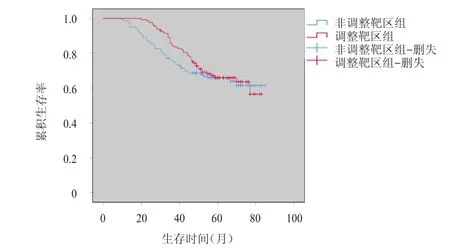
图1 调整靶区组(n=129)和非调整靶区组(n=144)局部晚期宫颈癌患者的生存曲线
2.2 RFR及远处转移情况的比较
调整靶区组有11例(8.5%)患者在5年内发生RFR,其中原发部位复发8例(6.2%),腹主动脉旁淋巴结复发3例(2.3%)。非调整靶区组有9例(6.3%)患者在5年内发生RFR,其中原发部位复发6例(4.2%),腹主动脉旁淋巴结复发2例(1.4%),阴道复发1例(0.7%)。远处转移是主要的放疗失败模式,调整靶区组和非调整靶区组分别有39例(30.2%)和43例(29.9%)患者有远处转移,主要转移部位为腹膜后、锁骨上、纵隔、肺、肝、骨。与非调整靶区组相比,调整靶区组在减少转移风险方面有更好的表现,但差异无统计学意义(OR=1.02,95%CI:0.61~1.71,P=0.947)。
2.3 放疗不良反应
放疗的不良反应主要为放射性直肠炎和放射性膀胱炎。调整靶区组发生放射性直肠炎:1级10例,2级6例,3级1例,4级0例;非调整靶区组发生放射性直肠炎:1级17例,2级7例,3级6例,4级3例。调整靶区组发生放射性膀胱炎:1级0例,2级2例,3级0例,4级0例;非调整靶区组发生放射性膀胱炎:1级1例,2级4例,3级2例,4级0例。
2.4 放疗不良反应影响因素的单因素及多因素分析
单因素分析显示,调整靶区可能是发生≥1级和≥3级放射性直肠炎的影响因素(P<0.05),临床分期是发生≥1级放射性直肠炎的影响因素(P<0.05)(表2)。以调整靶区和临床分期为自变量,≥1级和≥3级放射性直肠炎为因变量,进行多因素分析,结果显示,调整靶区为≥1级和≥3级放射性直肠炎的独立影响因素(OR=0.495、0.106,95%CI:0.256~0.960、0.014~0.853,P<0.05)。
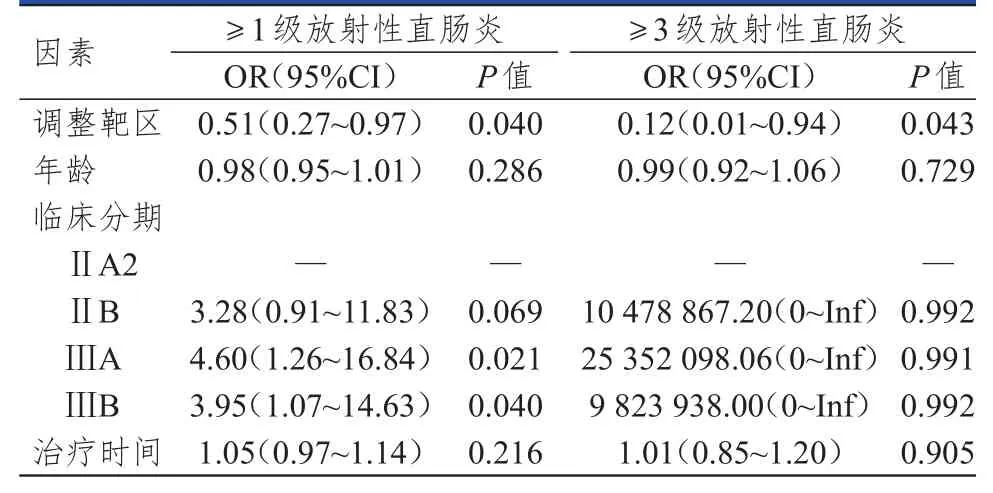
表2 局部晚期宫颈癌患者发生≥1级放射性直肠炎及≥3级放射性直肠炎影响因素的单因素分析
3 讨论
在本研究中,研究了宫颈癌途中调整放疗靶区范围的可行性,与不调整靶区相比是否有优势。结果表明,对于局部晚期宫颈癌患者,途中调整放疗靶区范围,不会对总生存率产生负面影响以及降低疗效,但降低了放射性直肠炎和放射性膀胱炎的发生率,显著降低了≥1和≥3级放射性直肠炎发生率。
调整靶区组和非调整靶区组患者放射性膀胱炎的发生率均不高,且无明显差异。主要原因:①直肠和膀胱受到射线照射主要由器官的运动和治疗引起的肿瘤缩退两方面引起。日常的器官运动对放射损伤也是非常重要的因素[4]。Heijkoop等[5]报道,直肠和膀胱填充物的每日变化会对子宫颈和子宫的形状和位置产生很大影响,偶尔会导致靶区离开PTV。Jadon等[6]发现,治疗期间直肠体积没有系统性变化,每天的体积变化范围为21~150 cm3,范围很大,而膀胱充盈时每日体积变化相对较小。为了尽量减少这些变化的影响,建议患者在膀胱适当充盈和直肠清空的情况下接受IMRT治疗,以减少它们的活动范围,但实际工作中,直肠排空较难操作,而在膀胱充盈方面更易操作,重复性好。本研究中,大多数患者能配合这一建议,在不能行图像引导放疗(image-guided radiotherapy,IGRT)的基层医院,这项工作虽然较繁重,但仍可通过宣教及指导使患者尽量配合。故膀胱每日照射重复性较好,两组患者发生放射性膀胱炎受膀胱运动影响相似,故放射性损伤差别不大。②相对于以往使用的常规放疗、适形放疗,现在普遍应用的IMRT技术在对膀胱的整体保护上已具有明显优势。乔文娟等[7]的研究报道,IMRT治疗宫颈癌过程中≥2级急性泌尿系不良反应发生率为14.1%~23.8%,迟发性泌尿系不良反应发生率更是低至0.7%~9.0%。③相对于直肠,膀胱的受照剂量要求相对宽松,膀胱V30是≥3级慢性泌尿系不良反应的有效预测指标。庞皓文等[8]也提出,V45是预测放射性膀胱炎的有效指标。而宫颈癌外照射剂量一般为45~56 Gy。宫颈癌放疗期间膀胱体积较小时位置变化会引起V45增加,而膀胱充盈状态时,不会引起V45增加,证明了在膀胱处于适当充盈状态时,IGRT在减少膀胱损伤中的作用有限,对于直肠的获益更大。刘青等[9]的研究结果表明,IGRT治疗可以减少直肠和膀胱的受照剂量及体积,但是直肠从IGRT中获益更大,所以,现有的IMRT和IGRT技术,宫颈癌放疗有关膀胱损伤较直肠损伤少。这与本研究所观察到的情况基本一致。
IGRT技术是将时间因素纳入三维适形放疗中,考虑了靶区和周围正常器官在治疗过程中的运动和放疗分次间的摆位误差,在患者治疗前、治疗中利用锥形束CT对肿瘤和危及器官进行实时监控,并能根据其位置和形状变化调整治疗靶区,使肿瘤包含在治疗计划系统所设计的剂量范围内[10-11],可明显减少直肠和膀胱的受照剂量及体积,减轻放疗不良反应[12]。近年来的一些研究显示了IGRT的优势,刘艳等[13]回顾性分析了80例局部晚期宫颈癌患者的病历资料,行常规放疗后放射性直肠炎发生率为75.0%,而IGRT治疗后放射性直肠炎发生率为42.5%,降低近一半,肿瘤缓解率分别为70%(28/40)、90%(36/40),2年生存率分别为45.0%、87.5%,其结论认为IGRT组疗效优于常规放疗组,放疗不良反应减轻。Wang等[14]回顾性分析了1433例接受IGRT治疗的ⅠB1~ⅣA期宫颈癌患者的病历资料,3年总生存率、无病生存率和局部控制率分别为83.0%、75.0%和87.4%,≥3级结直肠和泌尿生殖系统不良反应发生率分别为2.3%和1.3%。与未使用IGRT的既往研究相比,患者的生存率更高,不良反应发生率更低。该研究虽然纳入了大量患者,但是也存在一定的局限性。首先,这是一项单臂回顾性研究,因此,无法证明IGRT直接提高生存率和降低不良反应发生率。其次,由于每次放疗前使用千伏级的锥形束CT,使得患者额外受到的辐射增大,且治疗耗时长和费用高昂等多方面因素限制,绝大多数患者难以实现全程IGRT治疗。而且结合中国医疗机构和放疗设备参差不齐的医疗现状,IGRT在基层医院未能广泛推广和应用[15]。
现在IMRT已基本取代普通放疗,在中国广泛应用。但即使是IMRT技术,放疗过程中由于肿瘤不断发生不规则皱缩和变形移动,导致照射野内射线剂量不标准分布,也会影响IMRT的效果[16]。此外,由于肿瘤的缩退导致照射靶区相对增加,部分危及器官进入高剂量照射范围,使放射损伤大大增加[17]。本研究正是基于以往关于肿瘤缩退规律的研究结果:肿瘤缩退46%的平均外照射剂量为30 Gy左右[18],是短时间内肿瘤体积缩退最大的时段。Lee等[19]也报道了宫颈癌患者的照射剂量达到30 Gy后,GTV平均减少50%的研究结果。刘青等[9]的研究中,利用基于螺旋断层放射治疗机(helical tomotherapy,HT)自带的兆伏级MVCT图像引导系统,观察宫颈癌患者外照射过程中危及器官及分次照射间剂量变化规律,对比有无IGRT模式下分次间及全程IGRT治疗中直肠和膀胱照射剂量和体积的差异,目的为找到调整放疗计划和选择性进行IGRT的合适时间及次数,其结论认为,在难以实现全程图像引导的情况下,建议最好选择在治疗一半左右(13次左右),肿瘤缩退最明显时段,进行选择性图像引导,也可以达到有效减少直肠和膀胱损伤的效果,与本研究途中调整IMRT计划方法相似。因此,本研究策略为盆腔外照射15次,在肿瘤缩退最明显的时段,重新勾画靶区,调整IMRT计划,适当改变靶区,确保放疗有效性的前提下减少正常组织受照射的影响,降低膀胱与直肠等器官的损伤程度[9,20]。这种策略经济、有效、易于实施。此外,在本研究中观察到的疗效和不良反应发生率与Tan等[21]报道的研究中观察到的结果相差不大。
目前国内外对于放疗过程中调整IMRT放疗计划的研究,仅有少量临床样本,或者只停留在制作两套物理计划,侧重于物理参数层面比较[22-23]。本研究纳入的患者数量较多,数据结果对临床有参考意义,但也存在一定的局限性。首先,这是一项回顾性研究,因此,证实调整放疗靶区范围直接降低了局部晚期宫颈癌患者放射性直肠炎和膀胱炎发生率的证据不够充分。其次,本研究没有比较不同的调整计划方案,如放疗时仅进行1次计划调整或者2次、3次计划调整,对比它们之间的结果有无差别,更进一步优化调整策略。最后,有研究报道,初始治疗时,肿瘤最大径≥6 cm或最大径≥5 cm且肿瘤呈偏心性生长的患者,放疗期间肿瘤缩退引起周围器官随之位移幅度更大[24],后续工作中,应当再纳入部分此类患者,进一步分层分析,明确此类患者是否更能从调整放疗靶区范围中获益。
对于局部晚期宫颈癌患者,IMRT途中调整1次放疗靶区范围是一种有效和安全的放疗策略,可以有效减少放射性直肠炎和放射性膀胱炎,而不降低患者的疗效。
