不同日龄鸭肌肉组织多胺代谢和肌肉发育相关基因表达的规律
2022-09-14周雪敏康丽鹃郭永妮杨笑含蒋易龙王泽龙孙倩康波
周雪敏 康丽鹃 郭永妮 杨笑含 蒋易龙 王泽龙 孙倩 康波
(四川农业大学动物科技学院,成都 611130)
多胺主要包括腐胺、亚精胺和精胺[1],三者在鸟氨酸脱羧酶(ornithine decarboxylase,ODC)、亚精胺合成酶(spermidine synthase,SPDS)、精胺合成酶(spermine synthase,SPMS)、亚精胺/精胺N1-乙酰转 移 酶(spermidine/spermine N 1 -acetyltransferase,SSAT)、乙酰多胺氧化酶(acetylpolyamine oxidase,APAO)、精胺氧化酶(spermine oxidase,SMO)等多胺合成代谢相关酶作用下,相互转换以维持多胺池的稳态[2]。多胺具有调控动物生长发育、繁殖和衰老等多种生物学功能[3-4]。近年来研究表明,多胺在细胞增殖过程中必不可少[5],可参与调控组织再生和发育过程。多胺能促进小鼠骨骼肌的修复、纤维化和组织重塑[6],调节肌源性分化[7],对肌肉组织再生[8]和发育具有重要调控作用;多胺代谢异常会导致肌肉发育不良、肌肉肥大和萎缩[9]。骨骼肌的生长发育状况是家禽产肉性能的重要影响因素[10],家禽出生后的骨骼肌增重迅速,其生长主要由肌纤维肥大和卫星细胞增殖融合引起[11],表现为肌纤维的增粗和增长。肌源性调节因子(myogenic regulatory factors,MRFs)主要包括肌源性因子5(myogenic factor 5,Myf5)、生肌决定因子1(myostatin1,MyoD1)和肌细胞生成素(myogenin,MyoG)等[12],它们调控了整个肌肉发育过程[13]。胰岛素样生长因子-1(insulin-like growth factor-1,IGF-1)是调节骨骼肌合成代谢和分解代谢的关键生长因子[14];肌肉生长抑制素(myostatin,MSTN)基因,是一种骨骼肌生长发育的负调控因子,其功能和表达量的变化也可能会造成肌肉重量的变化[15]。然而,这些调控肌肉发育的关键基因在鸭出生后的表达规律及其与多胺调控禽类肌细胞增殖分化、骨骼肌发育的研究尚不完全清楚。
因此,本研究检测不同日龄鸭肌肉组织多胺含量、多胺代谢和肌肉发育相关基因表达量的变化,探究肌肉组织多胺代谢和肌肉发育相关基因表达的规律及其相关性,为阐明多胺调控鸭肌肉发育作用机制的研究提供参考。
1 材料与方法
1.1 材料
四川农业大学水禽育种场提供同批孵化的农华麻鸭30只(雌雄各半),日粮营养水平和管理方式均一致。分别在出雏后的0、30、60、90和120日龄采集鸭胸肌和腿肌组织并迅速冻于液氮,而后存放至-80℃冰箱保存备用。本实验的动物使用已通过四川农业大学动物护理和使用委员会的伦理审查和批准。
1.2 方法
1.2.1 组织总RNA提取及反转录合成cDNA 使用Tirzol(TaKaRa,大连)法提取鸭胸肌和腿肌总RNA,1.2%琼脂糖凝胶电泳检测RNA质量。按照RT-PCR反转录试剂盒(TaKaRa,大连)说明书,将总RNA反转录合成cDNA。
1.2.2 肌肉发育、多胺代谢相关基因的RT-qPCR检测分析 应用GenBank下载目的基因序列,使用Primer Premire 5.0软件设计引物后利用Oligo 12对设计的引物评价,整理后送到擎科生物科技有限公司进行合成,引物信息如表1。以不同日龄的鸭胸肌和腿肌cDNA为模板,采用PCR反应体系(10 μL):0.5 μL的cDNA模板,上下游引物各0.2 μL,SYBR Green 5.0 μL,去RNase水4.1 μL。反应条件:95℃,30 s;95℃,5 s;退 火,30 s;95℃,15 s;60℃,30 s。

表1 实验所用引物序列Table 1 Primer sequences used in the study
1.2.3 高效液相色谱检测多胺含量 取0.1g鸭肌肉组织浸泡于0.5 mL的5%高氯酸,加入10 μL的1,6-己二胺研磨充分,取上清;上清液中加入2 mL 2.5% NaOH和4 μL的苯甲酰氯,漩涡振荡均匀,置于40℃水浴锅衍生30 min,将pH调至7.0;用15 mL超纯水和15 mL 15%甲醇润洗C18固相萃取柱,再用萃取柱过滤衍生液,接着用0.5 mL甲醇洗脱样品;0.22 μm针头过滤器过滤洗脱液后4℃避光保存。以流速0.5 mL/min,紫外检测器检测波长229 nm;柱温25℃,流动相组成水∶甲醇=38∶62(V∶V)作为高效液相色谱检测条件。
1.2.4 数据处理及统计分析 利用2-∆∆Ct法,以GAPDH作为内参基因,计算不同日龄组鸭肌肉组织中目的基因的相对表达量,运用SAS 9.0统计软件ANOVA过程进行方差分析和Duncan多重比较,数值以平均值±标准差表示,P<0.05表示差异显著。使用Origin 软件对不同日龄鸭肌肉组织多胺代谢和肌肉发育相关基因表达量进行Pearson Correlation相关性分析和绘图。数值以平均值±标准差表示,P<0.05表示差异显著,P<0.01表示差异极显著。
2 结果
2.1 不同日龄鸭肌肉组织多胺含量的变化规律
如图1和图2所示,0日龄鸭胸肌组织多胺含量最高(P<0.05),30日龄时显著下降(P<0.05),60 日龄鸭胸肌组织腐胺和亚精胺含量继续下降,之后无显著变化,而鸭胸肌精胺含量则自此开始无显著变化(P>0.05)。如图2所示,0日龄鸭腿肌组织多胺含量最高(P<0.05),30日龄时下降,之后随日龄增加,无显著变化(P>0.05)。

图1 不同日龄鸭胸肌组织多胺含量的变化规律Fig. 1 Changes of polyamine contents of different aged duck pectoralis

图2 不同日龄鸭腿肌组织多胺含量的变化规律Fig. 2 Changes of polyamine contents in different aged duck leg muscles
2.2 不同日龄鸭肌肉组织多胺代谢相关基因表达量的变化规律
如图3、图4所示,胸肌ODC和SPMS基因表达量在0日龄时最高(P<0.05),而后下降,到60日龄时表达量最低(P<0.05),随后ODC和SPMS基因表达量上升,90日龄的表达量显著高于60日龄(P<0.05),而与120日龄时的表达量无显著差异(P>0.05);SPDS和APAO基因表达量随着日龄增加先下降后上升,SPDS基因表达量在0日龄时最高,30日龄和60日龄时下降,但30日龄和60日龄的表达量无显著差异(P>0.05),随后SPDS表达量逐渐上升,120日龄的表达量显著高于90日龄,而显著低于0日龄时的表达量(P<0.05),APAO基因0日龄的表达量仅次于120日龄时达到的最大表达量(P<0.05),30、60和90 日龄表达量的变化趋势与SPDS的表达规律一致;SSAT和SMO基因表达量在0日龄时最高而后下降,SSAT下降到60日龄后保持不变(P>0.05),SMO下降至30日龄后保持不变(P>0.05)。如图4所示,腿肌中多胺合成基因都具有先升高后降低再升高的规律,但存在一定时间差异,ODC第一次升高在30日龄(P<0.05),而后下降,最后在120日龄时达到最高(P<0.05),SPDS和SPMS第一次升高在60日龄(P<0.05),最后在120日龄时达到最高(P<0.05);多胺代谢相关基因SSAT和SMO表达量都呈先下降后不变最后再升高的规律,SSAT基因表达量0日龄时最高(P<0.05),30日龄时显著降低,但与60日龄和90日龄时表达量无显著差异(P>0.05),随后上升至与0日龄时无显著差异(P>0.05),APAO基因表达量0日龄时最高(P<0.05),30日龄时下降,从60 日龄开始随日龄增加,逐渐上升并在120日龄时上升至与0日龄时无显著差异(P>0.05)。

图3 不同日龄鸭胸肌中多胺代谢相关基因表达量变化Fig. 3 Expression changes of of polyamine metabolism related gene in different aged duck pectoralis

图4 不同日龄鸭腿肌中多胺代谢相关基因表达量变化Fig. 4 Expression changes of polyamine metabolism related gene in different aged duck leg muscles
2.3 不同日龄鸭肌肉组织发育相关基因表达量的变化规律
以RT-qPCR方法对鸭胸肌和腿肌肌肉发育相关基因的表达进行检测分析,结果如图5、图6所示。胸肌中MyoD1和Myf5基因均在0日龄时表达最高(P<0.05),而后下降,到60日龄和90日龄时表达较低,而后相比于60日龄表达略有上升;MyoG和IGF-1基因在0日龄时表达较高,30日龄时达到最高(P<0.05),60日龄时表达降低,而后不发生显著变化;而MSTN基因表达量在30日龄时显著下降达到最低,60日龄时逐渐上升,到90日龄时最高而后又下降。腿肌中,MyoD1基因表达在90日龄和120日龄时升高;Myf5基因在30日龄和60日龄时下降,90日龄和120日龄时略有升高;MyoG基因表达量在30日龄时升高而后趋于不变;MSTN基因在90日龄时升高,120日龄时达到最高。
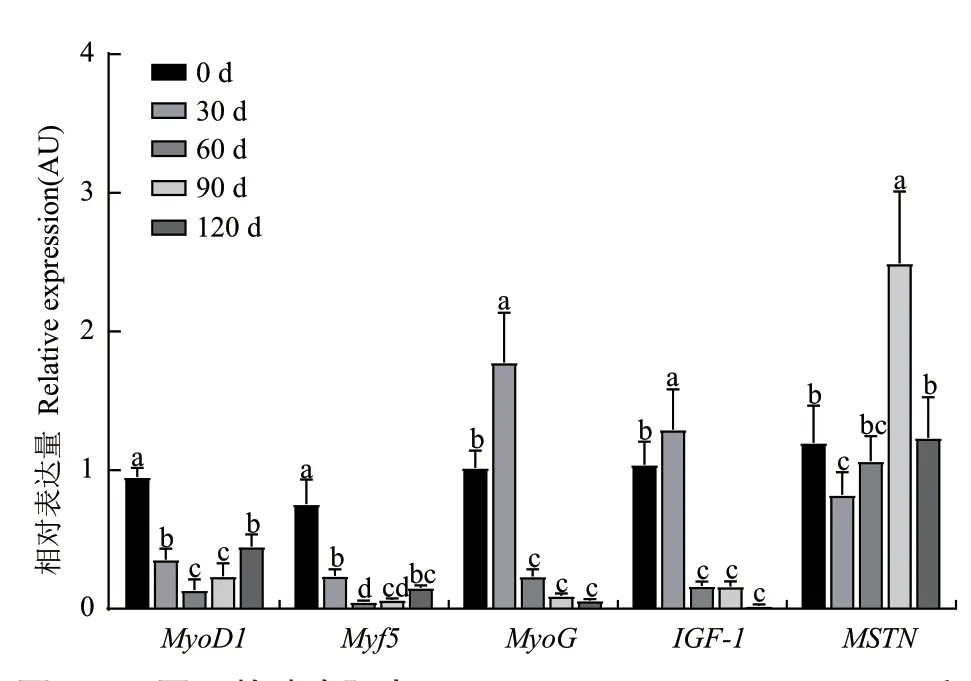
图5 不同日龄鸭胸肌中MyoD1、Myf5、MyoG、IGF-1和MSTN基因表达量变化Fig. 5 Changes of MyoD1,Myf5,MyoG,IGF-1 and MSTN gene expressions in different aged duck pectorales

图6 不同日龄鸭腿肌中MyoD1、Myf5、MyoG和MSTN基因表达量变化Fig. 6 Expression changes of MyoD1,Myf5,MyoG and MSTN gene in different aged duck leg muscles
2.4 不同日龄鸭肌肉发育相关基因与多胺代谢基因表达量的相关性分析
对不同日龄鸭肌肉发育相关基因和多胺代谢基因表达量进行两两相关性分析,由表2和表3可知,列入r2值大于等于50%的两两配对。相关性分析表明,鸭胸肌中MyoD1基因与SPMS、SPDS、SSAT、SMO基因的相关系数分别0.733 24、0.846 36、0.810 69和0.827 96,且 差 异 极 显 著(P<0.01);Myf5基因与SPMS、SPDS、SSAT、SMO基因的相关系数分别为0.946 4、0.827 96、0.945 63和0.916 11,且差异极显著(P<0.01)。鸭腿肌中ODC基因与MyoD1、MSNT基因的相关系数分别达到0.746 32和0.919 39,且差异极显著(P<0.01)。

表2 胸肌中肌肉发育相关基因与多胺代谢基因表达量的相关系数Table 2 Correlation coefficient between expressions of polyamine metabolism and muscle development genes in breast muscle
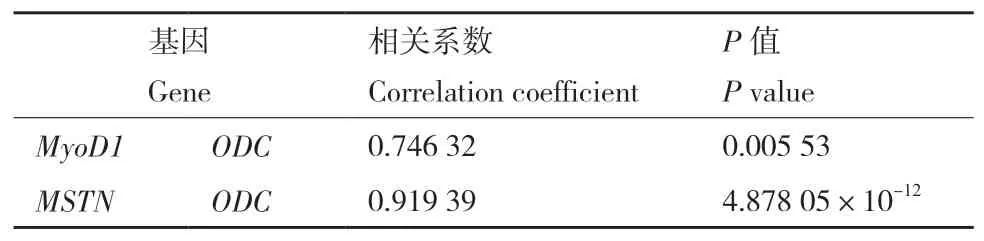
表3 腿肌中肌肉发育相关基因与多胺代谢基因表达量的相关系数Table 3 Correlation coefficient between expressions of polyamine metabolism and muscle development genes in leg muscle
3 讨论
3.1 鸭胸肌和腿肌组织多胺含量的变化
近年来研究表明,多胺可参与调控组织再生和发育过程。多胺能够促进细胞增殖,对细胞生长必不可少[16],在生长迅速的组织中其含量明显高于其他组织[5]。多胺可促进骨骼肌成肌细胞分化,增强小鼠坐骨神经切断后的代偿性肌肉肥大[7]。多胺及其前体处理可提高牛骨骼肌卫星细胞的增殖率和增殖相关基因的表达[17],以及牛卫星细胞分化相关基因丰度[18]。多胺可以改善因年龄、氧化应激造成的肌肉萎缩和肌肉营养不良[19]。作为多胺的一种,亚精胺能诱导骨骼肌卫星细胞自噬从而促进细胞增殖[20]。研究发现,鸭胸肌和腿肌生长发育存在一定的性别和品种的差异,高邮鸭和金定鸭的胸肌重拐点日龄为52日龄,腿肌重拐点日龄为16 日龄[21];北京鸭两个品系的胸肌重拐点日龄在36-41日龄,腿肌重拐点日龄在20-23 日龄[22];乌嘴白羽优质肉鸭胸肌重和腿肌重的拐点日龄,公鸭为50.4日龄、27.3日龄,母鸭为46.2日龄、25.2 日龄[23],这些结果提示雏鸭胸肌、腿肌的快速生长期分别在60日龄和30 日龄以前。我们的结果发现,0日龄和30日龄鸭胸肌组织中以及0日龄鸭腿肌组织中多胺含量较高,提示在鸭胸肌和腿肌快速生长时期,多胺可能促进肌肉细胞增殖和分化,进而参与调控肌肉组织的生长发育。然而,出生后的鸭肌肉发育主要是肌肉卫星细胞的增殖、再生和肥大,30 日龄相比于0日龄的胸肌增重是增加的,多胺含量是下降的,由于我们缺乏对鸭胸肌和腿肌重的拐点日龄及其前后日龄的多胺含量检测,所以胸肌和腿肌增重与多胺含量变化是否存在相关性还有待进一步研究。
3.2 鸭胸肌和腿肌多胺代谢相关基因表达量的变化
多胺合成代谢基因ODC、SPDS、SPMS及多胺分解代谢相关基因SSAT、APAO、SMO调控腐胺、精胺和亚精胺三者相互转化[24],进而调控多胺代谢在机体内保持动态稳定,这与细胞正常增殖和组织生长息息相关[25]。本研究发现,鸭胸肌中的多胺代谢相关基因,除APAO外均在0日龄时表达最高,说明0日龄时多胺合成及分解代谢较为旺盛。ODC和SPMS基因表达模式相似,均在0日龄时最高,而后下降,到60日龄时表达最低,而后表达上升无显著变化;SPDS和APAO表达模式类似,表现为30日龄时下降,60日龄时保持不变,90日龄和120日龄逐渐上升;SSAT和SMO基因表达在0日龄时最高而后下降,SSAT下降到60日龄后保持不变,SMO下降至30日龄后保持不变,而鸭胸肌中多胺含量先下降后不变的规律,提示胸肌中多胺代谢相关基因呈一定规律性变化调节着多胺池的稳态。鸭腿肌中,ODC基因表达趋势表现为30日龄时升高,60日龄时下降,90日龄时不变,120日龄时又上升至最高;SPDS和SPMS基因表达规律一致,表现为60日龄时升高,90日龄时下降,120日龄时上升至最高;SSAT和SMO基因表达规律相似,表现为先下降后不变,再上升到120日龄时达到最高,而APAO基因表达量先不变再上升至120日龄时达到最高,提示腿肌多胺代谢相关基因呈一定规律表达并调控多胺池的稳定。同时,我们发现胸肌和腿肌多胺代谢相关基因表达有着不同的规律,这可能由于胸腿和腿肌起源、发育速度以及快肌和慢肌分布不同[26]造成的组织差异性。
3.3 鸭胸肌和腿肌多胺代谢基因与肌肉发育相关基因表达量的相关性
出生后早期阶段,卫星细胞的增殖和融合可使肌核数量增加,有助于肌肉生长,而出生后期及成年后肌肉的肥大则不伴随肌核数量的改变和卫星细胞的增殖和融合[27]。MyoD1和Myf5在成肌细胞增殖、转化及肌纤维形成过程有重要作用[28],在成年后可通过其表达判断肌肉增殖和肥大[29]。MyoD1过度表达会抑制成肌细胞增殖并加快成肌纤维细胞的成熟[30]。本研究发现,鸭胸肌的MyoD1和Myf5基因表达量在0日龄时最高,30日龄时下降,60日龄时继续下降,与腐胺、亚精胺含量变化规律和多胺相关代谢基因(ODC、SPMS、SPDS、SSAT)表达规律一致,可能在早期参与卫星细胞增殖融合的肌肉生长过程;而后相比于60日龄和90日龄,120日龄时胸肌中MyoD1、SPDS和APAO基因显著升高,推测MyoD1、SPDS和APAO基因在生长发育后期参与肌肉的成熟和肥大;另外,相关性分析表明MyoD1和Myf5基因与鸭胸肌多胺代谢基因(SPMS、SPDS、SSAT、SMO)存在显著正相关,提示多胺代谢基因(SPMS、SPDS、SSAT、SMO)与MyoD1和Myf5基因共同参与鸭胸肌的发育。MyoG同样是MRFs成员,作为骨骼肌发育的正调控因子,促进肌细胞增殖形成肌纤维[17],主要影响产肉性能[31]。IGF-1可促进骨骼肌干细胞的增殖、肌细胞的分化以及融合成肌管[32],也与肌肉质量增加密切相关,是唯一能在肌肉再生和肥大中起关键作用的生长因子[33]。胸肌中,MyoG和IGF-1基因在30日龄时达到最高,提示30日龄时是胸肌发育的重要时期。MSTN作为肌肉生长发育的抑制剂,胸肌中MSTN在90日龄时达到最高,提示90日龄时胸肌发育受到了负向调控。然而,腿肌MyoD1的基因表达与MSTN的表达相似,在90日龄和120日龄时突然升高,且MSTN在120日龄时达到最高,此时ODC、SPDS、SPMS和APAO基因表达量达到最高,推测在120日龄时腿肌中多胺代谢较为旺盛,可能与MyoD1和MSTN基因共同调控鸭腿肌的生长。此外,相关性分析发现,多胺合成限速酶基因ODC与MyoD1和MSTN基因表达具有相关性,提示ODC可能与MyoD1和MSTN基因共同参与鸭腿肌的发育。
4 结论
鸭胸肌和腿肌的多胺含量在0日龄和30日龄时较高,胸肌和腿肌中多胺代谢基因呈一定规律变化,且鸭胸肌中多胺代谢基因(SPMS、SPDS、SSAT、SMO)与肌肉发育相关基因(MyoD1和Myf5)的表达存在正相关,腿肌中多胺代谢基因ODC与MyoD1和MSTN基因表达正相关,提示这些多胺代谢基因与肌肉发育相关基因可能共同调控鸭胸肌和腿肌的生长。