大黄鱼TRAF6的克隆及表达分析
2022-09-14陈英王艺磊邹鹏飞
陈英 王艺磊 邹鹏飞
(集美大学水产学院 农业农村部东海海水健康养殖重点实验室,厦门 361021)
肿瘤坏死因子受体相关因子(tumor necrosis factor receptor associated factors,TRAFs)是Toll样受体(toll-like receptors,TLRs)、NOD样受体(NODlike receptors,NLRs)、RIG-I样 受 体(RIG-I like receptors,RLRs)介导信号通路的重要接头蛋白,在宿主的固有免疫和适应性免疫应答中具有重要作用[1-5]。TRAFs可以介导核因子-κB(nuclear factor κB,NF-κB)、丝裂原活化蛋白激酶(mitogen-activated protein kinase,MAPK)和干扰素调节因子(interferon regulatory factor,IRF)的激活,调控宿主的免疫应答与炎症反应[1,3]。
目前在哺乳动物中发现了7个TRAF(TRAF1-7)成员,其共同特征是都有高度保守的C-末端TRAF结 构 域(除 了TRAF7在C-末 端 包 含7个WD40)[6]。TRAF结构域分为TRAF-N(coiled-coil domain)和TRAF-C(beta-sandwich domain,MATH domain),主要参与蛋白质之间的相互作用[7]。TRAFs(TRAF1除外)含有一个额外的N端结构域,由一个环指结构域(RING finger domain)和若干个锌指结构域(zinc fingers domain)组成[1]。TRAF2、TRAF3、TRAF5和TRAF6的环指结构域具有E3泛素连接酶活性,可通过K63关联的多聚泛素化介导蛋白质泛素化,激活下游信号通路[8-12]。
TRAF6蛋白作为TRAF家族的重要成员,参与肿瘤坏死因子受体超家族信号转导过程,也在IL-1/TLR 家族信号转导过程发挥重要作用,因而获得广泛关注[13-16]。哺乳动物中的相关研究表明,一些TLR家族成员(如TLR3/4)可通过与β干扰素TIR结构域接头蛋白(Toll/interleukin-1 receptor(TIR)domain containing adaptor inducing interferon-β,TRIF)相互作用,招募并激活TRAF3和TRAF6[17]。TLR家族其他成员(TLR1/2/4/5/6/7/8/9)和白介素-1受体(interleukin-1 receptor,IL-1R)超家族成员(IL-1/18/33R)可通过招募接头蛋白髓样分化因子88(myeloid differentiation factor 88,MyD88),激活IL-1受体相关激酶1或4(interleukin-1 receptor associated kinase-1/4,IRAK1/4),从而激活TRAF6[18-20]。同时,TRAF6还可以通过TLR7/8/9-MyD88途径激活下游IRF7[21-22]。
近年来,TRAF6的同源基因在硬骨鱼类中被克隆和鉴定,包括青鱼(Mylophyngodon piceus)[23]、花 鲈(Lateolabrax maculatus)[24]、草 鱼(Ctenopharyngodon idellus)[25]、 鲫(Carassius auratus)[26]、虹鳟(Oncorhynchus mykiss)[27]等。其中对青鱼相关研究发现TRAF6(bcTRAF6)在RIG-I/MAVS信号转导中起正调控作用[23];花鲈TRAF6可以抑制哈氏杆菌(Vibrio harveyi)和无乳链球菌(Streptococcus agalactiae)诱导的细胞凋亡[24];草鱼TRAF6可与IRF5相互作用,激活IRF5并诱导IFN1表达上调[25];鲫TRAF6的mRNA表达水平在聚肌苷酸胞苷酸(Poly I:C)、鞭毛蛋白(flagellin)和嗜水气单胞菌(Aeromonas hydrophila)刺激下显著上调[26];而虹鳟TRAF6的基因沉默显著抑制了LPS诱导的MAPKs和NF-κB相关信号通路的激活[27]。上述研究结果共同说明硬骨鱼类TRAF6在响应病原入侵、激活免疫相关信号通路、启动机体免疫应答等过程中的重要作用。
大黄鱼(Larimichthys crocea)属硬骨鱼纲鲈形目石首鱼科黄鱼属,是我国东部和南部沿海地区重要的海水养殖经济鱼类[28]。近年来,随着网箱养殖密度和养殖规模的不断扩大,养殖条件恶化,经常面临着刺激隐核虫病、弧菌病、假单胞菌病、黏孢子虫病、虹彩病毒病等疾病的侵袭[29-32]。然而,目前有关大黄鱼的病原识别及免疫激活的相关基础研究依然较匮乏,有必要开展大黄鱼基础免疫学的相关研究。因此,本研究以大黄鱼为实验对象,克隆了大黄鱼TRAF6基因,利用GFP荧光示踪质粒揭示了其亚细胞定位,同时通过荧光定量PCR检测了TRAF6在健康大黄鱼各组织以及在不同病原相关分子模式(pathogen-associated molecular patterns,PAMPs)刺激下的表达水平,初步解析了TRAF6在抗感染免疫中的作用。研究结果将为深入解析TRAF6在宿主固有免疫应答中的功能及其介导细胞信号转导通路的分子机制提供参考。
1 材料与方法
1.1 材料
选取健康大黄鱼(体长18 cm±1.5 cm,体重60 g±15 g,8月龄),购自福建宁德富发水产有限公司。实验前,大黄鱼在25℃的循环海水系统中暂养两周。
实验所用人胚肾细胞系(HEK 293T)购自中国典型培养物保藏中心(武汉大学保藏中心),使用含10%胎牛血清(Invitrogen-Gibco)、100 U/mL青霉素(P)和链霉素(S)的Dulbecco改良Eagle培养基(DMEM),培养于37℃、5% CO2的细胞培养箱中。
1.2 方法
1.2.1 生物信息学分析 利用BLAST(http://www.ncbi.nlm.nih.gov/BLAST/)对核苷酸和蛋白质序列进行分析;通过ORF finder(https://www.ncbi.nlm.nih.gov/orffinder/)预测基因的开放阅读框(Open Reading Frame,ORF);利用在线软件(http://www.bio-soft.net/sms/index.HTML)推算蛋白质分子量;利用NCBI基因组数据库(https://www.ncbi.nlm.nih.gov/genome/)检索脊椎动物TRAF6的基因序列,进一步使用Splign(https://www.ncbi.nlm.nih.gov/sutils/splign/splign.cgi)对基因结构进行分析。
1.2.2 体内免疫刺激 为研究TRAF6在健康大黄鱼体内的组织分布情况,将6条健康大黄鱼用0.01%丁香酚麻醉后,取鳃、肝、脾、头肾、体肾、肠、心、脑、皮肤和肌肉,将其分别保存于RNAlater中,同时取血液保存于Trizol中,用于后续总RNA的提取。为了研究大黄鱼TRAF6在不同免疫刺激下的表达特征,将鱼分成五组并分别腹腔注射变形假单胞菌(Pseudomonas plecoglossicida)悬浮液(5 × 105CFU/mL)、脂多糖(LPS)(L3024,Sigma,来自大肠杆菌 O111:B4,0.5 mg/mL)、肽聚糖(PGN)(69554,来自枯草芽孢杆菌,Sigma,1 mg/mL)、聚肌胞苷酸(Poly I:C,P9582,Sigma,1 mg/mL)和PBS溶液(对照组)各100 μL。注射6、12和24 h后每组随机选取6尾大黄鱼,分别采集鳃、头肾、脾、肠、血液组织以备后续总RNA的提取等实验。
1.2.3 总RNA提取和cDNA合成 使用Eastep®Super总RNA提 取 试 剂 盒(Promega)从 上 述 器官/组织样本中取绿豆粒大小组织块(20-40 mg)用于提取总RNA,其中,血液样品取300 μL使用TIANGEN®RNAsimple总RNA提取试剂盒(天根生化科技(北京)有限公司)提取总RNA。用琼脂糖凝胶电泳和OD260/280分析测定RNA的质量和浓度。每个样品取1 μg总RNA与不含RNase的DNase I(Thermo ScientificTM)反应,随后使用第一链cDNA合成试剂盒(RevertAid First Strand cDNA Synthesis Kit,#K1622,Thermo ScientificTM)将提取的RNA逆转录为cDNA并保存于-80℃冰箱中,用于目的基因克隆或实时荧光定量PCR分析。
1.2.4 实时荧光定量PCR 使用罗氏LightCycler®480实时荧光定量PCR仪,Go Taq®qPCR Master Mix试剂(Promega,Madison,美国),在384孔板上进行实时定量PCR实验。反应体系为10 μL:2 ×SYBR Green Master Mix 5 μL,正 向 引 物0.5 μL(4 μmol/L),反向引物0.5 μL(4 μmol/L),cDNA模板1 μL(100 ng/μL),无核酸酶水3 μL。PCR反应条件如下:95℃预变性5 min;95℃变性20 s,58℃退火20 s,72℃延伸15 s,在81℃进行读板,共40个循环;72℃延伸10 min,16℃反应5 min。将靶基因的相对表达量使用内参基因β-actin进行校正,并使用比较Ct方法(2-∆∆Ct)进行分析。采用t检验确定各处理组间的显著性差异水平,其中*表示差异显著P< 0.05,**表示差异极显著P< 0.01。引物序列见表1。
1.2.5 质粒构建 克隆大黄鱼TRAF6的ORF序列并构建至pMD19-T载体上测序鉴定,使用限制性内切酶将含有目的基因的pMD19-T质粒及真核表达质粒pTurboGFP-N进行酶切,并将大黄鱼TRAF6的ORF序列插入至pTurboGFP-N载体中,构建大黄鱼TRAF6的GFP荧光示踪质粒。上述质粒构建体均通过测序验证,所用引物序列见表1。
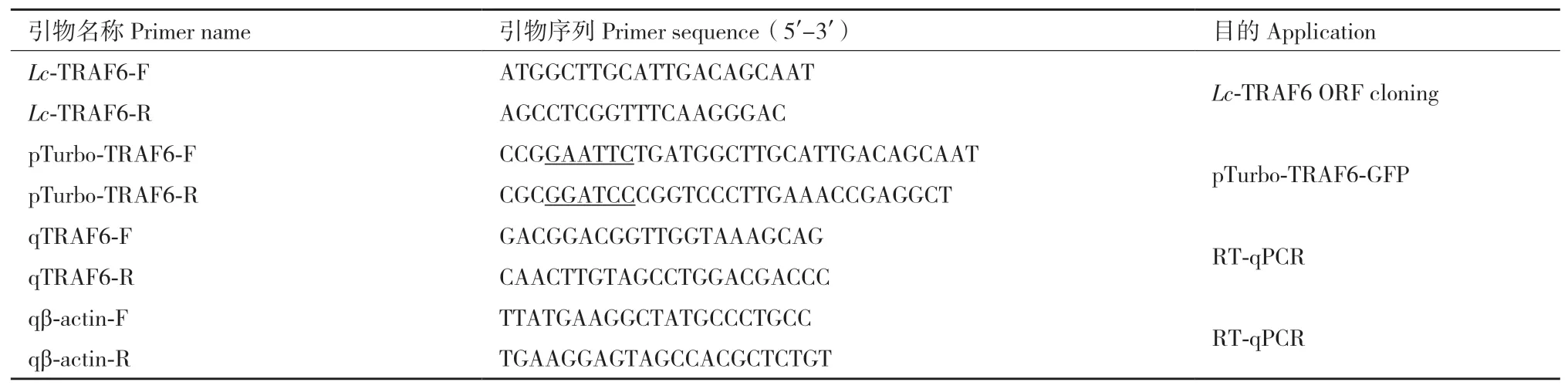
表1 本研究所用引物Table 1 Primers used in this study
1.2.6 亚细胞定位分析 将HEK 293T细胞(每孔2× 105个细胞)传代培养于6孔板中(已放入细胞爬片)过夜,使用Lipofectamine®3000 转染试剂将5 μg pTurbo-TRAF6-GFP和pTurboGFP-N(对照)质粒分别转染于HEK 293T细胞。转染约24 h后,细胞爬片用PBS洗涤并用4%多聚甲醛室温固定10 min,再加入TritonX-100透化处理10 min,继续用PBS洗涤一次后用4, 6-二氨基-2-苯基吲哚(DAPI)染色封片2 h。使用激光共聚焦显微镜(德国莱卡)观察细胞并拍照。
2 结果
2.1 大黄鱼TRAF6基因的克隆与序列分析
根据NCBI数据库中的序列信息(GenBank accession No. XM_019273436.2),利 用Primer 5设计特异性引物,以大黄鱼脾脏cDNA为模板克隆并获得大黄鱼TRAF6的ORF全长,命名为Lc-TRAF6(GenBank accession No. OL333599)。Lc-TRAF6ORF由1 725个核苷酸组成,编码574个氨基酸(aa)。蛋白保守结构域分析结果发现Lc-TRAF6由N端RING finger结构域(80-118 aa)、zinc fingers结构域(138-187 aa,214-271 aa),coiled-coil结构域(361-398 aa)和C端MATH-TRAF6结构域(405-530 aa)构成(图1)。

图1 大黄鱼TRAF6与其他脊椎动物TRAF6氨基酸序列比对Fig. 1 Multiple alignment of Lc-TRAF6 with TRAF6 in other vertebrates
将Lc-TRAF6与其他脊椎动物TRAF6氨基酸序列进行比较分析,结果显示,不同鱼类之间的TRAF6相似性较高,其中Lc-TRAF6的氨基酸序列与斜带石斑鱼(Epinephelus coioides)TRAF6的相似性为94%,与红鳍东方鲀(Takifugu rubripes)的相似性为87%,与虹鳟的相似性为78%,与草鱼的相似性为75%,与斑马鱼(Denio rerio)和斑点叉尾鮰(Ictalurus punetaus)的相似性为74%。而与鸟类和哺乳动物TRAF6相比,相似性水平有所下降,与 鸡(Gallus gallus)、人(Homo sapiens)和 小 鼠(Mus musculus)的相似性分别为66%、65%和64%(表2)。
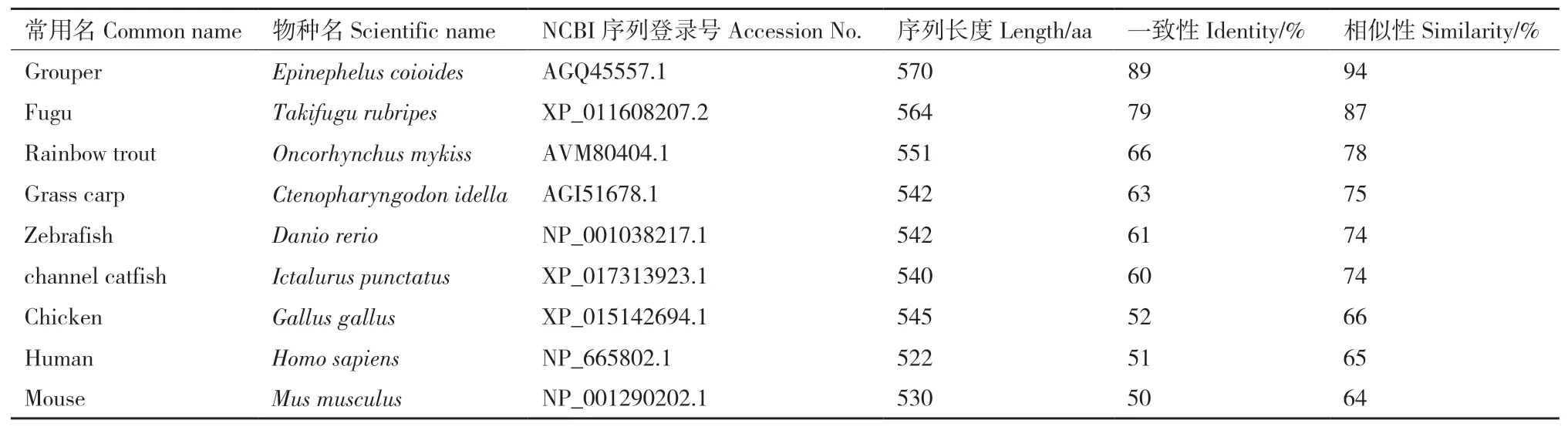
表2 Lc-TRAF6与其它脊椎动物TRAF6氨基酸序列相似性比较Table 2 Comparison of amino acid sequence similarity between Lc-TRAF6 and TRAF6 in other vertebrates
将Lc-TRAF6与红鳍东方鲀、斑马鱼、鸡、小鼠和人TRAF6的cDNA序列与其对应的基因序列进行比较,对其基因的外显子和内含子组成进行分析。结果发现,Lc-TRAF6基因序列由7个外显子和6个内含子组成,其外显子与内含子结构与红鳍东方鲀最为相似,而斑马鱼与鸟类和哺乳动物基因组结构更为相似,均包含6个外显子和5个内含子(图2)。在所检测的物种中,红鳍东方鲀TRAF6基因序列长度最短,为2 700 bp,小鼠最长,为14 395 bp;脊椎动物TRAF6基因在第2-5个外显子十分保守,其长度分别为151、159、72和78 bp,但内含子差异很大,其中最长的内含子有4 860 bp,而最短的内含子仅有71 bp(图2)。
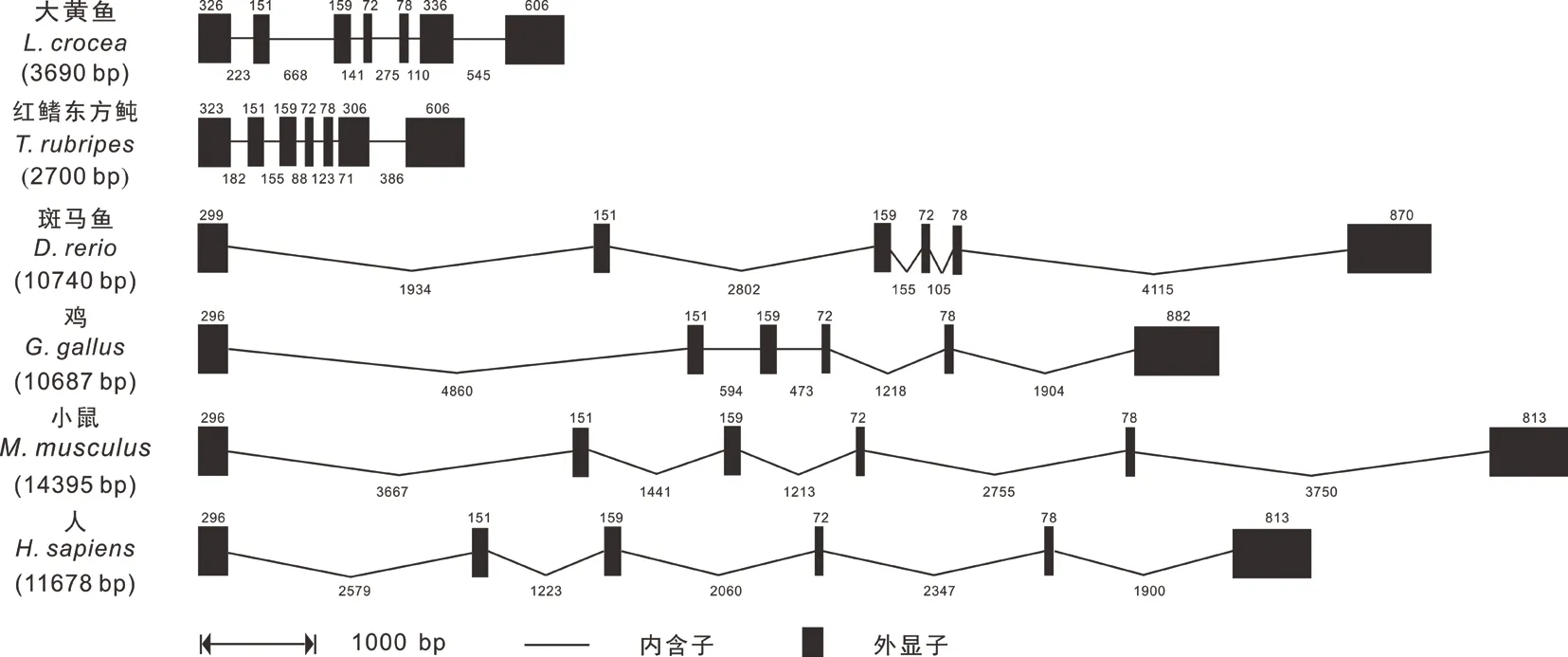
图2 Lc-TRAF6与其他脊椎动物TRAF6基因结构比较Fig.2 Genomic structure comparison of gene Lc-TRAF6 with TRAF6 in other vertebrates
2.2 大黄鱼TRAF6的亚细胞定位
为了解析Lc-TRAF6的亚细胞定位,将GFP荧光示踪质粒pTurbo-TRAF6-GFP和pTurboGFP-N分别转染HEK 293T细胞并用DAPI进行细胞核染色。激光共聚焦显微镜分析结果表明TRAF6-GFP融合蛋白主要分布在胞浆,且在靠近细胞核的部位呈现点状聚集现象,转染空质粒pTurboGFP-N的细胞其GFP荧光蛋白在全细胞中均有分布(图3)。
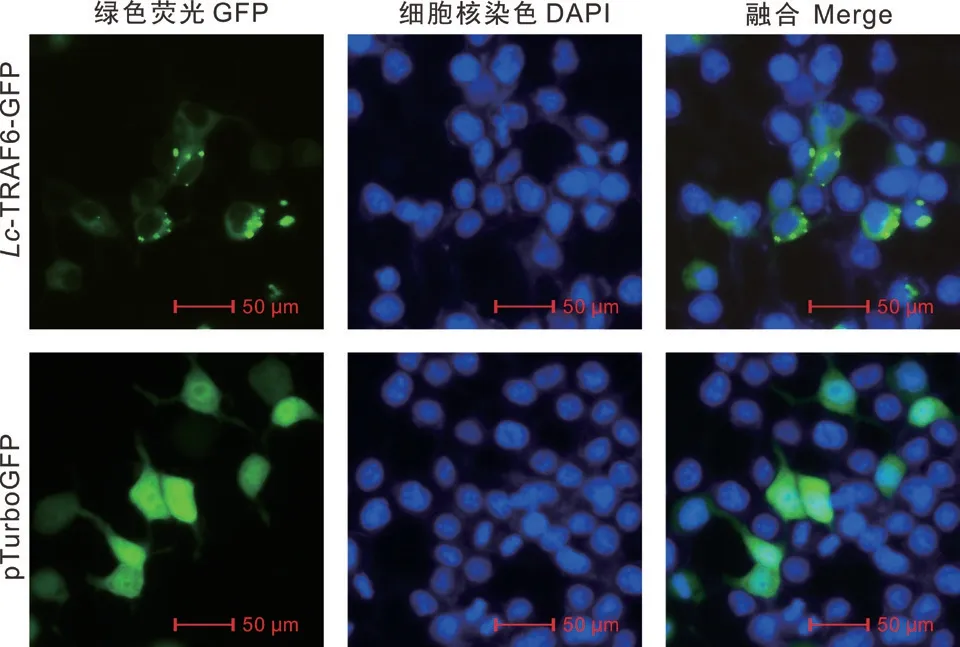
图3 Lc-TRAF6的亚细胞定位分析Fig.3 Subcellular localization analysis of Lc-TRAF6
2.3 大黄鱼TRAF6的表达分析
通过实时荧光定量PCR技术检测了Lc-TRAF6mRNA在健康大黄鱼11种器官/组织中的表达情况。结果表明Lc-TRAF6mRNA在所有检测器官/组织中普遍表达,但是在不同器官/组织中的Lc-TRAF6mRNA的表达水平存在差异,其中在血液中表达量最高,其次是鳃、肌肉、头肾、脾、心、肝、肠、体肾、皮肤,在脑中表达量最低(图4)。
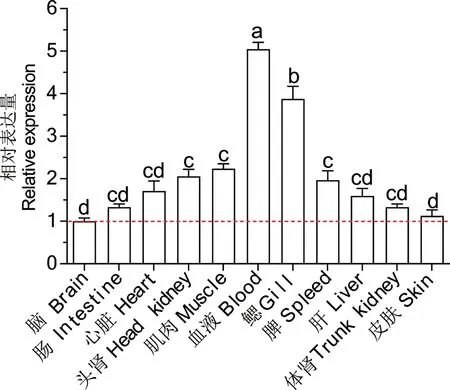
图4 Lc-TRAF6的组织表达分析Fig. 4 Tissue expression analysis of Lc-TRAF6
为了进一步解析Lc-TRAF6基因在宿主免疫反应中的作用,我们通过实时荧光定量PCR技术检测Lc-TRAF6在Poly I:C、LPS、PGN刺 激 下 和P.plecoglossicida感染后鳃、脾脏、头肾、血液和肠中的表达情况。结果表明,Lc-TRAF6在Poly I:C刺激下其表达水平显著上调:鳃在刺激6 h时Lc-TRAF6的表达水平相较于对照组上调了2.5倍(图5-A),脾在刺激12 h和24 h时Lc-TRAF6的表达水平相较于对照组分别上调了6.8倍和1.9倍(图5-B),头肾在6 h和12 h 时Lc-TRAF6的表达水平相较于对照组分别升高了2.8倍和3.2倍(图5-C),肠在刺激24 h时Lc-TRAF6的表达水平相较于对照组上调了2.8倍(图5-D),外周血中在刺激12 h时Lc-TRAF6的表达水平相较于对照组上调了3.0倍(图5-E)。LPS 刺激能显著诱导Lc-TRAF6的表达水平上调:鳃在LPS刺激6 h时Lc-TRAF6的表达水平为对照组的1.9倍(图5-A),脾在LPS刺激12 h时Lc-TRAF6的表达水平为对照组的4.0倍(图5-B),在LPS刺激24 h时头肾、肠和血表达水平较对照组分别高了1.9倍、2.2倍和2.0倍(图5-C-E)。在 PGN感染刺激下,Lc-TRAF6的表达水平也显著上调:鳃和肠在刺激6 h时Lc-TRAF6的表达水平较对照组分别上调了1.8倍和2.2倍(图5-A和5-D),头肾在刺激12 h和24 h时Lc-TRAF6的表达水平较对照组分别上调1.8倍和1.6倍(图5-C),脾和血在刺激12 h时Lc-TRAF6的表达水平较对照组分别上调3.9倍和4.2倍(图5-B和5-E)。同时,在P. plecoglosicida感染刺激下也能显著诱导大黄鱼 TRAF6 表达上调:鳃在刺激6 h时Lc-TRAF6表达水平是对照组的1.9倍(图5-A),脾在12 h时Lc-TRAF6表达量为对照组的6.5倍,头肾在24 h时Lc-TRAF6表达水平是对照组的1.8倍(图5-C),肠组织在刺激6、12、24 h时Lc-TRAF6表达水平分别是对照组的2.8倍、2.2倍和1.9倍(图5-D),外周血中刺激12 h 时Lc-TRAF6的表达量最高,为对照组的2.9倍(图5-E)。此外,在不同病原相关分子模式刺激6 h时鳃中Lc-TRAF6表达量均上调(图5-A);而脾脏和血液中Lc-TRAF6表达量峰值均出现在12 h时(图5-B和5-E)。

图5 Poly I:C、LPS、PGN和P. plecoglossicida刺激下Lc-TRAF6的表达分析Fig. 5 Expression analysis of Lc-TRAF6 under Poly I:C,LPS,PGN,and P. plecoglossicida stimulation
3 讨论
TRAF6是TLR信号通路中的关键信号转导分子,泛素化后的TRAF6激活TAK1,继而使IKK和MAPK磷酸化,分别激活NF-κB和AP-1[33]。哺乳动物TRAF6包含4个保守结构域,包括RING finger结构域、一系列zinc finger结构域、一个coiled-coil区域和一个MATH结构域。与哺乳动物TRAF6相似,Lc-TRAF6也包含经典结构域,包括一个RING finger结构域、两个zinc finger结构域、一个coiled-coil结构域和一个MATH结构域。
TRAF6基因结构分析表明,鱼类TRAF6基因由7个外显子和6个内含子组成,鱼类和哺乳动物TRAF6基因外显子的大小部分相似,同时斑马鱼和哺乳动物TRAF6基因只包括6个外显子和5个内含子,上述结果表明TRAF6基因可能在脊椎动物的演化中出现了差异。
大黄鱼TRAF6-GFP融合蛋白在HEK 293T细胞中主要分布于胞浆,且在靠近细胞核的部位呈现出点状聚集的现象。其他硬骨鱼类TRAF6的亚细胞定位结果显示,斜带石斑鱼TRAF6-GFP融合蛋白的绿色荧光主要分布在人宫颈癌细胞(HeLa)细胞质中,未见亮绿色斑点[12]。草鱼TRAF6-GFP位于草鱼肾细胞(Ctenopharyngodon idellakidney cell line,CIK)细胞质中,细胞核周围由亮绿色斑点包围[25]。花鲈TRAF6-GFP融合蛋白主要分布在HEK 293T细胞质中,细胞核周围也可见亮绿色斑点[24],与大黄鱼TRAF6-GFP分布情况极为相似,提示硬骨鱼类TRAF6可能具有结合囊泡或形成聚集体的机制[34]。
大黄鱼TRAF6在不同组织和器官中广泛表达,其中在血液中表达量最高,其次是鳃、脾、头肾等,在脑中表达最低。其他硬骨鱼类TRAF6表达分析结果显示,TRAF6分别在草鱼头肾[35]、鲫肌肉[26]、尼罗罗非鱼脾脏[36]、虹鳟和青鱼肝脏[27,37]表达量最高。上述结果表明硬骨鱼类TRAF6的组织表达特征可能因物种不同而存在一定的差异。
此外,大黄鱼TRAF6的表达水平在Poly I:C、LPS、PGN和P. plecoglossicida刺激下均显著上调,且在脾、头肾、肠、鳃和血液中的表达变化因免疫刺激和器官/组织的不同而存在差异。其他硬骨鱼类中的相关研究显示,花鲈TRAF6的表达水平在Poly I:C刺激和赤点石斑鱼神经坏死病毒(red-spotted grouper nervous necrosis virus,RGNNV)感 染 后 显著上调[38],鲫TRAF6在Poly I:C、嗜水气单胞菌(Aeromonas hydrophila)刺激后其表达水平显著上调[26],在小瓜虫(Ichthyophthirius multifiliis)感染后,草鱼TRAF6在皮肤、鳃、头肾和脾脏中的表达水平均显著上调[35]。上述结果表明硬骨鱼类TRAF6参与了宿主的免疫反应,特别是在宿主响应寄生虫、细菌和病毒等病原入侵的过程中具有重要作用。
值得注意的是,大黄鱼TRAF6在鳃和脾脏组织中响应不同PAMPs刺激的时间不尽相同。其中,鳃中TRAF6的表达水平在Poly I:C、LPS、PGN和P.plecoglossicida刺激6 h时其表达水平显著上调,表明鳃可能参与了病原体入侵的早期反应。鳃是鱼与外界密切接触的黏膜器官,鳃相关淋巴组织(gillassociated lymphiof tissues,GIALT)中富含免疫分子和免疫效应细胞,其中免疫分子包括抗菌肽、急性反应物质等,免疫效应细胞包括淋巴细胞、巨噬细胞、嗜酸性粒细胞、中性粒细胞和抗体分泌细胞等[39-40]。当机体被病原刺激后,鳃相关淋巴组织会启动免疫细胞及免疫分子参与免疫反应,诱导TRAF6等免疫相关信号分子的表达,激活免疫相关信号通路。而脾脏中TRAF6表达水平在不同PAMPs刺激12 h时达到峰值,且脾脏中TRAF6的表达上调幅度均大于鳃中,表明脾脏可能主要参与了病原体入侵的中期反应,这与鲤感染嗜水气单胞菌12 h时TRAF6基因的表达模式相似[41]。
4 结论
大黄鱼TRAF6基因ORF全长1 725 bp,编码一个含574 aa的蛋白,由RING finger结构域、两个zinc finger结构域、coiled-coil结构域和MATHTRAF6结构域组成。大黄鱼TRAF6主要分布在细胞质中,且在细胞核周围存在点状聚集。大黄鱼TRAF6广泛表达于健康大黄鱼中不同器官/组织中,在血液中表达水平最高,在脑中最低;在Poly I:C、LPS、PGN刺激和P. plecoglossicida感染下黏膜免疫组织(鳃和肠)、外周免疫组织(脾和头肾)和血液中TRAF6表达水平显著上调,表明大黄鱼TRAF6参与宿主的免疫应答。