桃红四物汤对大鼠肢体缺血-再灌注损伤骨骼肌长链非编码RNA H19、核因子κB-p65表达的影响
2022-09-14刘宗义朱付平李武平
刘宗义,朱付平,李武平
(湖南中医药大学第一附属医院,湖南 长沙 410007)
肢体缺血-再灌注损伤(Limb ischemic reperfusion injury,LI-RI)是肢体缺血损伤和再灌注损伤的合称,LI-RI多继发于挤压综合征、动脉栓塞、断肢再植、动脉损伤等疾病,致残率、病死率较高,不仅会导致患肢出现不可逆性肌肉坏死征象(小腿肌肉僵硬、肿胀、皮肤坏死等),血流再灌注会加重损伤,诱发全身重要器官衰竭,甚至危及生命。目前,医学界对于LI-RI的防治措施主要有预防性的筋膜切开术[1]、高压氧治疗[2]、基因治疗[3]等,但治疗成本较高,疗效不稳定,而且治疗LI-RI的具体作用机制尚未完全阐明。长期临床实践和动物实验研究表明,中医药在防治LI-RI方面具有独特优势[4],诸多中药中的有效成分在缺血-再灌注损伤(Ischemia reperfusion injury,IRI)防治中具有广阔前景[5]。课题组前期实验研究发现,活血化瘀类药物可通过调控Wnt/Ca2+信号途径下调三磷酸肌醇受体(IP3R)、Wnt5a、骨骼肌钙调蛋白依赖性蛋白激酶Ⅱ(CaMKⅡ)等蛋白表达从而减轻LI-RI[4,6]。
长链非编码RNA H19(Long non-coding RNA H19,LncRNA H19)是一个长度为3.0 kb具有高度进化保守性的LncRNA,作为最早发现的印记基因,LncRNA H19在肢体缺血-再灌注损伤中发挥重要作用。研究显示,LncRNA H19的异常表达与小鼠精原细胞(GC-1)缺血再灌注损伤密切相关[7],在机体重要脏器的缺血-再灌注损伤性疾病的病理机制研究中,显示LncRNA H19是IRI的上游关键分子,通过调控NF-κB通路表达降低下游炎症因子表达,发挥着重要的生物调控功能[7-9]。NF-κB 信号通路是 Wnt/Ca2+信号通路的主要小通路,可启动和调控 IL-1、TNF-α等炎症因子转录,而炎症因子又能反向推进NF-κB信号通路中蛋白的表达,诱导加重炎症反应[10]。课题组前期从Wnt/Ca2+信号通路中的蛋白分子相互关系角度研究,证实桃红四物汤能调控通路中的关键蛋白、降低钙超载、机体炎症反应,而NF-κB通路作为Wnt/Ca2+信号通路的关键小通路,其与LI-RI发生的相互关系尚未阐明,本实验着重探讨上游分子LncRNA H19与NF-κB通路间的调控关系,寻找LI-RI 损伤中骨骼肌细胞损伤的关键分子靶点,深入研究肢体缺血-再灌注损伤中骨骼肌细胞损伤的分子病理机制并予桃红四物汤干预,以多层面丰富LI-RI病理机制,为中医药防治LI-RI提供科学理论依据与新思路。
1 材料与方法
1.1 实验材料
1.1.1 实验动物:雄性SD大鼠78只,SPF级,8~10周龄,体重220~250 g,购于湖南斯莱克景达实验动物有限公司,动物实验伦理编号(LLBH-202103050001)、动物生产许可证号[SCXK(湘)2019-0004]、实验单位使用许可证编号[SYXK(湘)2019-0009]。所有大鼠均喂养于湖南中医药大学动物实验中心,相对湿度保持在50%~70%,温度20~25 ℃,光照12 h/d,常规饲料喂养,自由饮水。
1.1.2 实验药物:桃红四物汤由湖南中医药大学第一附属医院制剂科利用现代技术工艺加工制成。组成药物:桃仁、红花各15 g,川芎、熟地、当归、赤芍各10 g。根据药物所含主要有效成分的理化性质,确定桃红四物汤的制备工艺路线:桃仁、红花、川芎、熟地、当归、赤芍六味药物提取,水提液减压浓缩至相对密度1.08~1.12(热测温度 60 ℃),加入苯甲酸钠使其溶解,分装,即得。桃红四物汤原药物浓度为0.15 g/ml(规格250 ml/瓶,批号20201215)。
1.1.3 主要试剂与仪器:大鼠LncRNA H19阻断剂hsa-miR-199a-5p miRNA Inhibitor(批号CIH0463,美国Cohesion公司),大鼠NF-κB-p65 WB抗体(批号66535-1-Ig,Proteintech公司),mRNA逆转录试剂盒(批号CW2569,中国北京康为世纪公司),miRNA逆转录试剂盒(批号CW2141,北京康为世纪公司),荧光定量RCP仪(型号PIKOREAL96),台式冷冻离心机(型号H1650R,湖南湘仪公司),电泳仪(型号DYY-6C,北京六一公司),BD-180S双门冷冻柜(型号BC/BD-318HD,青岛海尔冰箱通用有限公司);Image Pro plus version 6.0(美国Media Cybernetics公司);酶标仪(型号PO-9622A,上海培奥分析仪器有限公司);实时PCR扩增仪(型号7500,美国ABI公司)。
1.2 实验方法
1.2.1 动物分组与给药:按随机数字表将78只SD大鼠分为空白组、模型组、LncRNA H19阻断剂组、桃红四物汤组,空白组6只,其余每组24只。桃红四物汤组于缺血前3 d开始予桃红四物汤灌胃,每天灌胃2次,缺血前2 h再给药1次,除空白组外每只动物共灌胃7次,给药剂量根据体质量通过“体表面积-剂量换算法”计算得出,依据课题组前期动物实验结果,桃红四物汤中剂量(0.15 g/ml)为最佳药效浓度[11],即每次灌胃给药剂量为2 ml,未采用桃红四物汤灌胃的其余各组在给药相同时间点给予等体积蒸馏水灌胃。阻断剂组造模前2 h予尾静脉注射LncRNA H19基因阻断剂3.75 mg/kg[12-13]。模型组、桃红四物汤组在同样时间点给予相同体积0.9%氯化钠溶液尾静脉注射,每日固定时间点给药2次,除空白组外其余各组大鼠连续给药7次。
1.2.2 大鼠LI-RI模型构建:所有动物置恒温恒湿和自然光照的动物房中适应性饲养1周。空白组动物不造成肢体缺血-再灌注损伤,余下三组大鼠参照前期实验方法造模[14],用口腔正畸橡皮筋和塑料套管阻断大鼠左后肢血流4 h,再解除患肢橡皮筋和扎带阻断恢复下肢血液灌注,制备LI-RI模型。阻断大鼠左后肢血流4 h后,大鼠趾掌变得苍白,局部皮肤青紫、皮温发凉,患肢活动明显受限,恢复患肢血流灌注后,大鼠趾掌恢复红润温暖,提示造模成功。
1.2.3 实验动物取材:在血流再灌注0、2、4、8 h 时间点,每组随机选取6只大鼠(除空白组6只大鼠于0 h全部选取),用3%戊巴比妥钠1.5 ml/kg腹腔注射麻醉,麻醉成功后,将大鼠固定在手术台上,用脱毛膏脱去左后肢毛发备皮,络合碘体表消毒后75%酒精脱碘,沿左侧后肢纵轴方向切开皮肤、筋膜,暴露左下肢腓肠肌,每只大鼠患肢截取腓肠肌组织300 mg,用0.9%氯化钠溶液洗净,干燥,刀片切割后装入保存管中,迅速置于-70 ℃超低温冰箱中保存。
1.2.4 HE染色:取0.25 mg缺血-再灌注4 h大鼠腓肠肌组织,用4%中性甲醇溶液固定腓肠肌组织,4 μm厚度石蜡切片后60 ℃恒温,烤片12 h,切片脱蜡至水,将切片用苏木素染1 min后用蒸馏水冲洗,PBS返蓝后再用伊红染30 s,再次用蒸馏水冲洗并用酒精脱水处理,置于二甲苯中10 min后封片,染色后在显微镜下观察各组大鼠腓肠肌组织炎症反应及形态学变化。
1.2.5 DAPI荧光染色:取0.25 mg再灌注4 h大鼠腓肠肌组织,60 ℃烤片12 h,切片,脱蜡至水,DAPI工作液37 ℃染核10 min,PBS冲洗,缓冲甘油封片,避光存放,荧光显微镜电脑采集,每个样本取5个视野采集,倍数为400倍。骨骼肌细胞凋亡率=(细胞核浓缩细胞数÷细胞总数)×100%。
1.2.6 RT-qPCR检测:取0.25 mg大鼠腓肠肌组织,采用Trizol法提取骨骼肌总RNA,将腓肠肌组织加液氮充分研磨,室裂解5 min,离心后取上层液相加入20~30 μl无菌无酶水溶解沉淀,紫外分光光度计测定浓度。混匀,离心后孵育靶基因。再次离心,冷却,以GAPDH为内参,采用SYBR法测定目标基因相对表达量。引物序列见表1。

表1 LncRNA H19、NF-κB-p65、GAPDH引物序列
1.2.7 Western blot法检测:剪取0.025 g大鼠腓肠肌组织,预冷PBS洗组织,加入裂解液反复研磨,裂解后离心,灌胶,封胶。取50 μl的5×loading buffer加入蛋白上清中混匀,沸水煮5 min,电泳电压设定为恒定78 V,时间2.5 h,Marker 2 μl点入第1孔,其余每孔点入10~30 μl已变性蛋白上样,转膜电流300 mA恒定,将膜取出放入1×PBST中洗1次,将膜浸入后配制好的5 %脱脂奶粉中室温放置1 h,4 ℃过夜。再按照1∶2000比例稀释,将膜与一抗一起孵育,室温放置90 min,按照1∶5000比例用1×PBST稀释HRP标记的二抗与膜共同室温孵育90 min,ECL显色曝光、成像。
1.3 统计学方法 采用SPSS 25.0统计学软件进行分析,实验数据使用Graph Pad Prism 8软件制图分析。各组间比较采用单因素方差分析,若各组数据满足正态性、方差齐性,则采用重复测量资料方差分析,若方差不齐,则用多因素方差分析比较各组不同时间段组间LncRNA H19、NF-κB-p65表达差异;P<0.05表示差异有统计学意义。
2 结 果
2.1 各组大鼠HE染色结果比较 见图1。染色后显微镜观察,空白组腓肠肌纤维排列整齐,结构清晰,呈长索状,肌浆丰富,肌纤维表面有多个紧密附着的细胞核,核大小、着色均匀,未见异常改变。除空白组外,其余各组骨骼肌均可见不同程度的破坏和异常改变,随着再灌注时间的延长,各组肌肉组织破坏和形态学改变越发明显。模型组缺血-再灌注后骨骼肌纤维间缝隙增大,少量肌细胞破裂,细胞内可见明显炎症物质浸润;桃红四物汤组、LncRNA H19阻断剂组肌纤维轻度破坏,细胞受损肿大畸形,排列整齐,肌纤维间缝隙稍增大,炎症浸润不明显,较模型组减轻。

A:空白组;B:模型组;C:LncRNA H19阻断剂组;D:桃红四物汤组图1 各组大鼠缺血-再灌注4 h后腓肠肌形态比较(HE染色,×400)
2.2 各组大鼠DAPI荧光染色及腓肠肌细胞凋亡率比较 见表2(图2)。空白组腓肠肌细胞架构完整无变形,细胞核呈圆形或椭圆形,核外形、染色均匀。除空白组外,其余组均可见数量不等的凋亡小体,即细胞核碎裂成大小不等的圆形小体,核边缘不规则,被细胞膜包绕。模型组细胞凋亡率高于空白组,差异有统计学意义(P<0.05)。与模型组比较,LncRNA H19阻断剂组、桃红四物汤组细胞着色较重,核浓缩呈新月形,聚集于核膜一边,但两组细胞凋亡率均低于模型组,且桃红四物汤组低于LncRNA H19阻滞剂组,差异有统计学意义(P<0.05)。

表2 各组大鼠缺血-再灌注4 h后腓肠肌细胞凋亡率比较(%)
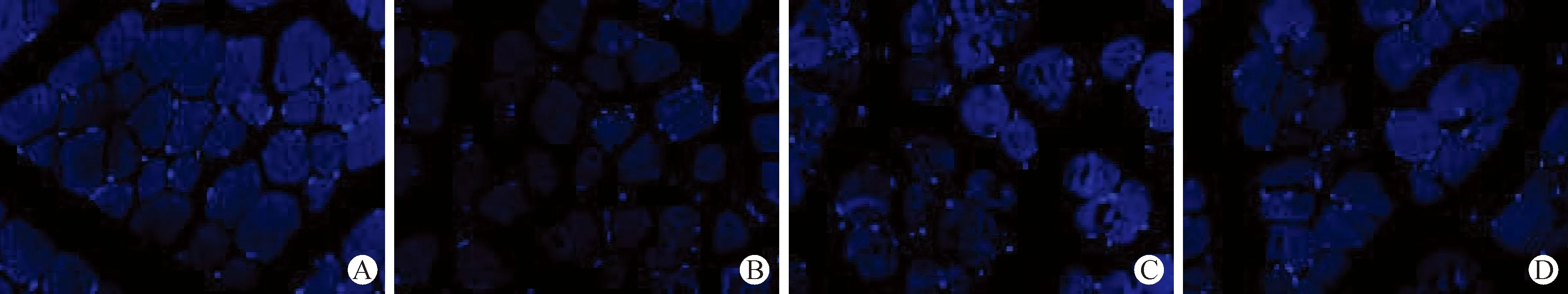
A:空白组;B:模型组;C:LncRNA H19阻断剂组;D:桃红四物汤组图2 各组大鼠缺血-再灌注4 h后腓肠肌细胞比较(DAPI染色,×200)
2.3 各组大鼠腓肠肌LncRNA H19表达比较 见表3。与空白组比较,干预后模型组、LncRNA H19阻断剂组、桃红四物汤组中 LncRNA H19表达均上调,差异有统计学意义(P<0.05)。随着血流再灌注时间延长,LncRNA H19在骨骼肌中的表达逐渐增强,于再灌注4 h达到最高值,血流再灌注4 h后呈现下降趋势。与模型组比较,桃红四物汤组、LncRNA H19阻断剂组的干预4、8 h,LncRNA H19表达均低,差异有统计学意义(P<0.05)。干预4、8 h,LncRNA H19阻断剂组的LncRNA H19表达量低于桃红四物汤组,差异有统计学意义(P<0.05)。

表3 各组大鼠不同时间点腓肠肌LncRNA H19表达比较
2.4 各组大鼠腓肠肌NF-κB-p65蛋白表达比较 见表4(图3)。模型组大鼠腓肠肌NF-κB-p65蛋白表达高于空白组大鼠的腓肠肌NF-κB-p65蛋白表达,差异有统计学意义(P<0.05)。桃红四物汤组、LncRNA H19阻滞剂组大鼠腓肠肌NF-κB-p65蛋白表达均高于模型组大鼠的水平;而随着时间延长,NF-κB-p65蛋白表达升高,且在2、4 h两组表达均高于模型组,差异有统计学意义(P<0.05)。桃红四物汤组、阻滞剂组大鼠腓肠肌NF-κB-p65蛋白表达比较,差异无统计学意义(均P>0.05)。

表4 各组大鼠不同时间点腓肠肌NF-κB-p65蛋白表达比较

A:空白组;B:模型组;C:LncRNA H19阻断剂组;D:桃红四物汤组图3 各组大鼠不同时间点NF-κB-p65蛋白表达比较
2.5 各组大鼠腓肠肌NF-κB-p65 mRNA表达比较 见表5。随着血流再灌注时间的延长,NF-κB-p65 mRNA在骨骼肌中的表达逐渐增强,于再灌注4 h到达最高值,血流再灌注4 h后表达量有所下调。与空白组比较,模型组、LncRNA H19阻断剂组、桃红四物汤组中NF-κB-p65 mRNA表达均增强,差异有统计学意义(均P<0.05)。与模型组比较,桃红四物汤组、LncRNA H19阻断剂组NF-κB-p65 mRNA表达均低于模型组,差异有统计学意义(均P<0.05)。LncRNA H19阻断剂组NF-κB-p65 mRNA表达低于桃红四物汤组,差异有统计学意义(均P<0.05)。

表5 各组大鼠不同时间点腓肠肌NF-κB-p65 mRNA表达比较
3 讨 论
LI-RI是肢体出现缺血后血液又回灌入组织而引起的一系列组织损伤,常继发于动脉损伤、断肢(指)再植、血栓性闭塞等临床疾病中,是一种病理机制复杂且治疗困难的临床疾病,不仅可以引发局部组织和器官损伤,而且可诱发远隔组织、器官的进一步损伤,严重时甚至可导致全身炎症反应及多器官功能衰竭[15]。随着现代医学研究的深入,国内外学者发现LI-RI的发生发展与自由基、细胞凋亡、钙超载、中性粒细胞的黏附与聚集、NO等众多因素密切相关,以及诱发大量促炎症细胞因子爆发式释放,如NF-κB-p65、IL-1β、TNF-α等,不仅会再次加重肌肉组织的损伤,且炎症因子进入血液循环,可诱发全身炎症反应和远隔重要器官损害[16]。
团队前期研究发现,桃红四物汤可通过调控Wnt/Ca2+信号通路中IP3R、Wnt5a、CaMKⅡ等关键受体减轻钙超载反应,降低LI-RI大鼠腓肠肌细胞凋亡率,并下调血浆中IL-1β、TNF-α等炎症因子表达,起到减轻LI-RI作用[17]。桃红四物汤由桃仁、干地黄、红花、炒川芎、赤芍药、当归等中药组成,其中桃仁、红花能改善血管条件,防止血栓形成,加速溶栓过程。红花能提高大鼠体内超氧化物歧化酶(SOD)生物活性,降低丙二醛(MDA)血清水平,红花提取物预处理可降低大鼠肠缺血再灌注损伤的氧化应激反应、细胞凋亡率[18]。当归可减少组织过氧化损伤和提高细胞生物膜的稳定性,川芎具有抗氧化作用,在小肠缺血再灌注损伤中,其主要成分川芎嗪能够拮抗内质网应激相关炎症和细胞凋亡通路表达[19]。赤芍总苷可通过增强抗氧化酶的生物活性,降低组织的脂质过氧化反应,提高细胞膜稳定性,减轻细胞因缺血而带来的病理损伤[20]。桃红四物汤可有效降低血浆中IL-1β、TNF-α等炎症因子表达,减轻LI-RI作用[21]。在脑缺血-再灌注方面,桃红四物汤可以通过激活PI3K/AKT信号转导通路促进脑缺血部位的血管新生,使脑缺血-再灌注损伤大鼠损伤的神经功能得到恢复[22]。
近年来国内外学者对LI-RI的防治和病理损伤的机制研究重心逐渐发展至分子生物学、细胞机制水平和信号因子、基因靶向调控等方面。LncRNA H19是一个长度为3.0 kb具有高度进化保守性的长链非编码RNA,在机体众多内脏器官的I-RI类疾病的病理机制中,LncRNA H19均起到了生物调控功能[23]。LncRNA H19可通过敲减miR-103/107表达,抑制细胞坏死和拮抗小鼠I-RI心梗的出现[24]。在动脉粥样硬化调控机制的研究中发现,LncRNA H19在动脉粥样硬化患者血清中高度表达,通过NF-κB信号通路调控动脉粥样硬化疾病,促进血管平滑肌细胞增殖并抑制细胞凋亡[25-27]。LncRNA H19过表达后,NF-κB-p65蛋白在血管平滑肌细胞中高度表达[28-30]。而NF-κB信号通路是 Wnt/Ca2+信号通路中的主要小通路,普遍分布于细胞浆中,静息状态下它与抑制性蛋白IκB结合而为非活性状态。NF-κB是一种快反应转录因子,可被许多物质激活,如病毒、细胞内因子、蛋白激酶C激活剂及细胞外刺激等[31-33]。NF-κB信号通路被激活后可参与许多基因转录与调控过程,可调控与启动肿瘤坏死因子-α、白介素-1等炎症因子转录,进而引起一系列炎症反应[34-36]。在机体免疫、氧化应激、组织炎症、细胞增殖与凋亡等生理病理过程中发挥重要作用[37]。近年研究发现,LncRNA H19-NF-κB信号通路可相互作用,发挥其生物学作用[38]。刘湜桦等[39]研究发现,LncRNA H19通过激活NF-κB信号通路,促进幽门螺旋杆菌感染的GC细胞增殖、迁移、侵袭。Jiang等[40]通过抑制脑出血模型大鼠中LncRNA H19表达,发现 LncRNA H19沉默后,脑出血大鼠脑组织NF-κB-p65表达降低,提示LncRNA H19可导致神经损伤,释放炎症因子,加剧氧化应激,并通过激活NF-κB通路进一步加重脑出血大鼠脑损伤。以上研究表明,LncRNA H19-NF-κB信号通路与LI-RI炎症反应、细胞凋亡密切相关,并可调控NF-κB信号通路和介导炎症反应发生。
本研究HE染色结果显示,桃红四物汤组和LncRNA H19阻滞剂组腓肠肌纤维的破坏程度较模型组明显减轻,且桃红四物汤组的肌纤维轻度破坏,炎症浸润不明显,较LncRNA H19阻断剂组稍减轻。DAPI 荧光染色显示,桃红四物汤组、LncRNA H19阻滞剂组细胞凋亡率低于模型组,说明LncRNA H19阻滞剂、桃红四物汤预处理可减少细胞凋亡,减轻LI-RI作用。 RT-qPCR 、Western blot检测结果显示,与空白组相比,各组大鼠NF-κB-p65蛋白及其mRNA表达一致性上调,说明NF-κB-p65是LI-RI Wnt5a/Ca2+信号通路的关键蛋白;与模型组相比,桃红四物汤组、LncRNA H19阻滞剂组不同时间点腓肠肌 LncRNA H19表达一致性下调,提示桃红四物汤可抑制LncRNA H19表达。桃红四物汤组、阻滞剂组的NF-κB- p65表达比较差异无统计学意义,表明桃红四物汤可通过调控上游分子LncRNA H19途径下调NF-κB- p65表达,减轻LI-RI作用。这为 LI-RI骨骼肌细胞损伤的分子机制和桃红四物汤的防治作用提供了实验证据。在研究 LI-RI 发生、进展、预防的分子病理机制中,NF-κB是Wnt/Ca2+信号通路的一条关键小通路,上游分子LncRNA H19是否可以通过调控Wnt/Ca2+信号途径中其他小通路的表达协同影响LI-RI,以及桃红四物汤在抑制LI-RI细胞凋亡方面可能存在多通路、多靶点效应,值得进一步开展体外细胞实验研究。
