樟疫霉拮抗链霉菌S-03菌株发酵条件优化及其稳定性探究
2022-09-13孙志敏李昱龙沈紫竹赵银娟
孙志敏,李昱龙,沈紫竹,陈 芃,樊 奔,赵银娟*
(1.南方现代林业协同创新中心,中国江苏 南京 210037;2.南京林业大学a.生物与环境学院;b.林学院,中国江苏 南京 210037)
樟疫霉属卵菌门(Oomycota)、疫霉属(Phytophthora),是全球最具破坏力的植物病原体之一[1]。樟疫霉侵染植物导致根部萎缩,叶片缩小褪绿,冠变薄和树颈坏死[2];伴随着土壤周围产生黑色渗出物[3],主根逐渐坏死并延伸到侧根和茎,最终导致植物的死亡[4]。樟疫霉的寄主植物从20世纪80年代的900多种,已增长到5 000多种[5],造成农林业巨大损失。因此,防治樟疫霉成为亟待解决的问题。在农林业生产中,人们普遍使用甲霜灵、亚磷酸盐等化学农药抑制疫霉病害[6~8]。但是,长期使用化学农药会使病原菌产生耐药性,而且化学杀菌剂对土壤环境及人类健康具有潜在威胁[9],因此,使用天然活性化合物和生物防治疫霉病害[3],是发展绿色农业的有效途径。
放线菌(actinomycete)在自然界中广泛分布,种类繁多,代谢功能各异,是人类获得天然化合产物的主要来源。绝大多数已知的放线菌具有抗菌活性。目前,已发现的次级代谢产物达22 500多种,具有抑菌活性的有16 500种,其中10 100种来自放线菌,7 630种来自链霉菌(streptomycete)[10]。链霉菌能产生多种次生代谢物,包括抗生素、铁载体、固氮酶、植物激素、抗菌酶、抗氧化剂等,从而促进植物生长和发育,抵抗病原菌的侵染[11~12]。因此,该菌在农林业极具应用价值。当前,已有多种抗菌代谢物被广泛应用于真菌病害防治[13]。比如:嗜酸链霉菌(Streptomycesphilanthi)RM-1-138能通过产生挥发性物质,防控立枯丝核菌(Rhizoctoniasolani)、灰梨孢菌(Pyriculariagrisea)、镰刀菌(Fusariumfujikuroi)等植物病原真菌引发的病害[14];埃尼索氏链霉菌(Streptomyceteenissocaesilis)的发酵滤液可以有效抑制向日葵土壤中的寄生杂草(Orobanchecumana),增加向日葵根际多酚氧化酶的活性,改善根际有益微生物的菌群[15];从美洲鳄梨(ButyrospermumparkiiKotschy)和樟属(Cinnamomum)植物根部分离出的内生木霉(Trichoderma),可以有效防治樟疫霉侵染引发的鳄梨根腐病[16]。因此,环境中存在着大量的具有潜在价值的生防链霉菌菌株。本研究前期从锦绣杜鹃(Rhododendron pulchrumSweet)土壤根际筛选得到了对樟疫霉具有拮抗效应的生防菌株阿劳琼链霉菌(Streptomycesaraujoniae)S-03。阿劳琼链霉菌是2013年巴西科学家Da Silva等[17]从马铃薯根部分离出来的一种新的链霉菌种,其对樟疫霉的拮抗作用为本实验室首次报道,但关于该菌株的高效发酵条件及抑菌物质的物理化学特性尚不明确。因此,本研究围绕菌株发酵条件优化、抑菌活性物质稳定性和离体植物叶片防治开展研究,为后期菌株的抑菌活性物质分离和鉴定做铺垫,同时也为后续大规模发酵和生防菌剂的开发奠定基础。
1 材料和方法
1.1 材料
1.1.1 供试菌株
阿劳琼链霉菌菌株S-03由本实验室从南京林业大学锦绣杜鹃健康植株根际土壤中分离筛选获得,樟疫霉PC-1由南京林业大学森林保护系戴婷婷老师友情提供。
1.1.2 培养基
樟疫霉菌株的培养及链霉菌抑菌活性的检测采用10%V8番茄汁培养基:V8番茄汁100 mL、CaCO33.0 g、琼脂15.0 g,用去离子水补足至1 000 mL,121℃灭菌20 min。
链霉菌活化采用高氏一号(Gause’s synthetic agar)培养基:可溶性淀粉 20.0 g、K2HPO40.5 g、NaCl 0.5 g、MgSO4·7H2O 0.5 g、KNO31.0 g、FeSO4·7H2O 0.01 g,pH 7,用去离子水补足至1 000 mL,121℃灭菌20 min。
发酵种子液培养基:可溶性淀粉20.0 g、牛肉膏 3.0 g、葡萄糖 1.0 g、酵母粉 5.0 g、CaCO34.0 g,pH 7,用去离子水补足至1 000 mL,121℃灭菌20 min。
基础发酵培养基:蛋白胨10.0 g、葡萄糖15.0 g、NaCl 1.0 g、(NH4)2SO41.0 g,用去离子水补足至1 000 mL,121℃灭菌20 min。
1.1.3 主要试剂及仪器
可溶性淀粉、牛肉膏、葡萄糖、酵母粉、CaCO3等分析纯试剂,购自国药集团化学试剂有限公司。
恒温培养箱(松下健康医疗器械株式会社,日本);高速冷冻离心机(艾本德公司,德国);旋转蒸发仪(IKA集团,德国),环境扫描电子显微镜(FEI公司, 美国)。
1.2 方法
1.2.1 生防菌株S-03发酵液制备
发酵种子液的制备:将菌株S-03接种于高氏一号固体培养基,28℃培养5 d;随后,接种到发酵种子液培养基中,28℃、160 r/min培养3 d。
发酵液制备:按1%接种量将种子液接种到发酵培养基中,28℃、160 r/min培养7 d。6 000 r/min离心20 min后,上清液经0.22 μm滤膜过滤,用于抑菌活性检测。
1.2.2 发酵液抑菌活性检测
将樟疫霉接种于V8番茄汁固体培养基,25℃培养3 d。用6 mm打孔器打取菌饼,接种到新鲜V8番茄汁固体培养基中央,在菌饼左右两边1.5 cm处各用打孔器取出琼脂块,并在孔中分别添加50 μL培养基对照和阿劳琼链霉菌S-03发酵液,25℃培养3 d,通过比较两边菌丝生长半径的差异计算抑制率。

1.2.3 发酵培养基的优化
通过单因素实验对培养基碳源、有机氮源、无机氮源和无机盐条件进行优化。在基础发酵培养基中,分别选用葡萄糖、蔗糖、山梨醇、甘露醇、麦芽糖、可溶性淀粉作为主要碳源(15 g/L);黄豆饼粉、蛋白胨、酵母粉、牛肉粉、尿素作为唯一有机氮源(10 g/L);NH4Cl、(NH4)2SO4、NH4NO3、NaNO3、KNO3作为无机氮源(1 g/L);ZnCl2、KCl、NaCl、MgCl2、MnCl2、CaCl2作为无机盐(1 g/L)。参照方法1.2.2检测各样品抑菌活性,以确定最佳培养基成分。
1.2.4 发酵培养基的正交试验
在对碳源、有机氮源、无机氮源和无机盐营养成分完成筛选的基础上,设计4因素3水平的正交试验(表1),进行抑菌分析。每个处理重复3次。

表1 正交试验因素和水平设计Table 1 The orthogonal test on factors and levels
1.2.5 发酵条件的优化
选用最优发酵培养基配方,对发酵的装液量、起始pH、时间、接种量、温度、转速进行优化。每个处理重复3次。
装液量:在250 mL锥形瓶中,分别添加25 mL、50 mL、75 mL、100 mL、125 mL、150 mL 的最优发酵培养基,28℃、160 r/min培养7 d。
起始pH:将培养基的起始pH分别调至4、5、6、7、8、9、10、11,28 ℃、160 r/min 培养 7 d。
发酵时间:在28℃、160 r/min条件下培养1~10 d。
接种量:将种子液分别以1%、2%、4%、6%、8%接入到发酵培养基中,28℃、160 r/min培养7 d。
发酵温度:将发酵培养基分别置于25℃、28℃、31℃、34℃、37℃,160 r/min培养7 d。
发酵转速:将发酵转速分别设置为120 r/min、140 r/min、160 r/min、180 r/min、220 r/min,28 ℃培养7 d。
1.2.6 发酵液中抑菌物质的稳定性检测
热稳定性:取1 mL发酵液置于2 mL离心管中,分别在30℃、40℃、50℃、60℃、70℃、80℃、90℃、100℃处理1 h,参考1.2.2的方法检测各组分抑菌活性。每个处理重复3次。
酸碱稳定性:取10 mL发酵液,将pH分别调节至 3、4、5、6、7、8、9、10、11、12,室温放置 2 h 后调pH至7,测定各组分抑菌活性。每个处理重复3次。
光照稳定性:取5 mL发酵液置于培养皿中,室温下打开盖子,置于紫外灯下分别照射0 h、2 h、4 h、6 h、8 h、10 h,测定各组分抑菌活性。每个处理重复3次。
亲水性和疏水性:在发酵液离心后的上清液中分别加入等体积的三氯甲烷、正丁醇、乙酸乙酯和石油醚,振荡萃取24 h,分别检测有机相跟水相的抑菌活性。每个处理重复3次。
1.2.7 菌株S-03发酵液对樟疫霉菌丝生长的影响
在V8番茄汁固体培养基中央接种樟疫霉,并用打孔器在樟疫霉左右两边打孔,分别添加50 μL培养基和S-03发酵液,28℃培养3 d,观察菌丝生长状况。将左右两孔周边的菌丝置于环境扫描电子显微镜Quanta 200下,观察菌丝形态。
1.2.8 菌株S-03发酵液在离体植物的生防检测
用75%乙醇浸泡锦绣杜鹃叶片30 s,无菌水冲洗3次后,用10%次氯酸钠浸泡30 s,再用无菌水冲洗3次。病原菌对照组在叶脉两侧使用灭菌针制造表面伤口,接种樟疫霉菌饼。生防组接种S-03发酵液后立即接种樟疫霉。处理后将叶片置于含润湿的无菌滤纸平板中,28℃恒温箱内培养5 d,评估防治效果。

1.2.9 数据处理
所有数据用平均值±标准差()表示。原始数据记录于Excel 2016。培养基营养条件、发酵参数和抑菌物质稳定性,以及正交试验,均使用SPSS 19进行显著性差异分析。使用Photoshop 2018计算病斑与叶片像素比,测定叶片相对病斑面积。使用GraphPad Prism 8.0绘制图片。
2 结果
2.1 发酵培养基成分的优化
我们首先对培养基的碳源、有机氮源、无机盐、无机氮源进行了优化。所选的6种碳源培养基的抑菌效果如图1A所示,菌株S-03在6种不同的碳源中均能产生抑菌活性物质,但无显著差异;以可溶性淀粉为碳源时,菌株S-03对樟疫霉的抑制率相对较高,达到58.44%。5种有机氮源发酵液的抑菌检测效果如图1B所示,以酵母粉和黄豆饼粉为有机氮源时抑菌效果最佳,分别是47.28%和50.27%,与蛋白胨、尿素、牛肉粉3种发酵液的抑菌效果有显著差异。对于无机盐成分而言,菌株S-03对KCl的利用效果较好,其次是NaCl、MgCl2(图1C)。此外,菌株S-03以NH4Cl为无机氮源时,抑菌效果最差,仅为25.49%,以(NH4)2SO4为无机氮源时抑菌效果最佳,达到45.23%(图1D)。上述结果说明培养基成分能显著影响发酵液的抑菌效果。
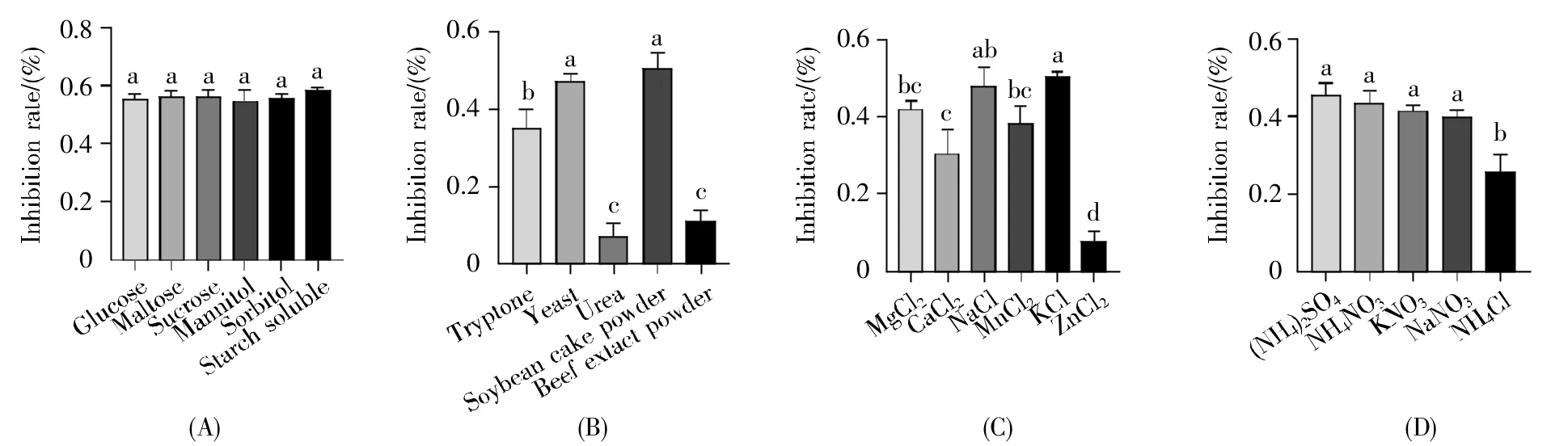
图1 菌株S-03发酵培养基的优化(A)碳源;(B)有机氮源;(C)无机盐;(D)无机氮源。不同字母表示不同处理经Duncan’s新复极差法检验,在P<0.05水平差异显著。Fig.1 Optimization of fermentation medium for strain S-03(A)Carbon sources;(B)Organic nitrogen sources;(C)Inorganic salts;(D)Inorganic nitrogen sources.Different letters indicate significant difference(P<0.05)when different treatments were tested by Duncan’s new multiple range method.
2.2 培养基成分质量浓度的优化
采用正交试验对碳源、有机氮源、无机盐、无机氮源的最佳培养基质量浓度进行优化,结果如表2所示。根据R值的大小可知,4种因素对菌株S-03发酵液抑菌效果的影响顺序为:黄豆饼粉>KCl>(NH4)2SO4>可溶性淀粉。根据K值的大小可得出,最佳发酵培养基水平为可溶性淀粉(3)、黄豆饼粉(1)、(NH4)2SO4(1)、KCl(1),即最佳发酵培养基配方为:可溶性淀粉45 g/L、黄豆饼粉20 g/L、(NH4)2SO41 g/L、KCl 1 g/L。
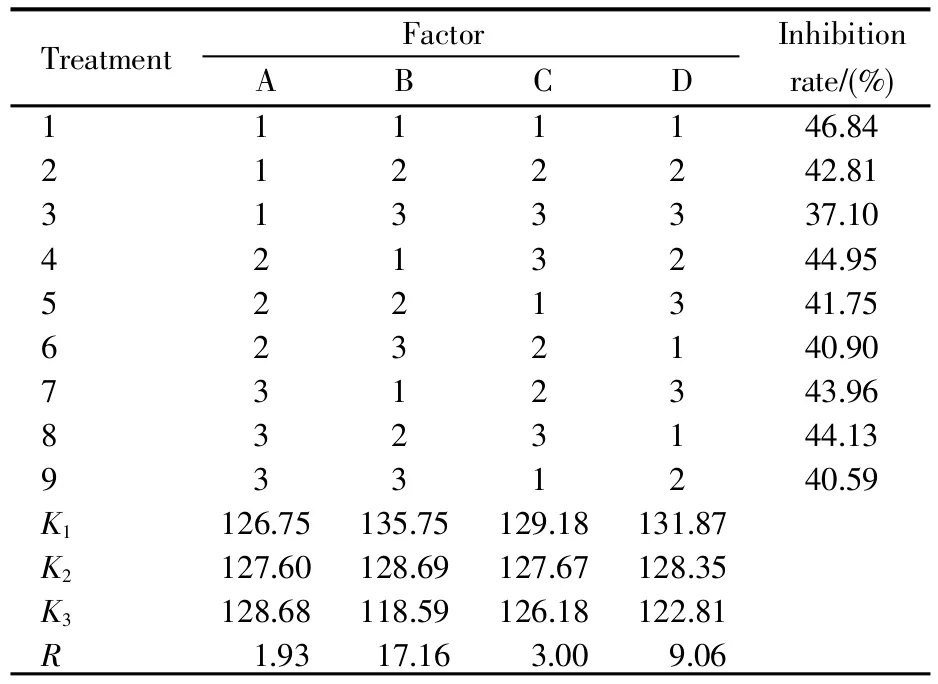
表2 正交试验结果Table 2 Orthogonal experiment results
2.3 发酵条件的优化
选用最优发酵培养基对发酵条件进行优化,结果如图2所示,在起始pH 8、装液量75 mL/250 mL、发酵时间7 d、接种量2%、发酵温度28℃、转速160 r/min时,菌株S-03的抑菌活性最佳。菌株S-03原始配方发酵液的抑制率仅为30.92%(图3A),而优化后发酵液的抑制率达到了58.66%(图3B),相比原配方提高了89.72%。
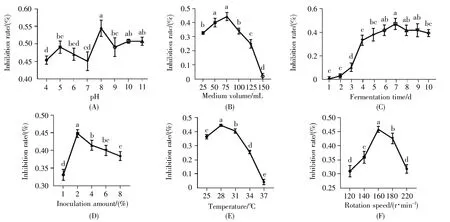
图2 不同发酵条件对菌株S-03发酵液抑菌效果的影响(A)发酵起始pH;(B)装液量;(C)发酵天数;(D)接种量;(E)发酵温度;(F)发酵转速。不同字母表示不同处理经Duncan’s新复极差法检验,在P<0.05水平差异显著。Fig.2 The influence of different fermentation conditions on the antifungal effect of the fermentation broth of strain S-03(A)Initial pH value;(B)Amount of liquid;(C)Fermentation time(days);(D)Inoculum amount;(E)Fermentation temperature;(F)Rotation speed during fermentation.Different letters indicate significant difference(P<0.05)when different treatments were tested by Duncan’s new multiple range method.

图3 优化培养基配方和发酵条件后菌株S-03发酵液的抑菌效果比较(A)原配方发酵液抑菌效果;(B)优化配方后发酵液抑菌效果。Fig.3 Comparison of the antifungal effect of strain S-03 fermentation broth after medium formula and fermentation condition optimization(A)The antifungal effect before optimization;(B)The antifungal effect after optimization.
2.4 菌株S-03发酵液抑菌活性物质的稳定性与极性分析
为了探究S-03菌株发酵液在不同环境的应用效果,我们对菌株S-03发酵液的热稳定性、酸碱稳定性、紫外稳定性以及抑菌物质的极性进行了分析。结果显示:pH>7时,发酵液的抑制率随pH的升高而降低,在3~7范围内,发酵液的抑制率波动较小,表明其能够耐受酸性条件,但碱性条件对活性物质可能具有破坏作用(图4A);随着温度的升高,发酵液的抑制率逐渐降低,说明它不能耐受高温(图4B);发酵液经紫外照射处理后,各组分的抑制率没有显著差异,说明发酵液的紫外稳定性较高(图4C);发酵液经正丁醇、乙酸乙酯和三氯甲烷萃取后,均有很好的抑菌效果,但经石油醚萃取后抑菌活性显著降低(图4D),表明S-03产生的抑菌物质极性较低,与正丁醇、乙酸乙酯和三氯甲烷极性接近。
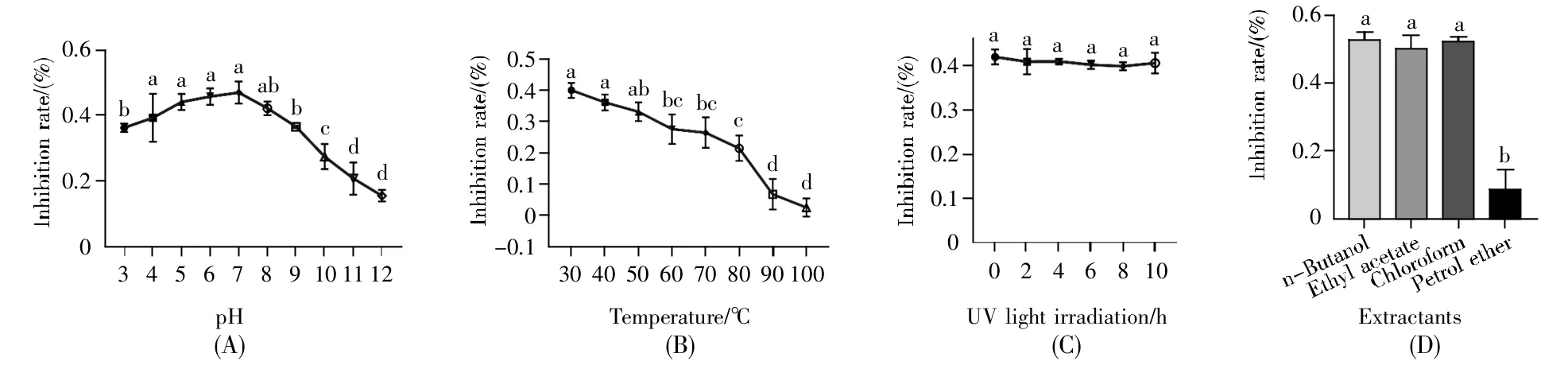
图4 菌株S-03抑菌物质的稳定性(A)酸碱稳定性;(B)热稳定性;(C)紫外照射稳定性;(D)抑菌物质极性。不同字母表示不同处理经Duncan’s新复极差法检验,在P<0.05水平差异显著。Fig.4 Stability of the antifungal substance from strain S-03(A)Acid-base stability;(B)Thermal stability;(C)UV-irradiation stability;(D)Polarity.Different letters indicate significant difference(P<0.05)when different treatments were tested by Duncan’s new multiple range method.
2.5 菌株S-03发酵液对樟疫霉菌丝生长的影响
利用扫描电子显微镜观察发酵液对樟疫霉菌丝形态的影响,结果显示:菌丝表面发生不同程度的损伤,呈现不均一的塌陷和皱缩干瘪(图5C,红色箭头指示)。而对照菌丝生长旺盛(图5A左侧),形态饱满,粗细均匀(图5B)。上述结果表明,S-03发酵液能够破坏樟疫霉菌丝的结构,从而抑制其生长。

图5 菌株S-03发酵液对樟疫霉菌丝形态的影响(A)S-03发酵液与樟疫霉平板对峙;(B)樟疫霉正常菌丝;(C)发酵液处理的樟疫霉菌丝。Fig.5 The effect of strain S-03 fermentation broth on the morphology of P.cinnamomi(A)S-03 fermentation broth vs.P.cinnamomi in plate culture;(B)P.cinnamomi normal mycelia;(C)P.cinnamomi mycelia treated with fermentation broth.
2.6 菌株S-03在杜鹃叶片上的生防测试
为了检测菌株S-03发酵液的生防效果,选择离体杜鹃叶片(在平板中保湿培养5 d)进行生防效果检测。结果显示:接种樟疫霉菌饼的杜鹃叶片出现黑色病斑(图6B),相对病斑面积为9.40%;未接种对照组无明显病斑(图6A);对于接种S-03发酵液再接种樟疫霉的叶片,伤口病斑明显减弱(图6C),相对病斑面积仅为1.88%,提示S-03发酵液有效减缓了樟疫霉对叶片的侵染。生防测试结果表明,菌株S-03发酵液在体外能够有效保护植物,防治效率高达80.00%。

图6 菌株S-03对杜鹃叶片的生防效果检测(A)未接种樟疫霉;(B)仅接种樟疫霉;(C)发酵液处理后接种樟疫霉;(D)杜鹃叶片相对病斑面积(每个处理3个叶片)。不同字母表示不同处理经Duncan’s新复极差法检验,在P<0.05水平差异显著。Fig.6 Biocontrol effect of strain S-03 on R.pulchrum leaves(A)Uninoculated;(B)Inoculated with P.cinnamomi;(C)Treated with fermentation broth before inoculation with P.cinnamomi;(D)Relative lesion area on leaves(3 leaves per treatment).Different letters indicate significant difference(P<0.05)when different treatments were tested by Duncan’s new multiple range method.
3 讨论
本研究前期筛选得到一株能有效抑制樟疫霉的生防链霉菌菌株S-03,其被鉴定为阿劳琼链霉菌。有研究发现,阿劳琼链霉菌可以通过产生缬氨霉素(valinomycin)和大环内酯类(macrolides)抗生素来抑制灰葡萄孢菌(Botrytiscinerea)[18]。Liu等[19]从中国青藏高原分离出阿劳琼链霉菌HSA312,其发酵液能有效抑制稻瘟病菌(Magnaportheoryzae)菌丝的生长、分生孢子的萌发和附着物的形成。本研究也是首次报道阿劳琼链霉菌S-03对樟疫霉有抑制作用,这拓宽了阿劳琼链霉菌的抗菌谱。本文采用单因素和正交试验相结合的方法,对菌株S-03的发酵培养基条件及参数进行了优化,同时对菌株S-03发酵液的理化性质进行了分析,为后续抑菌物质分离纯化奠定了基础。
发酵是微生物获得大量活性物质的重要途径,而发酵培养基的成分对活性物质的代谢合成具有十分重要的作用[20]。相关文献表明,不同的发酵培养基配方及条件对菌株所产生的抑菌活性物质有很大的影响[21]。因此,发酵培养基的优化及稳定性分析对后续抑菌活性物质的分离、纯化及大规模制备具有重要意义。本研究通过结合单因素试验及正交试验对S-03菌株的发酵条件进行了优化,获得了菌株最适宜的发酵培养基配方及条件,但没有考虑交互作用。正交试验结果显示,黄豆饼粉是影响菌株发酵液抑菌活性的主要因素(表2)。黄豆饼粉的蛋白质含量可达40%左右,并且含有丰富的氨基酸和维生素,能促进菌体生长和代谢产物的积累[22];此外黄豆饼粉成本低廉,原料丰富,且容易获取,因此其是后期进行规模化发酵生产的重要有机氮源。菌株S-03的发酵培养基中除了有机氮源黄豆饼粉外,还额外增添了无机氮源(NH4)2SO4,可以提高抑菌活性产物产量,这与链霉菌TD-1[23](氮源为黄豆饼粉+硝酸钾)相似。在发酵参数优化中,发酵起始pH和发酵天数对抑菌产物活性有较大影响,这与链霉菌GS-3-39[24](起始pH 5)、海洋放线菌H74-18[25](发酵时间72 h)差异较大。同种不同属的菌株发酵参数大相径庭,这可能与菌株自身的生理特征、遗传分化特性及分离来源有关,也可能与其生成活性物质的代谢通路有关,值得深入探讨。
发酵液中抑菌活性物质的稳定性是进行大规模菌剂生产的必要因素。周丽娜等[26]报道两株链霉菌HD-109、HD-103的抗菌活性物质对紫外光照敏感,照射5 h后,抑菌活性完全丧失,这限制了菌株在大田的生防应用。在本研究中,阿劳琼链霉菌S-03发酵液的稳定性实验表明,其抑菌活性物质能耐受pH 3~9条件(图4A)、60℃以下温度(图4B)以及紫外线照射(图4C),这有利于菌株S-03的野外生防应用。
发酵液对樟疫霉菌丝形态造成较大影响(图5C),推测发酵液中可能含有一些功能蛋白质,如纤维素酶、蛋白酶等,可破坏疫霉菌丝,也可能是菌株S-03产生的抗生素破坏了细胞膜的完整性。阿劳琼链霉菌S-03发酵液经过有机溶剂萃取后仍然存在较好抑菌效果,说明活性物质很可能是次级代谢产物,具体有待进一步的分离鉴定。阿劳琼链霉菌S-03在离体植物叶片中也表现出良好的生防效果,但本文缺少完整植株实验,后续将在无菌苗以及大田试验中继续验证阿劳琼链霉菌S-03的生防效果。有文献表明,链霉菌在防治植物真菌的同时还具有促进植物生长的作用,如:绛红褐链霉菌(Streptomycetepurpeofuscus)SP3[27]菌株对红豆杉土传根病和红豆杉植株具有防治与促生的双重作用,这极大提高了菌株的应用性。本实验尚未对阿劳琼链霉菌S-03的促生作用进行研究,这也是后续研究的重要方向。
综上所述,阿劳琼链霉菌S-03有潜力作为林业上防治樟疫霉根腐病害的生防菌株,有望制成生物菌剂,投入生防应用。优化后的培养基及培养条件极大提高了发酵液中抑菌活性物质的抑菌效果,为规模化投入生产应用提供了理论基础。
