基于高通量测序的5种蜘蛛所携带的细菌多样性比较
2022-09-13王玥琪ALIAbid崔淑艳
高 瑛,韩 瑜,王玥琪,ALI Abid,2,崔淑艳,郑 国
(1.沈阳师范大学生命科学学院,中国辽宁 沈阳 110034;2.费萨拉巴德农业大学昆虫学系,巴基斯坦费萨拉巴德 38040)
细菌广泛分布于自然界,并普遍存在于动物的各器官、组织和细胞。细菌种类丰富、群落构成复杂,参与宿主的营养代谢、生殖健康及对生境的适应等诸多生命活动[1~4],对真核生物的多样性和演化有十分重要的影响[5~6]。随着高通量测序技术的发展,人们对动物体微生物的多样性、群落组成及其功能的认识逐步深入。目前,针对昆虫微生物及其功能的相关研究工作较多[6~9]。关于蜘蛛微生物的研究,早期工作多集中于内共生菌的感染[10~13]以及内共生菌对宿主生殖和行为影响的研究[14~15]。近期,针对蜘蛛微生物群落的研究逐渐增多,如:蜘蛛整体细菌群落研究[16~17],基于组织、器官和种群水平的细菌多样性分析[18~21],蜘蛛肠道微生物与其猎物微生物多样性比较[18,22]等。但是,我国北方地区蜘蛛细菌群落的比较研究尚未见报道。
环境因素对昆虫共生菌的传播起着非常重要的作用[23]。蜘蛛是重要的农林害虫天敌,广泛存在于陆地生态系统,易于携带大量的共生菌和其他细菌等微生物[17]。不同蜘蛛对蛛丝的利用和捕食方式有所区别,所处的生境和取食的猎物也存在一定差异,因此,其所携带微生物的多样性和群落组成也将受到不同程度的影响。本研究基于16S rRNA测序方法,比较了利氏猫蛛(Oxyopeslicenti;猫蛛科Oxyopidae)、星豹蛛(Pardosaastrigera;狼蛛科Lycosidae)、金黄逍遥蛛(Philodromusaureolus;逍遥蛛科Philodromidae)、三突伊氏蛛(Misumenopstricuspidatus;蟹蛛科Thomisidae)和园蛛(Araneus)sp.1(园蛛科Araneidae)共5种蜘蛛的细菌群落,以期了解蜘蛛所携带细菌的多样性和群落组成与其捕食方式及生存环境的关系。
1 材料与方法
1.1 样本采集
蜘蛛样本于2020年10月中旬采自沈阳市沈北新区蒲河沿岸的社区公园(41°56'N,123°22'E)。本研究涉及的5种蜘蛛根据捕食方式不同分属5个功能群[24],其中,利氏猫蛛(其他游猎Ⅰ型)、金黄逍遥蛛(其他游猎Ⅱ型)、三突伊氏蛛(伏击型)和园蛛sp.1(圆网型)使用扫网法采自灌木丛,星豹蛛(地表游猎型)使用管扣法采自地表层。5种蜘蛛均属于非濒危和非保护物种。每种蜘蛛选取体型接近的10头个体,单头保存在小广口瓶(高5 cm,直径3 cm)中,瓶中放入浸水的棉花保湿,瓶口塞上干燥的棉花。饥饿两周之后,将蜘蛛经无水乙醇固定,于-20℃冰箱保存[16]。
1.2 DNA提取、PCR扩增和测序
按照DNeasy PowerSoil Kit(QIAGEN公司,美国)试剂盒的说明书,每种蜘蛛分别提取10头个体的整体DNA。使用1.2%琼脂糖凝胶电泳检测DNA提取质量和完整性,同时使用Nanodrop NC 2000分光光度计(Thermo Fisher Scientific公司,美国)检测DNA浓度和纯度(OD260/OD280比值)。之后随机选取两头同种蜘蛛提取的DNA等摩尔量汇合为一个样本,以减少测序数据的偶然性[16],每种蜘蛛得到5个DNA样本。
每个DNA样本使用16S rRNA V3~V4区通用引物 338F(5'-ACTCCTACGGGAGGCAGCA-3')和 806R(5'-GGACTACHVGGGTWTCTAAT-3')进行PCR扩增。扩增体系共25 μL:5 μL 5×reaction buffer,5 μL 5× GC buffer,2 μL dNTP(2.5 mmol/L),1 μL forward primer(10 μmol/L),1 μL reverse primer(10 μmol/L),2 μL DNA template,0.25 μL Q5 DNA polymerase,8.75 μL ddH2O。PCR 的反应条件为:98℃预变性2 min;98℃变性15 s,55℃退火30 s,72℃延伸30 s,循环25次;72℃延伸5 min。扩增产物通过2%琼脂糖凝胶电泳纯化回收目标片段,合格的产物通过Illumina NovaSeq PE 250平台进行测序(上海派森诺生物有限公司),用于评估细菌多样性[25]。
通过QIIME 2软件(2019.4)[26]中的Divisive Amplicon Denoising Algorithm 2(DADA2)插件对原始数据进行质控、去噪、拼接、去嵌合体[27],以100%相似度进行变异扩增子序列(amplicon sequence variant,ASV)聚类[28],然后根据Greengenes数据库[29],在Naive Bayes分类器中使用classifysklearn算法对每个ASV特征序列进行物种注释[30]。
1.3 数据处理与分析
对ASVs进行抽平处理后计算每个样本的α多样性,并通过R 3.3.1绘图进行可视化。α多样性采用Chao1丰富度指数[31]、Shannon多样性指数[32]、Simpson优势度指数[33]和Pielou均匀度指数[34]进行评估,使用Kruskal-Wallis秩和检验和Dunn’s test检验差异的显著性。通过线性判别分析效应量[linear discriminant analysis(LDA)effect size,LEfSe]揭示差异显著且能有效解释细菌群落差异的指示类群(LDA>4,P<0.05)[35],采用非参数Kruskal-Wallis秩和检验检测组间丰度差异的类群,同时通过Wilcoxon秩和检验验证显著性,最后通过线性判别分析(LDA)对数据进行降维并评估差异显著的物种的影响力。通过CANOCO 5.0分别在门和属两个分类水平对优势菌群进行主成分分析(principal component analysis,PCA),探讨蜘蛛所携带细菌的群落组成与其宿主功能群的关系。
2 结果
2.1 测序结果分析
所有样本共获得4 645 487条原始序列,经过DADA2进行质控后得到4 219 367条有效序列,平均每个样本获得168 775条有效序列。所有的测序结果被分为16 092个ASVs,共34门421科948属细菌(表1)。其中,采于地表的星豹蛛划分到的ASVs及注释到的细菌各分类水平的数量均最多,游猎于灌木丛的金黄逍遥蛛的数量均最少(表 1)。

表1 5种蜘蛛所携带细菌的16S rRNA测序基本信息Table 1 Sequence analysis of bacterial 16S rRNA genes from five species of spiders
2.2 不同蜘蛛所携带细菌的群落组成分析
在门分类水平上,5种蜘蛛所携带细菌的群落组成表现出了较大差异。变形菌门(Proteobacteria)、拟杆菌门(Bacteroidetes)和厚壁菌门(Firmicutes)是5种蜘蛛共有的核心菌门(>1%)。其中,变形菌门的相对丰度最高,在金黄逍遥蛛中占比高达74.78%,在星豹蛛中的占比最低,但也达到了47.10%;拟杆菌门的相对丰度在5种蜘蛛中较均匀,在利氏猫蛛中最高,为23.85%,在三突伊氏蛛中最低,为15.08%;厚壁菌门的相对丰度在利氏猫蛛、星豹蛛和三突伊氏蛛中超过10.46%,在另两种蜘蛛中也超过了5.04%。此外,放线菌门(Actinobacteria)和蓝细菌门(Cyanobacteria)的相对丰度在星豹蛛中分别高达16.18%和1.41%,而在其他4种蜘蛛中最高分别仅为2.90%和0.43%;软壁菌门(Tenericutes)的相对丰度在园蛛sp.1中高达12.64%,而在其他4种蜘蛛中最高仅为1.31%(图1A)。
在属分类水平上,5种蜘蛛所携带细菌的群落组成也表现出了较大差异。相对丰度大于1%的有17属,土壤杆菌属(Sediminibacterium)、苍白杆菌属(Ochrobactrum)、无氧芽孢杆菌属(Anoxybacillus)、贪铜菌属(Cupriavidus)和溶杆菌属(Lysobacter)是共有的核心菌属(>1%)。其中,土壤杆菌属和苍白杆菌属是除金黄逍遥蛛以外的其他4种蜘蛛中相对丰度最高的两个菌属,占比分别在13.97%~22.15%和12.75%~20.40%,这两个属在金黄逍遥蛛中的相对丰度也分别高达16.74%和14.93%;无氧芽孢杆菌属、贪铜菌属和溶杆菌属的相对丰度在三突伊氏蛛中均最高(11.77%、7.98%和6.54%),在金黄逍遥蛛中均最低(2.03%、1.60%和1.27%)。此外,立克次氏体属(Rickettsia)和沃尔巴克氏菌属(Wolbachia)的相对丰度在金黄逍遥蛛中分别高达28.63%和17.57%,在其他4种蜘蛛中均小于0.01%;微杆菌属(Microbacterium)、红球菌属(Rhodococcus)和芽孢杆菌属(Bacillus)的相对丰度在星豹蛛中分别为3.58%、3.59%和2.68%,在其他4种蜘蛛中最高分别为0.09%、0.02%和0.56%(图1B)。
2.3 不同蜘蛛所携带细菌的α多样性分析
本文基于ASVs水平比较了5种蜘蛛所携带细菌的α多样性。分析结果表明:Chao1指数在5种蜘蛛间不存在显著差异(P>0.05)。星豹蛛的Shannon指数和Pielou均匀度指数极显著高于金黄逍遥蛛(P<0.01),显著高于园蛛sp.1(P<0.05);两个指数在星豹蛛与利氏猫蛛、三突伊氏蛛之间,以及星豹蛛以外的其他4种蜘蛛之间不存在显著差异(P>0.05)。星豹蛛的Simpson指数仅显著高于金黄逍遥蛛(P<0.05);Simpson指数在星豹蛛以外的其他4种蜘蛛之间不存在显著差异(P>0.05)(图2)。
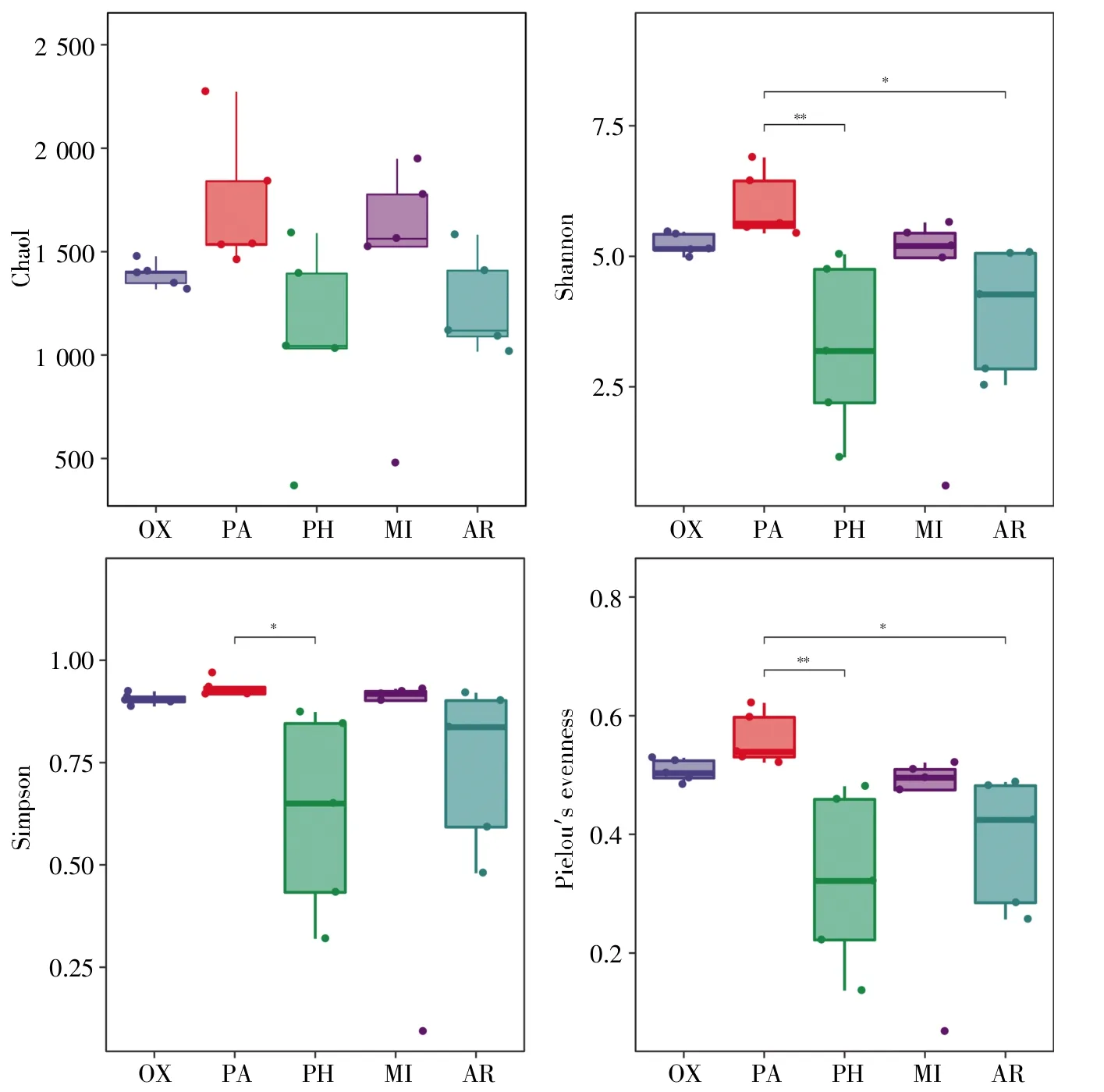
图2 5种蜘蛛所携带的细菌α多样性差异分析OX:利氏猫蛛;PA:星豹蛛;PH:金黄逍遥蛛;MI:三突伊氏蛛;AR:园蛛sp.1.*:P<0.05,**:P<0.01。Fig.2 Variance analysis of the α-diversity index of bacteria among five species of spidersOX:Oxyopes licenti;PA:Pardosa astrigera;PH:Philodromus aureolus;MI:Misumenops tricuspidatus;AR:Araneus sp.1.*:P<0.05,**:P<0.01.
2.4 不同蜘蛛所携带菌群的差异分析
为比较不同蜘蛛所携带细菌的差异,采用LEfSe分析来发掘相对丰度存在显著差异的类群(LDA>4,P<0.05)。分析结果显示,星豹蛛和金黄逍遥蛛所携带的细菌中存在相对丰度具有显著差异的菌群。星豹蛛中的放线菌门、放线菌纲(Actinobacteria)、放线菌目(Actinomycetales)、微杆菌科(Microbacteriaceae)、微杆菌属和芽孢杆菌属显著高于其他4种蜘蛛;金黄逍遥蛛中的立克次氏体科(Rickettsiaceae)、立克次氏体属和沃尔巴克氏菌属显著高于其他4种蜘蛛(图3)。
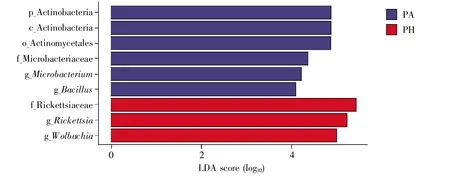
图3 5种蜘蛛所携带细菌的LEfSe分析PA:星豹蛛;PH:金黄逍遥蛛。图中仅显示LDA>4、P<0.05时差异显著的结果。Fig.3 LEfSe analysis of the bacteria among five species of spidersPA:Pardosa astrigera;PH:Philodromus aureoles.Only the results with significant difference(P<0.05)when LDA>4 are shown in the figure.
2.5 不同功能群蜘蛛优势菌群的PCA分析
为探讨蜘蛛所携带细菌的群落组成与其宿主功能群的关系,在门和属两个分类水平对蜘蛛优势菌群进行了PCA分析排序(图4)。在门分类水平,第一轴和第二轴分别解释了49.72%和28.70%的变异信息(累计78.42%),地表游猎型的星豹蛛与采自灌木丛的其他4种功能群蜘蛛的优势菌门差异较大,放线菌门与其相关性最高;在采自灌木丛的4种功能群蜘蛛中,软壁菌门与圆网型的相关性最高,变形菌门与其他游猎Ⅱ型的相关性更高(图4A)。在属分类水平,第一轴和第二轴分别解释了48.43%和26.43%的变异信息(累计74.86%),其他游猎Ⅱ型的金黄逍遥蛛与其他4种功能群蜘蛛的优势菌属差异较明显,沃尔巴克氏菌属和立克次氏体属与其相关性最高;红球菌属和芽孢杆菌属与地表游猎型的星豹蛛相关性最高(图4B)。

图4 不同功能群蜘蛛优势菌群的主成分分析(A)门;(B)属。OTH-Ⅰ:其他游猎Ⅰ型;GRH:地表游猎型;OTH-Ⅱ:其他游猎Ⅱ型;AMH:伏击型;ORW:圆网型。Fig.4 Principal component analysis of dominant bacteria among different guilds of spiders(A)Phylum;(B)Genus.OTH-Ⅰ:Other huntersⅠ;GRH:Ground hunters;OTH-Ⅱ:Other huntersⅡ;AMH:Ambush hunters;ORW:Orb web.
3 讨论
本研究比较了5种蜘蛛所携带细菌的多样性和组成差异,16S rRNA序列共注释到34门421科948属细菌。采于地表的星豹蛛所携带细菌的各分类水平数量均最高,为23门190科345属,最低的金黄逍遥蛛也达到了21门141科246属,高于以往大部分蜘蛛微生物相关研究结果[16~17]。
以往研究发现,宿主的生活环境和食物可以影响其共生菌及肠道微生物[22,36~38],这在本研究中也得到了部分证实。在门分类水平,本研究发现变形菌门的相对丰度在5种蜘蛛中均最高,是蜘蛛所携带的细菌群落中优势度最高的门。这一结果与以往很多节肢动物有关的研究结果相似,如:Zhang等[16~17]发现变形菌门在多种蜘蛛共生菌中相对丰度最高;Hu等[21]报道变形菌门在沟渠豹蛛(Pardosalaura)、星豹蛛和白斑隐蛛(Nursciaalbofasciata)的肠道菌群中相对丰度最高。此外,变形菌门也是灰飞虱(Laodelphaxstriatellus)[38]、橘二叉蚜(Aphisaurantii)[39]、中华通草蛉(Chrysoperlasinica)成虫[40]、荔枝蝽(Tessaratomapapillosa)[41]和日本龟蜡蚧(Ceroplastesjaponicus)[42]等多种昆虫共生菌群落中相对丰度最高的门。本研究结果显示,放线菌门的相对丰度在地表游猎型星豹蛛中高达16.18%,而在采自灌木丛的其他4种蜘蛛中最高仅为2.90%,证明了环境因素对蜘蛛所携带细菌群落具有重要作用。Zhang等[16]发现,变形菌门的相对丰度在采自武汉不同地点的迷宫漏斗蛛(Agelenalabyrinthica)(98.86%)和机敏漏斗蛛(Agelenadifficilis)(13.86%)之间存在着巨大差异,这也证实了环境因素的影响。此外,本研究发现,软壁菌门的相对丰度在圆网型园蛛sp.1中最高,为12.64%,而在同样采自灌木丛的其他3种蜘蛛中最高仅为1.31%,推测这是不同功能群蜘蛛猎取的食物不同造成的。向礼波等[43]也认为,食性是影响东亚钳蝎(Buthusmartensii)和西藏琵蝎(Scorpiopstibetanus)肠道优势菌属的重要因素。
在属分类水平,苍白杆菌属和土壤杆菌属的相对丰度在本研究的5种蜘蛛中均超过12%,前者与Hu等[21]在沟渠豹蛛、星豹蛛和白斑隐蛛肠道细菌中的分析结果相似,而后者在以往关于蜘蛛细菌群落的研究中占比均较低,最高仅为2.03%[16~17,21]。立克次氏体属和沃尔巴克氏菌属是多种蜘蛛细菌群落的核心菌群[2,13,16~17],它们在本研究的金黄逍遥蛛中是优势度最高的两个菌属,然而,这两个菌属的相对丰度在同样采自灌木丛的其他3种蜘蛛和采于地表的星豹蛛中均小于0.01%。这与Goodacre等[2]在多种蜘蛛中发现的这两个菌属分布不均的结果相似。王振宇等[44]认为,沃尔巴克氏菌属分布不均匀与蜘蛛自身条件、行为,以及沃尔巴克氏菌的传播效率有关。同时,本研究发现,红球菌属、微杆菌属和芽孢杆菌属是地表游猎的星豹蛛的核心菌群,但在采自灌木丛的其他4种蜘蛛中的相对丰度均很低。上述结果从属的分类水平再次支持了,环境因素和不同的食物对蜘蛛所携带细菌的群落组成的重要性。
在多样性分析结果中,星豹蛛所携带细菌的各α多样性指数均最高,其中Shannon指数和Pielou均匀度指数显著高于金黄逍遥蛛和园蛛sp.1,Simpson指数显著高于金黄逍遥蛛(P<0.05);而采自同一灌木丛的其他4种蜘蛛的各α多样性指数的差异均较小(P>0.05)。以上信息说明,环境因素对蜘蛛所携带细菌的α多样性有重要影响。
通过比较不同蜘蛛所携带细菌的组成及多样性,我们发现,活动范围广、接触环境复杂的星豹蛛(地表游猎型)的细菌群落组成差异较大,多样性最高,说明环境是影响蜘蛛菌群的重要因素;同处于灌木丛的4种功能群蜘蛛的细菌群落组成也存在一定差异,推测是蜘蛛猎取的食物不同造成的。总的来讲,本研究工作对进一步了解蜘蛛的细菌群落及其影响因素有参考价值,但其影响机制和细菌对蜘蛛的影响等方面还有待进一步研究。
