骨髓间充质干细胞联合纳米羟基磷灰石胶原蛋白复合支架修复兔节段性骨缺损的实验研究*
2022-09-13吴启润周东明吕晓峰段文禹王孟辉高岩
吴启润 周东明 吕晓峰 段文禹 王孟辉 高岩
四肢长骨节段性骨缺损的修复一直是临床治疗的难题[1]。临床上,传统治疗方法具有一定的缺点如自体骨移植易造成二次损伤、感染;异体骨移植存在疾病传播风险、骨愈合缓慢及免疫排斥等[2-3]。而通过膜引导下骨再生技术是治疗节段性骨缺损的一种新思路和新方法[4-5]。但目前制备的膜管生物力学强度不高,不足以保持相应的膜管下容积,活动后导致膜管移位、变形,影响膜下新骨形成、重塑,从而限制了其临床应用[6-7]。Ilizarov 技术通过牵张作用治疗骨缺损,但该方法产生钉道感染、过程痛苦,且对患者心理健康产生不利影响[8],临床上尚无有效方法治疗长段骨缺损。
近年,探索引导性骨再生材料修复骨缺损已经成为骨科领域的一个研究热点。将纳米羟基磷灰石(nanometer hydroxyapatite,Nano-HA)与胶原蛋白以一定的方式复合以后得到类似自然骨骼的结构,可作为骨修复材料。纳米羟基磷灰石强度高,钙磷结构接近于自然骨骼,生物相容性好;Ⅰ型胶原蛋白具有免疫原性低,易降解等特点,同时它影响细胞的分化增殖,参与细胞代谢的多个过程,是保持细胞正常功能不可缺少的物质。骨髓间充质干细胞(bone marrow mesenchymal stem cells,BMSCs)能够多向诱导分化潜能,扩增能力强。本实验采用BMSCs 联合纳米羟基磷灰石胶原蛋白(Nano-HA/COL)复合支架,植入兔骨缺损处,观察其修复效果。
1 材料与方法
1.1 主要仪器和试剂 LIVE/DEAD 染色试剂盒(美国Life Technologies 公司);注射用青霉素钠(生产厂家:山东圣旺药业股份有限公司,批准文号:兽药字150061248,规格:160 万单位/支);超低温冰箱(Hermo Fisher Scientific 公司);戊二醛消毒熏箱(江苏泰州宏泰实验设备厂);流式细胞仪(美国Beckman Coulter 公司);胎牛血清(FBS)(美国Gibico 公司);PBS 缓冲液(美国 Hyclone 公司);1 mL 一次性注射器(山东威高股份有限公司);Ⅰ型胶原蛋白(苏州天可贸易有限公司);二氧化碳孵育箱(美国Thermo Fisher 公司)。
1.2 实验动物 国产家兔30 只[2 月龄,体重2~2.5 kg,不限雌雄,由包头医学院动物实验中心提供动物许可证:SCXK(蒙)2014-0003]。实验操作在包头医学院动物实验中心进行,实验过程通过包头医学院第一附属医院医学伦理委员会审批(编号20210011)。
1.3 方法
1.3.1 纳米羟基磷灰石胶原蛋白复合支架的制备 将Nano-HA 微粒(40 nm)与聚乙烯亚胺按3︰2比例混合制成凝胶,凝胶与1%发泡剂聚氧乙烯十二烷基醚混合直至泡沫状,加入交联剂凝固。倒入管状模具待HA 凝胶成型后取出,冷冻干燥并在1 200 ℃下热凝结成HA 管。称取450 mgⅠ型胶原蛋白放入50 mL 的0.50 mol/L 醋酸溶液,搅拌使溶质充分溶解后经1 mol/L 的NaOH 使pH 值接近7。将制备的HA 管置入溶液后冷冻4 h,移入冷冻干燥机中,UV 射线照射支架可制得已干燥成型的纳米“羟基磷灰石-胶原蛋白”管状支架材料。大体外观及电镜下微观结构见图1。

图1 纳米“羟基磷灰石-胶原蛋白”管状支架材料
1.3.2 家兔骨髓间充质干细胞分离培养 10% 水合氯醛2.5~3 mL/kg 腹腔注射麻醉,常规髂区备皮、消毒、铺巾。16 号骨穿针接10 mL 注射器(含稀释的肝素钠)在髂骨穿刺获得红骨髓5 mL,注射入适量的L-DMEM 培养基中,以200 目滤网滤过后,置于转速离心机离心8 min 去上清液,用L-DMEM培养液悬浮沉淀,制成单细胞悬液。细胞按1×108/L 浓度接种培养瓶中,于37 ℃、5%CO2条件下培养。定量换液,待细胞生长到90% 时用0.25% 胰蛋白酶消化。镜下观察细胞相互分离后停止消化,按1×106/L 浓度接种,传代培养,镜下观察。见图2。

图2 倒置相差显微镜下兔BMSCs形态(P3×10)
1.3.3 兔骨髓间充质干细胞(BMSCs)表面抗原的检测 取P3 代的BMSCs,浓度为1×109/L 置于离心机中,离心5 min 去上清液,加PBS 缓冲液吹打均匀,取细胞悬液至EP 管,分别加入适量CD29、CD34、CD44、CD166 抗体,避光下孵育30 min,PBS 缓冲液去除未结合抗体,离心机离心5 min 后去除上清液,每管加PBS 缓冲液后检测。
1.3.4 骨髓间充质干细胞接种纳米羟基磷灰石胶原蛋白支架 纳米羟基磷灰石胶原蛋白支架浸泡于适量DMEM 培养液后呈胶状,环氧乙烷消毒。取P3代BMSCs 悬液与Nano-HA 凝胶振荡复合8 min,然后塑形为长16 mm、直径4 mm 的圆柱状,置CO2培养箱孵育2 h 备用。
1.3.5 活死细胞检测细胞活性 将接种BMSCs 的Nano-HA/COL 支架用LIVE/DEAD 细胞染色试剂进行染色,在高倍荧光显微镜下观察。
1.3.6 实验分组及兔双侧尺骨缺损模型的建立 取家兔30 只,2 月龄,体重2~2.5 kg,随机分为空白组、单纯支架组、实验组,每组10 只。每只家兔水合氯醛腹腔注射麻醉,无菌条件下暴露双侧前臂尺骨,在尺骨骨干中段制成16 mm 节段性骨缺损,见图3A。空白组不植入材料;单纯支架组植入Nano-HA/COL 支架,见图3B;实验组植入BMSCs复合的Nano-HA/COL 支架,逐层缝合伤口,见图3C、图3D;各组均不做内外固定。术后每日观察动物情况并肌注青霉素40×104U/d,共3 d。每组术后8、12 周空气栓塞处死5 只兔子获取尺骨局部标本进行大体标本观察和组织染色,判断各组骨缺损修复情况。
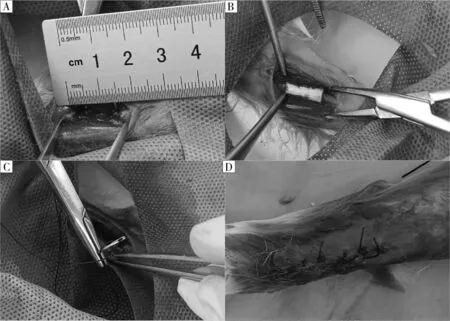
图3 尺骨缺损模型的建立
1.4 观察指标及判定标准
1.4.1 大体形态观察 观察所有家兔术后活动、饮食、伤口愈合情况,取双侧尺骨标本观察其大体形态、材料表面吸收的情况、缺损处修复情况。
1.4.2 X 射线观察 分别于术后8、12 周对每组动物进行手术部位X 射线检查,根据Lane-Sandhu X射线评分标准进行评分[9],见表1。

表1 Lane-Sandhu X射线评分标准
1.4.3 组织形态学分析 获取兔双侧尺骨缺损包括正常骨端5 mm 的部位标本,经甲醛固定、脱钙、乙醇脱水,石蜡包埋后切片,行HE 染色。
1.5 统计学处理 采用SPSS 17.0 统计软件分析,计量资料用()表示,多组之间采用单因素方差分析,以P<0.05 为差异有统计学意义。
2 结果
2.1 骨髓间充质干细胞在纳米羟基磷灰石胶原蛋白支架上的细胞活力 将BMSCs 与Nano-HA/COL 支架复合后进行LIVE/DEAD 染色,观察到细胞均匀分布于支架材料中,多数细胞均呈现绿色荧光(活细胞),见图4。

图4 BMSCs在Nano-HA/COL支架上的细胞活力(×200)
2.2 大体标本形态观察 术后家兔进食及活动正常,切口无发红、肿胀等炎症反应。术后8 周时:空白组骨缺损骨面清晰,两端骨质硬化,新骨形成少,骨缺损未能修复;单纯支架组填充材料少量降解,材料与骨分界较清楚;实验组填充材料部分降解,与骨界面较模糊,可见少量骨痂形成,与宿主骨组织结合紧密。术后12 周时:空白组骨缺损骨面清晰,可见少量新骨形成,比术后8 周时明显;单纯支架组植入材料基本降解,骨缺损部分修复,缺损区见大部分骨痂组织,断端处模糊;实验组植入材料明显降解,骨痂形成进一步增多,与宿主骨组织结合紧密,材料与宿主骨基本融合,骨皮质连续,骨缺损大部分修复。见图5。

图5 术后大体形态观察
2.3 X 射线检查 根据Lane-Sandhu X 射线评分标准来评估骨形成评分,取其平均值作为结果统计,术后8 周每组双侧尺标本个数为20,术后12 周每组双侧尺标本个数为10。术后8、12 周,实验组X 射线骨形成评分均高于空白组和单纯支架组,且单纯支架组均高于空白组,差异均有统计学意义(P<0.05),见表2。术后8 周:空白组骨缺损两端有无骨痂形成,髓腔未通,可见明显骨缺损,并无骨性连接,见图6A;单纯支架组填充材料与宿主骨分界清楚,见图6B;实验组材料密度高于宿主骨密度,材料填充处有明显钙化影并与宿主骨分界清楚,见图6C。术后12 周:空白组骨缺损区两端髓腔未通,断端形成少量骨痂,骨缺损周围高密度略高,无骨性连接见图6D;单纯支架组和实验组,材料与宿主骨之间无明显骨折界线见图6E;材料已溶解性吸收、髓腔再通,皮质骨连续,尤以实验组明显,见图6F。
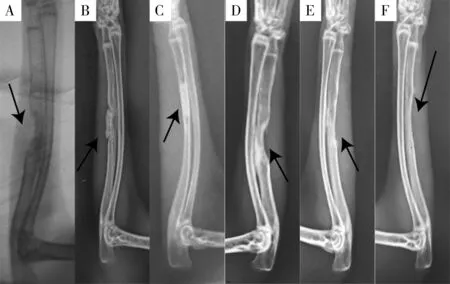
图6 X射线检查骨缺损处
表2 Lane-Sandhu X射线骨形成评分[分,()]

表2 Lane-Sandhu X射线骨形成评分[分,()]
*与空白组比较,P<0.01;#与单纯支架组比较,P<0.01。
2.4 组织形态学分析 术后8 周:空白组断端出现少量的骨基质,髓腔未通,见图7A;单纯支架组材料未降解,可见纤维肉芽组织,骨小梁形成,但排列混乱,见图7B;实验组材料大部分降解,骨缺损区可见骨小梁,可见新生骨组织形成,见图7C。术后12 周:空白组骨缺损区为纤维组织连接,少量的骨基质,髓腔封闭,少量骨小梁形成,排列混乱,骨缺损未修复,见图7D;单纯支架组,材料基本降解,纤维组织填充,见新生骨小梁形成,骨小梁排列混乱,可见髓腔脂肪组织,见图7E;实验组材料完全降解,骨缺损区可见少量纤维结缔组织,骨小梁较粗大,骨小梁排列有序,可见骨髓脂肪组织,髓腔再通,骨缺损基本修复,见图7F。

图7 骨缺损处HE染色(10×20)
3 讨论
骨缺损是临床中常见的损伤,临床上治疗骨缺损是依靠自体骨或同种异体骨移植[10]。髂嵴的祖细胞和生长因子丰富,移植取材方便,手术操作简单,成为移植骨的主要来源[11]。但是,自体骨取骨时会造成供体部位血管神经损伤、深部感染等严重并发症,同时,自体骨移植尚存在骨块尺寸、形状和数量的限制及骨块易发生移位、被吸收、脱出等问题。目前,骨组织工程支架修复节段性骨缺损是一种创新方法[12]。骨组织工程通过生物材料、细胞和细胞因子的组合来促进骨缺损的修复,支架起着核心作用,它们不仅为细胞生长提供空间结构,还能够促进新组织向特定结构生长[13-14]。Nano-HA 是骨组织工程中常用细胞载体基质材料,它溶解度高,抗疲劳、抗拉伸能力强,同时具有类似天然骨的多孔结构,很适合作为移植载体使用[15]。BMSCs 在基因工程、骨组织工程中的应用价值得到广泛关注[16-17]。BMSCs 增殖能力强、可多向诱导分化[18]。随后大量的实验及临床研究证实了BMSCs 结合支架材料治疗骨缺损的可行性[19]。
本研究制作兔尺骨中段16 mm 的骨缺损模型,不保留骨膜的全段骨缺损,排除骨膜对成骨的影响,这使得实验更充分体现复合支架的成骨性能。LIVE/DEAD 染色结果表明:兔BMSCs 与Nano-HA/COL 支架复合后,大部分呈绿色荧光,表明细胞基本能够存活,细胞与材料之间存在良好的生物相容性;术后家兔进食及活动正常,切口无发红、肿胀、渗液等炎症征象,无呕吐、厌食,表明了实验材料的生物相容性好。实验结果表明,X 射线检查中在相同时间段内空白组骨缺损区两端髓腔未通,骨缺损周围密度略高,无骨性连接。单纯支架组材料与宿主骨之间无明显骨折界线,材料已溶解性吸收、髓腔相通。实验组材料几乎完全溶解性吸收、皮质连续,骨缺损大部分修复。根据表2 术后8、12 周Lane-Sandhu X 射线评分:实验组>单纯支架组>空白组,差异均有统计学意义(P<0.05),可视为实验组修复效果优于单纯支架组、空白组。组织学检测中,在相同时间段内空白组骨缺损区为纤维组织连接,少量的骨基质及钙盐沉积,无连续的新生骨形成。单纯支架组植入材料进一步降解,骨缺损区可见少量纤维结缔组织,新生骨小梁形成,髓腔再通,骨缺损基本修复,但骨修复实验组较为明显。总之,通过术后的X 射线摄片、大体观察、组织学检查方面,观察到在相同时间段内,植入BMSCs 复合的Nano-HA/COL 支架的家兔观察指标的结果均要好于单纯植入Nano-HA/COL 支架和不植入任何材料的家兔,并且单纯植入纳米羟基磷灰石胶原蛋白支架的家兔骨修复作用要好于不植入材料。说明了纳米羟基磷灰石复合胶原蛋白具有良好的骨传导和骨诱导作用。这两种材料组成的复合骨可以作为一种新型的骨缺损修复材料。
本实验骨缺损的修复主要有以下方面:Nano-HA/COL 支架联合BMSCs 具备了良好的成骨活性:纳米羟基磷灰石(nHA)化学成分和表面特性影响着细胞的生存、附着、迁移分化和增殖[20];互通的多孔系统是骨支架材料的重要参数:纳米羟基磷灰石胶原蛋白支架为圆柱状立体结构,内部有连通的三维结构,孔隙率为(70±15)%,孔径为500~600 μm,孔隙连通率为99%,促进成骨细胞的长入,有利于周围的细胞因子的附着和增生,逐渐分化为新骨组织,同时纳米羟基磷灰石逐渐分解,最终被新骨组织替代;良好的生物相容性:术后家兔进食、活动正常,切口无发红、肿胀等炎症反应。本实验结果表明Nano-HA 及其复合材料与BMSCs 具有显著的成骨作用,为重建骨缺损及临床应用提供了实验依据。但迄今为止,达到组织工程支架材料要求的理想的组织工程化产品还有许多问题需要探索和解决,组织工程化骨的构建还需进一步研究。
