自体富血小板凝胶联合脂肪干细胞促进糖尿病足大鼠创面修复的机制研究*
2022-09-13冯召岚盛健健董爱武李江雄曹玲玲
冯召岚 盛健健 董爱武 李江雄 曹玲玲
糖尿病足是糖尿病的严重并发症之一,患者足部溃烂,创伤难愈,严重时甚至导致截肢及死亡[1]。相关调查显示,约15%的糖尿病患者遭受足部溃烂的折磨,全球范围内每20 秒就有1 例因糖尿病而截肢的患者,而70%的截肢患者往往在5 年内死亡[2]。糖尿病足的高截肢率及高死亡率严重威胁患者生命安全,因此积极探究糖尿病感染性慢性创面的治疗,刻不容缓。富血小板(platelet-rich plasma,PRP)凝胶是静脉血梯度离心分离后,以氯化钙及牛凝血酶激活的产物,含有多种生长因子,有利于细胞增殖[3]。Elsaid 等[4]分别给予糖尿病足患者PRP 凝胶外敷及生理盐水处理,发现PRP 凝胶具有明显缩小患者足部溃疡面积的作用。秦新愿等[5]研究指出,PRP 局部注射在促进糖尿病足溃疡创面修复方面效果良好。脂肪干细胞(adipose-derived stem cells,ADSCs)具有分化为表皮细胞、血管内皮细胞的多向分化潜能,可有效促进创面愈合。此前,国内外多项研究证明,PRP 凝胶联合ADSCs 治疗皮肤创伤,效果明显[6-7]。但关于其治疗机制,研究甚少。本研究分析了磷脂酰肌醇3-激酶(phosphoinositide-3-kinase,PI3K)/ 蛋白激酶B(protein kinase B,Akt)信号通路在PRP 凝胶联合ADSCs 治疗糖尿病足中的作用,现汇报如下。
1 材料与方法
1.1 实验动物 78 只8 周龄清洁级雄性大鼠,体重200~240 g,购自上海美轩生物科技有限公司,合格证号:11400700197085。所有动物适应性饲养6 周,室温控制在20 ℃左右,湿度控制在60%~70%。本实验方案经医院伦理委员会审核批准,实验操作符合相关动物伦理学要求。
1.2 主要实验试剂及仪器 链脲佐菌素(streptozotocin,STZ,美国Sigmag),磷酸盐缓冲液(phosphate buffer solution,PBS,美国Hyclone),柠檬酸-柠檬酸钠缓冲液(上海如吉生物科技发展有限公司),胎牛血清(fetal bovine serum,FBS,阿根廷Natocor),苏木精-伊红染色剂(hematoxylin-eosin staining,HE,中国上海索莱宝),CD31 抗体(美国Abcam)、PI3K/Akt 抗体(美国Abcam),TRETrizol(美国Thermofisher),甘油醛-3-磷酸脱氢酶(GAPDH,中国上海生工),Primers(中国上海生 工),SYBR Premix Ex Taq™Ⅱ(日 本TaKaRa),PrimeScript™RT reagent Kit with gDNA Eraser(日 本TaKaRa),Ⅰ型胶原酶(美国Thermofisher),胰蛋白酶(中国上海生工),乙二胺四乙酸盐(ethylene diamine tetraacetie acid,EDTA,上海阿拉丁生化科技股份有限公司),DMEM/F12 培养基(美国Thermofisher),链霉素(上海阿拉丁生化科技股份有限公司),DAB 辣根过氧化物酶(上海阿拉丁生化科技股份有限公司),高糖高脂饲料(北京科澳协力饲料有限公司),配方为:猪胆盐0.3%,胆固醇1.5%,蔗糖20%,精炼猪油10%,普通饲料68.2%;高速离心机(3K15,德国SIGMA),Real Time PCR 仪(CFX96,美国BioRad),光学显微镜(DP71,日本Olympus),NanoDrop2000 超微量分光光度计(美国Thermofisher)。
1.3 方法
1.3.1 糖尿病足裸鼠模型的建立 78 只大鼠随机取15 只作为正常组,予以常规清洁级饲料。其余63 只予以高糖高脂饲料。喂养6 周后,禁食12 h,进行第一次STZ 腹腔注射,以0.1 mmol/L 的柠檬酸-柠檬酸钠缓冲液(pH 为4.4)配制为1%的STZ 注射液,现配现用,经滤过处理后,以150 mg/kg 进行腹腔注射。注射第3 天进行尾静脉取血,检测血糖水平(血糖≥16.7 mmol/L 为达标),标记不合格大鼠;于第7 周进行第二次STZ 腹腔注射,操作方法同前,注射第3 天检测尾静脉血糖;对于血糖升高不明显大鼠,于第8 周进行第3 次STZ 腹腔注射;剔除三次干预后,血糖含量仍不达标大鼠。
采用烫伤法建立糖尿病足与创伤模型:待糖尿病模型大鼠出现明显的热痛觉、触觉异常等神经病变症状时,采用烫伤板在大鼠后足的左侧做一5 mm×5 mm 的创伤,并将烫伤处浸入70 ℃的水中8 s,建立糖尿病足大鼠模型,使用硅胶板对创面边缘进行固定,防止创面过早愈合。本研究中63 只SD 大鼠,60 只糖尿病足模型建立成功,其中2 只血糖水平不达标,1 只因高血糖死亡。正常组大鼠也按照上述方法在后足左侧建立创伤模型。
1.3.2 PRP 凝胶的制备 采用改良Cascade-Esforax 法制备PRP 凝胶[8],使用Ca2+激活。采用7%(0.3 mL/100 g)水合氯醛(生产厂家:西安天正药用辅料有限公司,批准文号:国药准字H37022673,规格:500 g)腹腔注射麻醉大鼠,取5 mL 注射器,吸取0.3 mL 4%的枸橼酸钠抗凝剂(生产厂家:伊势久生物科技有限责任公司,批准文号:国药准字H20058912,规格:100 mL),注射器连接硬膜外管,于大鼠颈静脉处取3 mL 静脉血,以1 100 g 离心10 min;而后加入0.3 mL 的氯化钙(生产厂家:西宝生物科技股份有限公司,批准文号:AHD0004H,规格:500 g)50 mg/mL 以激活,静置后,中间淡黄色凝胶即为PRP 凝胶,留取备用。
1.3.3 ADSCs 的分离和培养 将实验大鼠进行腹腔麻醉后,取两侧腹股沟脂肪垫组织,用PBS 缓冲液反复冲洗后剪碎至靡状,0.2%Ⅰ型胶原酶恒温消化40 min,以基础培养基中和,1 500 r/min离心10 min,去除杂质及上清;沉淀混匀后采用200 目滤网过滤,以1 000 r/min 离心5 min,弃上清;采用含有10%FBS 的DMEM/F12 混悬细胞,按照2×104个/瓶接种于25 cm2培养瓶内;将原代细胞置于37 ℃,5% CO2及饱和恒温培养箱中,48 h 换液。待原代细胞融合至80%左右时开始传代:弃去原培养液以PBS 冲洗,采用0.25%胰蛋白酶+0.03%EDTA 进行消化;消化结束后吹打细胞,使其充分悬浮,以1 000 r/min 离心5 min,用含有10%胎牛血清及1%链霉素的DMEM 培养基重新悬浮细胞,按1︰3 比例进行传代,当传代细胞单层汇合达70%以上时可继续传代;留取生长良好的第3 代细胞,用于后续实验。
1.3.4 动物模型分组与创面干预 按照创面干预方式将60 只建模成功的大鼠分为模型对照组、PRP组、ADSCs 组、PRP+ADSCs 组各15 只。正常组、模型对照组创面滴加0.2 mL 生理盐水;PRP 组创面滴加PRP 凝胶0.2 mL;ADSCs 组创面滴加ADSCs 0.2 mL(2×104个细胞/mL);PRP+ADSCs 组滴加ADSCs-PRP 复合物0.2 mL(2×104个细胞/mL)。
1.3.5 RT-PCT 检测PI3K、Akt mRNA 的表达 分别于创伤后3、7、10、14 d 时,每组随机取3 只大鼠,观察其创面恢复情况。采用Trizol 法提取愈伤组织总RNA,运用NanoDrop2000 超微量分光光度计检测RNA 浓度和纯度(OD260/230约为2.2,OD260/280为1.8~2.2);采用反转录试剂盒(日本TaKaRa)制作cDNA 文库,配制10 μL 反应体系;采用iTaq™Universal SYBR®Green Supermix 荧光定量酶(上海生工)及RT-PCR 仪(美国,BioRad)进行PCR 扩增反应,采用3 步法扩增,参数设置:95 ℃ 30 s,95 ℃ 5 s;62℃ 30 s,72 ℃ 10 s,95 ℃10 s,45 个循环;溶解曲线为75 ℃ 60 s,95 ℃ 1 s。从PCT 仪中导出数据,采用2-△△Ct法计算目的基因的mRNA 相对表达水平,以GraphPad Prism 7.0绘制柱状图。以GAPDH 为内参基因,RT-PCR 引物序列见表1。

表1 RT-PCR引物序列表
1.3.6 组织标本的制备与处理 创伤后3、7、10、14 d,每组随机处死3 只大鼠,取愈伤组织为实验标本,采用4%甲醛固定,梯度脱水、浸蜡、包埋后制作成厚度为4 μm 的切片,行HE 染色。血小板-内皮细胞黏附分子(CD31)、PI3K、Akt 表达检测:分别采用相应的抗体共孵育后,滴加DAB辣根过氧化物酶显色后,采用HE 复染,梯度脱水,透明,风干后封片,采用PBS 为阴性对照,显微镜下阅片、分析。由2 名经验丰富的病理科医师进行阅片,随机选取光学显微镜下的5 个视野,记录CD31 细胞阳性表达率,视野下以细胞核和/或细胞质出现棕黄色颗粒为阳性;采用Image Pro Plus 6.0 软件处理免疫组化图片,计算光密度值(optical density,OD),取每张切片的5 个视野设为平均OD值,统计PI3K、Akt 表达OD 值。
1.4 观察指标及评价标准 观察各组大鼠干预3、7、10、14 d 时的创面愈合率,创面愈合率=(创面初始面积-未愈合面积)/创面初始面积×100%,统计各组创面愈合时间;免疫组化法检测各组干预3、7、10、14 d 时CD31 细胞阳性表达率及PI3K、Akt 蛋白表达OD 值;RT-PCT 检测各组干预3、7、10、14 d 时PI3K、Akt mRNA 表达水平。
1.5 统计学处理 运用SPSS 20.0 和GraphPad Prism 7.0 进行数据分析及图表绘制,各组不同时间点创面愈合率、PI3K、Akt 表达OD 值等计量资料采用均数±标准差()表示,组间比较采用方差分析,方差齐两两比较采用LSD 检验;P<0.05 表示差异有统计学意义。
2 结果
2.1 各组不同时间点创面愈合率及完全愈合时间比较 随着时间的延长,各组创面愈合率呈上升趋势,组间及时间点比较差异均有统计学意义(P<0.05),PRP+ADSCs 组、正常组干预3、7、10、14 d 时的创面愈合率均显著高于PRP 组、ADSCs 组及模型对照组(P<0.05),而PRP+ADSCs 组与正常组组间同时间点比较差异均无统计学意义(P>0.05);PRP+ADSCs 组、正常组的创面完全愈合时间显著早于PRP 组、ADSCs 组及模型对照组(P<0.05),而ADSCs 组和PRP 组创面愈合时间比较差异无统计学意义(P>0.05)。见表2。
表2 各组不同时间点创面愈合率及完全愈合时间比较()
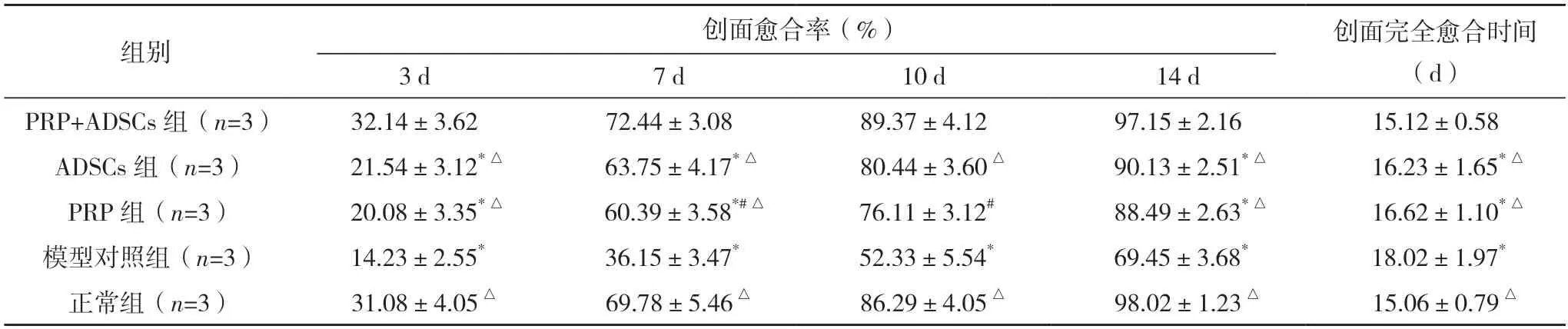
表2 各组不同时间点创面愈合率及完全愈合时间比较()
*与同时间点PRP+ADSCs 组及正常组比较,P<0.05;#与同时间点ADSCs 组比较,P<0.05;△与同时间点模型对照组比较,P<0.05。创面愈合率:F组间=525.400,P组间=0.001;F时间=3 705.000,P时间=0.001。创面完全愈合时间:F组间=10.181,P组间=0.001。
2.2 各组不同时间点CD31 细胞阳性表达率比较 随着时间的延长,各组间CD31 细胞阳性表达率呈上升趋势,组间及时间点比较差异有统计学意义(P<0.05);PRP+ADSCs 组、正常组干预3、7、10 及14 d 时的CD31 细胞阳性表达率均显著高于PRP 组、ADSCs 组及模型对照组(P<0.05)。见表3。
表3 各组不同时间点CD31细胞阳性表达率比较[%,()]

表3 各组不同时间点CD31细胞阳性表达率比较[%,()]
*与同时间点PRP+ADSCs 组及正常组比较,P<0.05;#与同时间点ADSCs 组比较,P<0.05;△与同时间点模型对照组比较,P<0.05。F组间=457.100,P组间=0.001;F时间=655.600,P时间=0.001。
2.3 各组不同时间点PI3K、Akt 表达OD 值比较 大鼠创伤组织PI3K、Akt 表达OD 值的组间及时间点比较差异均有统计学意义(P<0.05),其中PRP+ADSCs 组和正常组干预3、7 及10 d 时的PI3K、Akt 表达OD 值均显著高于PRP 组、ADSCs组及模型对照组(P<0.05),见表4。
表4 各组不同时间点PI3k、Akt蛋白表达OD值比较()

表4 各组不同时间点PI3k、Akt蛋白表达OD值比较()
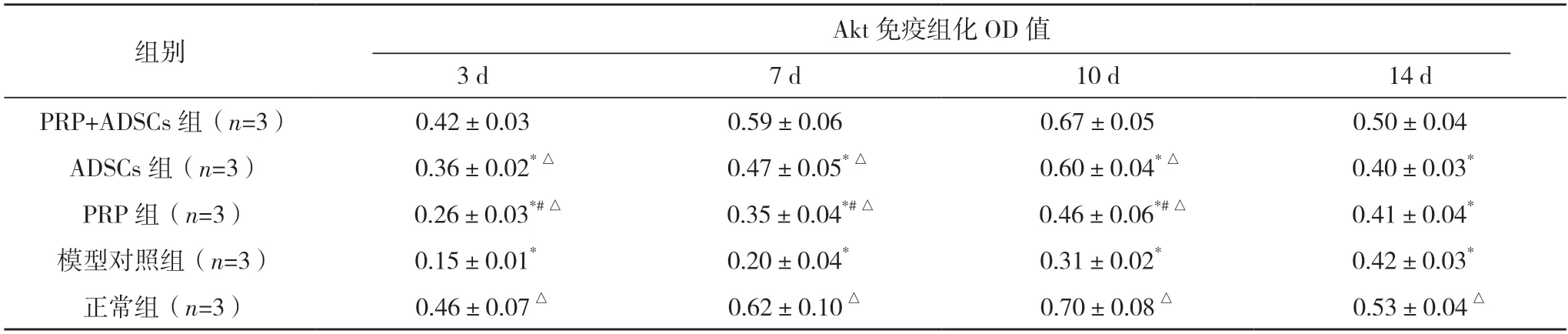
表4(续)
2.4 各组不同时间点愈创组织中PI3K、Akt mRNA相对表达情况比较 RT-PCR 数据分析显示,当将模型对照组设为单位一时,PRP+ADSCs 组、ADSCs组、PRP 组及正常组大鼠的PI3K、Akt mRNA 表达量出现显著上调,见表5。
表5 各组不同时间点愈创组织中PI3k、Akt mRNA相对表达量()

表5 各组不同时间点愈创组织中PI3k、Akt mRNA相对表达量()
3 讨论
糖尿病溃疡创面由于组织结构及细胞形态发生病理性改变,不利于创面肉芽组织生长,故难以愈合[9]。PRP 凝胶联合ADSCs 是目前治疗皮肤创面损伤的常用手段,PRP 凝胶可抑制血管病变,减轻炎症反应,ADSCs 可刺激真皮外基质胶原的合成,加快创面恢复[10]。PI3K/Akt 信号通路广泛存在多种细胞中,具有调控细胞生长、增殖、分化、凋亡等作用[11]。本研究通过CD31 细胞阳性表达率检测创面血管生成情况,通过免疫组化检测PI3K、Akt 蛋白表达水平,通过PT-PCR 检测PI3K、Akt mRNA 的相对表达量,以分析PRP 凝胶联合ADSCs 治疗糖尿病足治疗的可能机制。
本研究中分别给予各组实验鼠PRP 凝胶联合ADSCs、单独PRP 凝胶、单独ADSCs 等干预,结果显示,PRP+ADSCs 组创面愈合时间早于PRP 凝胶或ADSCs 单独使用组,早于模型对照组。说明给予糖尿病溃疡创面单一PRP 凝胶或ADSCs 干预均可有效促进创面修复,但二者联合效果更佳。分析原因,ADSCs 虽可分泌血管内皮生长因子、成纤维生长因子等多种促进病灶新生血管生长的有效成分。但单一的生长因子在促进细胞增殖及转移方面作用甚微,当多种细胞因子相结合时才可发挥效用[12]。PRP 凝胶中的血小板衍生生长因子(platelet-derived growth factor,PDGF)、转化生长因 子-β(transforming growth factor β,TGF-β)等可调控ADSCs 的旁分泌作用,加速成纤维细胞的迁移和增殖,促进创面修复[13]。同时,PRP 凝胶还具有抑制创面感染的作用,其特有的纤维蛋白网络结构可为ADSCs 提供生物支架,有利于ADSCs 持续释放生长因子,促进局部微血管生成,增加血供,促进细胞外基质及胶原合成,增强创面上皮化能力[14]。PRP 凝胶与ADSCs 二者联合可相互协同,促进创面恢复。本研究还发现,随着时间的增长,各组间CD31 细胞阳性表达率明显升高,且PRP+ADSCs 组、正常组、PRP 组、ADSCs 组的表达率均显著高于模型对照组。CD31 在内皮细胞、嗜中性粒细胞及T 细胞亚群中广泛表达,是血管内皮相关的标志性蛋白[15]。CD31 阳性表达率的升高,进一步证明PRP 凝胶及ADSCs 干预有利于创面新生血管生成。
PI3K 是由催化亚基p110 和调节亚基p85 组成的二聚体蛋白,可分为Ⅰ型、Ⅱ型及Ⅲ型3 类,其中Ⅰ型PI3K 研究较为广泛,与肿瘤的发生发展密切相关[16]。PI3K 中的调节亚基p85 可与细胞表面的各类受体相互作用,引发自身构象改变,从而催化p110 激活PI3K;活化后的PI3K 可产生第二使信分子3,4,5-三磷酸磷脂酰肌醇,该信号分子可 与Akt 的Pleckstrin 同源性(pleckstrin homology,PH)结合域相结合,引发其蛋白构象改变,促进Ser473 和Thr308 位点的磷酸化;磷酸化蛋白激酶B(phosphorylated protein kinase B,p-Akt)可通过调控动物雷帕霉素靶蛋白(mammalian target of rapamycin,mTOR)、核转录因子(nuclear factor-κB,NF-κB)等下游靶基因,完成细胞增殖、分化、凋亡等生物过程[17]。本研究中免疫组化结果显示,干预3、7、10 d 时,各组PI3K、Akt 蛋白表达OD 值均明显升高,且PRP+ADSCs 组、ADSCs 组、PRP 组均显著高于模型对照组,说明PRP 凝胶及ADSCs 干预可有效激活PI3K/Akt 信号通路。RT-PCR mRNA表达分析显示,随着干预时间的延长,各组PI3K、Akt mRNA 表达水平呈上升趋势,干预14 d 时随着创面愈合率的增长,PI3K、Akt mRNA 表达量呈下降趋势,以PRP+ADSCs 及正常组最为显著,进一步证明PI3K/Akt 信号通路的激活是PRP 凝胶联合ADSCs 治疗糖尿病足的可能机制。Chen 等[18]研究指出,重组人血小板源性生长因子-BB(recombinant human platelet-derived growth facto,rhPDGF-BB)与人脂肪源性干细胞(human adipose-derived stem cells,hADSCs)可通过上调磷酸化磷脂酰肌醇3-激酶(p-PI3K)及p-Akt 水平以激活PI3K/Akt 信号通路,促进跟腱炎康复。
综上所述,自体PRP 凝胶联合ADSCs 在治疗糖尿病溃疡型创面方面效果良好,这可能与PI3K/Akt 信号通路的激活相关。另外,本研究还存在明显不足:仅对PI3K、Akt 的蛋白及mRNA 的表达情况进行探究,未分析PI3K/Akt 信号通路下游关键因子的表达情况;未采用LY294002 等PI3K/Akt 信号通路相关抑制剂进行对照研究,故实验结论说服力不足,期待后续实验中进一步完善。
