苯酞类化合物及其生物活性研究进展
2022-09-13杨雅琳
杨雅琳,冯 阳,陈 浩,许 敏
昆明理工大学生命科学与技术学院,昆明 650500
苯酞类化合物是指具有苯并五元内酯环母核结构的一类芳香酯类化合物。结构特征为邻羟甲基苯甲酸中的羟基和羧基发生分子内酰化反应失去一单位的水分子而形成苯并五元内酯环结构。苯酞类化合物广泛存在于伞形科植物中。此外,少量苯酞类化合物也分布于海桐花科、菊科、胡椒科和紫堇科植物。还有一部分苯酞类化合物分布在细菌、真菌等微生物的次生代谢产物中。苯酞类化合物极不稳定,易受光照和温度等因素的影响而使结构发生转化,这也是苯酞类化合物结构多样性的主要原因之一。根据苯酞化合物的结构特征,目前发现了简单苯酞类、聚合苯酞类和苯酞生物碱杂合体。简单苯酞类多为油状物,少量为晶体,且熔点较低,部分低极性苯酞类化合物能在挥发油提取物中检测到[1-3]。聚合苯酞类大部分容易结晶,且多是藁本内酯的聚合物或是藁本内酯和含有异喹啉骨架或含氮化合物的杂合体,根据聚合物的数量和类型又分为二聚、三聚、多聚苯酞及苯酞生物碱。苯酞类化合物具有多样的生物活性,如心脑血管活性、抗菌、抗肿瘤、抗炎、镇痛和杀虫等。尤其是近些年发现苯酞类化合物能够促进脑血管微循环和保护脑神经,具有预防和治疗阿尔茨海默症(AD)的潜在活性。例如,主要活性成分为丁基苯酞的恩必普胶囊具有改善缺血脑区管微循环、增加缺血区脑血流量和保护血脑屏障的作用,是治疗脑梗塞、脑血栓之后的神经功能缺失的重要临床药物,并且丁基苯酞联合高压氧能够提高老年血管性痴呆(VD)患者认知功能和生活能力[4-7]。因此,苯酞类化合物一直是研究热点之一。前期有文献对苯酞类化合物及其生物活性进行了总结[8-11],但是目前没有文献总结近五年苯酞类化合物的研究进展。因此,本文从来源、骨架特征及其生物活性等方面对2015至2021年期间苯酞类化合物的研究工作进行总结,以期为苯酞类化合物的开发和利用提供参考,尤其是苯酞类化合物在老年血管性痴呆方面的开发和利用。
1 苯酞类化合物的来源
天然苯酞类化合物主要来源于伞形科植物,是伞形科植物的特征成分[12-14]。其中苯酞类化合物在藁本属植物川芎(Ligusticumchuanxiong)和当归属植物当归(Angelicasinensis)中的含量最高。有趣的是,从当归中分离得到的一些三聚苯酞是由三个苯酞单体经两次[2π+2π]加成反应聚合而成[14-16]。同时,还有一些苯酞类化合物分布在海桐花科[17]、菊科[18]、紫堇科[19]和胡椒科[20]植物中。从海洋真菌月状旋孢腔菌(CochlioboluslunatusSCSIO41401)中分离得到的主要是C-3位二碳单位取代型苯酞,且多为乙基取代[21]。还有一些配糖化苯酞,主要分布在软珊瑚真菌拟盘多毛孢属Pestalotiopsissp.ZJ-2009-7-6[22]和菊科植物伞花蜡菊Helichrysummicrophyllum[23],以及川芎(L.chuanxiong)根茎中[24]。此外,有少部分苯酞类生物碱被报道[19,25],它们多数为苯酞异喹啉的杂合体,主要分布在紫堇科植物夏天无(Corydalisdecumbens)等药用植物中[25]。值得注意的是,近些年从地衣、细菌和真菌中发现的苯酞类化合物数量增加,且它们的侧链取代基团多样,有倍半萜和脂肪长链等[21,22,25,26]。由此可见,以地衣、细菌和真菌为样品分离纯化新颖苯酞类化合物将是一个比较有意义的研究课题。
2 苯酞类化合物的结构类型
迄今为止,已有超过400多个苯酞类化合物被报道,其中包括苯酞单体和苯酞聚合物[9]。苯酞单体通常在C-3被丁烯基、乙烯基、丙烯基、异丁烯基和正丁基等基团取代,同时偶有C-3未被取代型苯酞被报道。本文主要按苯酞单体化合物(C-3未被取代型、C-3取代型苯酞)和苯酞聚/杂合体(二聚苯酞、三聚苯酞、苯酞生物碱杂合物)结构类型,总结近五年苯酞类化合物的研究进展。
2.1 C-3未被取代型苯酞
C-3未被取代型苯酞(见图1、表1)主要分布在细菌和真菌中,还有一些分布在伞形科植物川芎(L.chuanxiong)、菊科植物美头火绒草(Leontopodiumcalocephalum)和胡椒科植物塔椒草(Peperomianivalis)中。其中,化合物19是苯酞芳香环在C-6通过C-C键与萜类杂合,而化合物20~22是苯酞芳香环在C-5通过醚键与萜类杂合而成,它们都属于萜类与苯酞的杂合体[26,27],该类结构较为新颖的苯酞为真菌中特征性成分。此外,亦有文献报道了C-3未被取代型苯酞配糖体,例如pestalotiolide A(17)[22]和6-O-β-(D-glucopyranosyl)-4-methoxy-1(3H)-benzofuranone(18)[23]在C-7被葡萄糖配糖化。

图1 C-3未被取代型苯酞的结构式

表1 C-3未被取代型苯酞类化合物
2.2 C-3取代型苯酞
自然界中存在的苯酞类化合物中,C-3取代型苯酞的数量所占比例最大,结构如图2、3和4所示,化合物名称和来源分别列于表2、3和4。C-3的取代基多为丁烯基、乙烯基、丙烯基、异丁烯基以及正丁基等。
2.2.1 C-3位二碳单位取代型苯酞
该类化合物以C-3位由两个碳原子单位组成的基团取代为其特征,如乙基、羟乙基和乙酸基等。同时,在苯环上的取代基团有甲氧基、羧基和羟基等。大多数的C-3位二碳单位取代型苯酞主要分布在真菌和细菌中,还有部分分布在海桐花科植物海金子(Pittosporumillicioides)中,详见图2和表2。

图2 C-3位二碳单位取代型苯酞的结构式

表2 C-3位二碳单位取代型苯酞
2.2.2 C-3位四碳单位取代型苯酞
C-3位四碳单位取代型苯酞是伞形科植物川芎的主要化学成分。该类化合物在C-3取代型苯酞中的占比最高,它们在C-3位由四个碳原子单位组成的基团取代,如正丁基、丁烯基和1-丁酮基等。同时,它们在苯环上的取代也较为多样。例如,从伞形科植物川芎中分离得到的丁烯基苯酞类化合物36~42在C-6或C-7位上通过醚键与不饱和脂肪长链连接[37]。正丁基苯酞类化合物43~53在不同的位置被糖基取代[24]。有趣的是,从川芎根茎分离出来的thiosenkyunolide A(32)和 thiosenkyunolide B(33)是罕见的含硫杂原子苯酞,其在苯环C-7上被含有硫原子的基团取代[24],详见图3和表3。

表3 C-3位四碳单位取代型苯酞

图3 C-3位四碳单位取代型苯酞的结构式
2.2.3 C-3位其它取代型苯酞
除了二碳和四碳单元外,在C-3位上还有甲基、甲氧基、羟基、苯基、长链烷基、羰基等取代基团。Daldinolide A(61)和 daldinolide B(62)在C-3被一分子苯基取代[41]。化合物70~80为苯酞倍半萜杂合体[25]。其中,fendlerin D(80)是唯一一个与两个倍半萜杂合的苯酞化合物[25]。化合物81~83在C-5位被苄基取代,而talaromycolide B(82)则是通过苄基形成的苯酞二聚体[42]。(±)-Neophathalide A(84)为[5,6]螺环苯酞衍生物[43]。(±)-Neophathalide B(85)是从川芎中分离出来的一对对应异构体[43],是具有苯并四元内酯环结构的新颖苯酞类化合物,详见图4和表4。
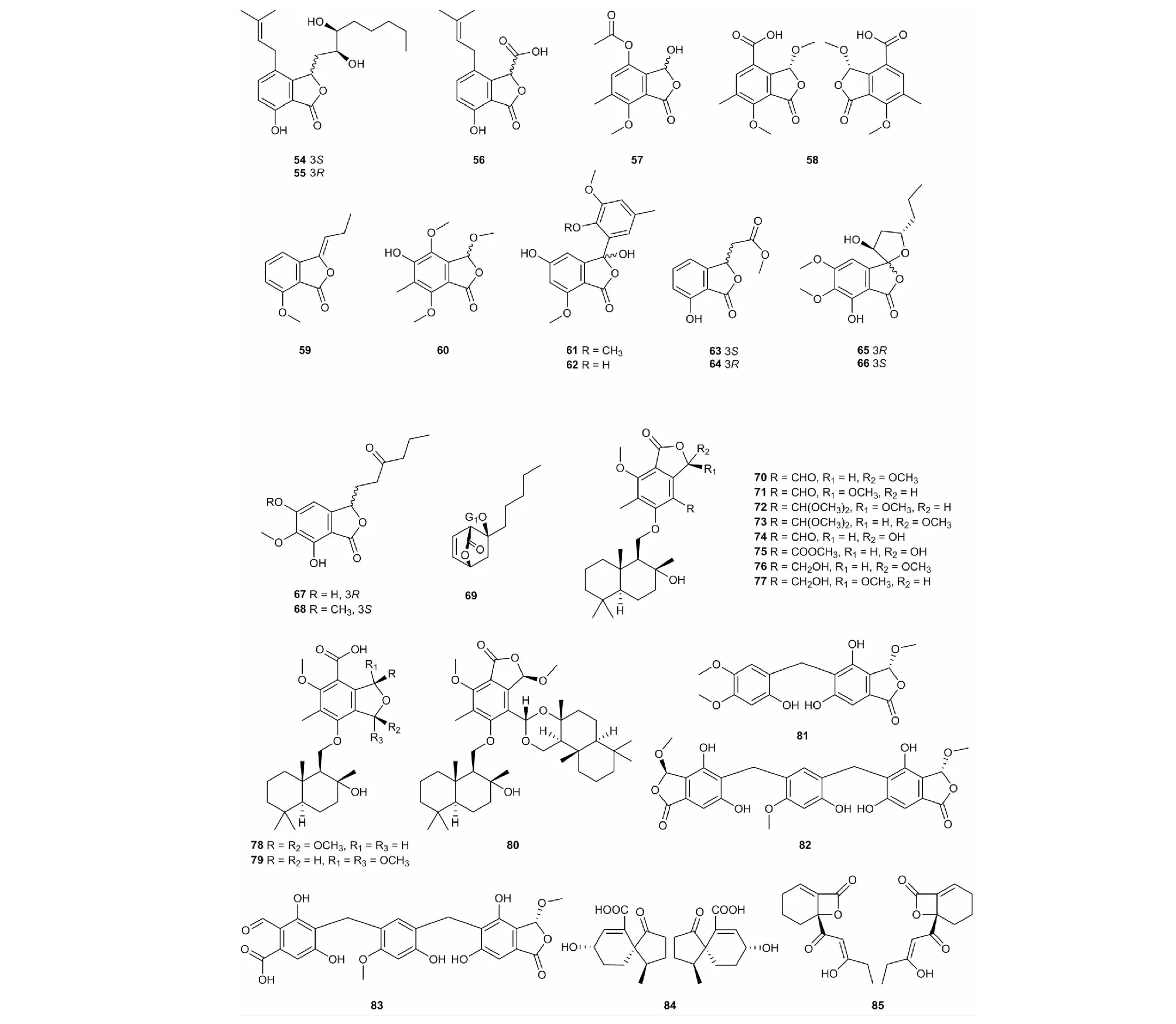
图4 C-3位其它取代型苯酞的结构式

表4 C-3位其它取代型苯酞
2.3 二聚型苯酞
近五年,越来越多的二聚型苯酞被报道。二聚型苯酞是由两分子苯酞单体聚合而成,且聚合方式分为[4π+2π]加成聚合以及[2π+2π]加成聚合,它们主要分布在伞形科植物川芎(L.chuanxiong)和当归(A.sinensis)中。二聚型苯酞和代表性聚合单体的结构如图5和6所示,化合物名称和来源分别列于表5和表6。
2.3.1 [4π+2π]加成聚合反应
Diels-Alder反应是最典型的[4π+2π]加成反应。而由[4π+2π]加成聚合反应生成的二聚型苯酞有5/6/6/6/5稠环骨架。Chuanxiongnolide L2(86)的聚合位置在C-7,4a和C-6′,7′,由蒿本内酯和扩环的苯酞单体聚合而成,而且它是第一个因E环扩环成为拥有5/6/6/6/6 稠环骨架的二聚型苯酞。Chuanxiongnolide L3(87)、chuanxiongnolide L4(88)和 chuanxiongnolide L5(89)在C-7,3a和C-6′,7′位通过双烯合成而形成一个有新六元环的二聚苯酞,这三个二聚型苯酞的生物合成路线可能是蒿本内酯和其它的苯酞单体化合物在C-7,3a和C-6′,7′位上通过[4π+2π]加成反应形成[13]。化合物90~92的聚合位置在C-3,8和C-6′,3′a,angesinenolide B(90)是唯一一个在C-6和C-3a上有过氧桥的聚合型苯酞[14]。化合物91是由E-丁烯基苯酞和蒿本内酯聚合而成,化合物92则是由Z-丁烯基苯酞与其它的苯酞单体化合物经[4π+2π]加成反应形成[49]。化合物93的聚合位置在C-6,3a和C-6′,7′,由蒿本内酯和其它的苯酞单体聚合而成[50],详见图5和表5。
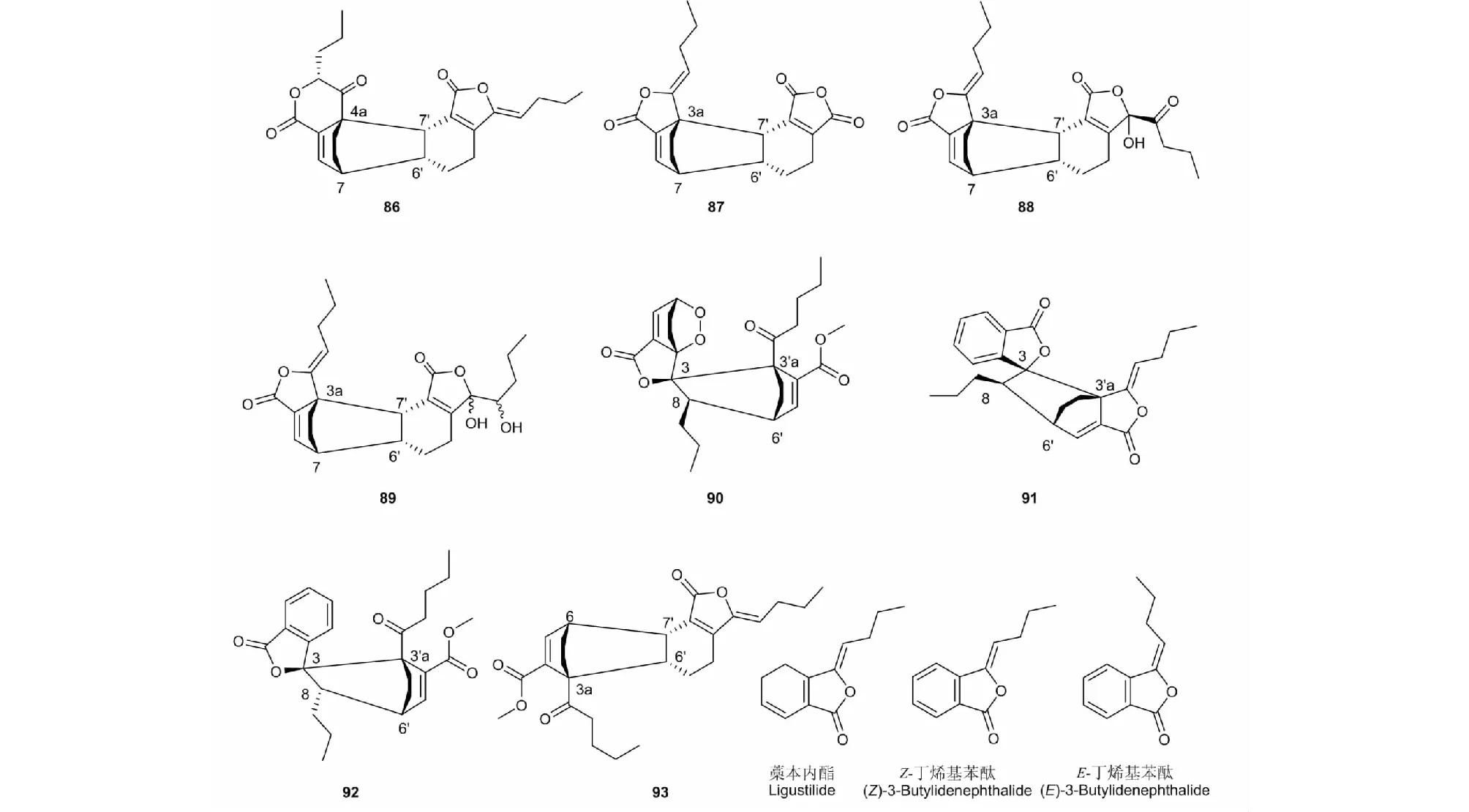
图5 [4π+2π]加成聚合反应型苯酞的结构式

表5 [4π+2π]加成聚合反应型苯酞
2.3.2 [2π+2π]加成聚合反应
两分子的单体苯酞化合物通过[2π+2π]加成聚合形成拥有5/6/4/6/5稠环骨架二聚体化合物。聚合位置都在C-7a,3a和C-7′,7′a的化合物有95~96和100~102。Chaxiongnolide C(95)、chaxiongnolide D(96)[51]和chuanxiongdiolide R5(102)[52]的构型不同,但聚合单体相同,分别是蒿本内酯和neocnidilide。Chuanxiongdiolide R4(100)的聚合单体是蒿本内酯和其它的苯酞单体[52]。Chuanxiongdiolide R6(101)的聚合单体是蒿本内酯和洋川芎内酯 A[53]。其它化合物的聚合位置分别在C-3a,7a和C-6′,7′、C-3,8和C-3a′,7a′、C-6,7和C-7′,7′a、C-3,8和C-6′,7′、C-3a,7a和C-7′,7′a,且聚合单体多数为蒿本内酯。这类化合物多数分布在伞形科植物川芎和当归,还有少部分分布在东当归(A.acutiloba)中,详见图6和表6。
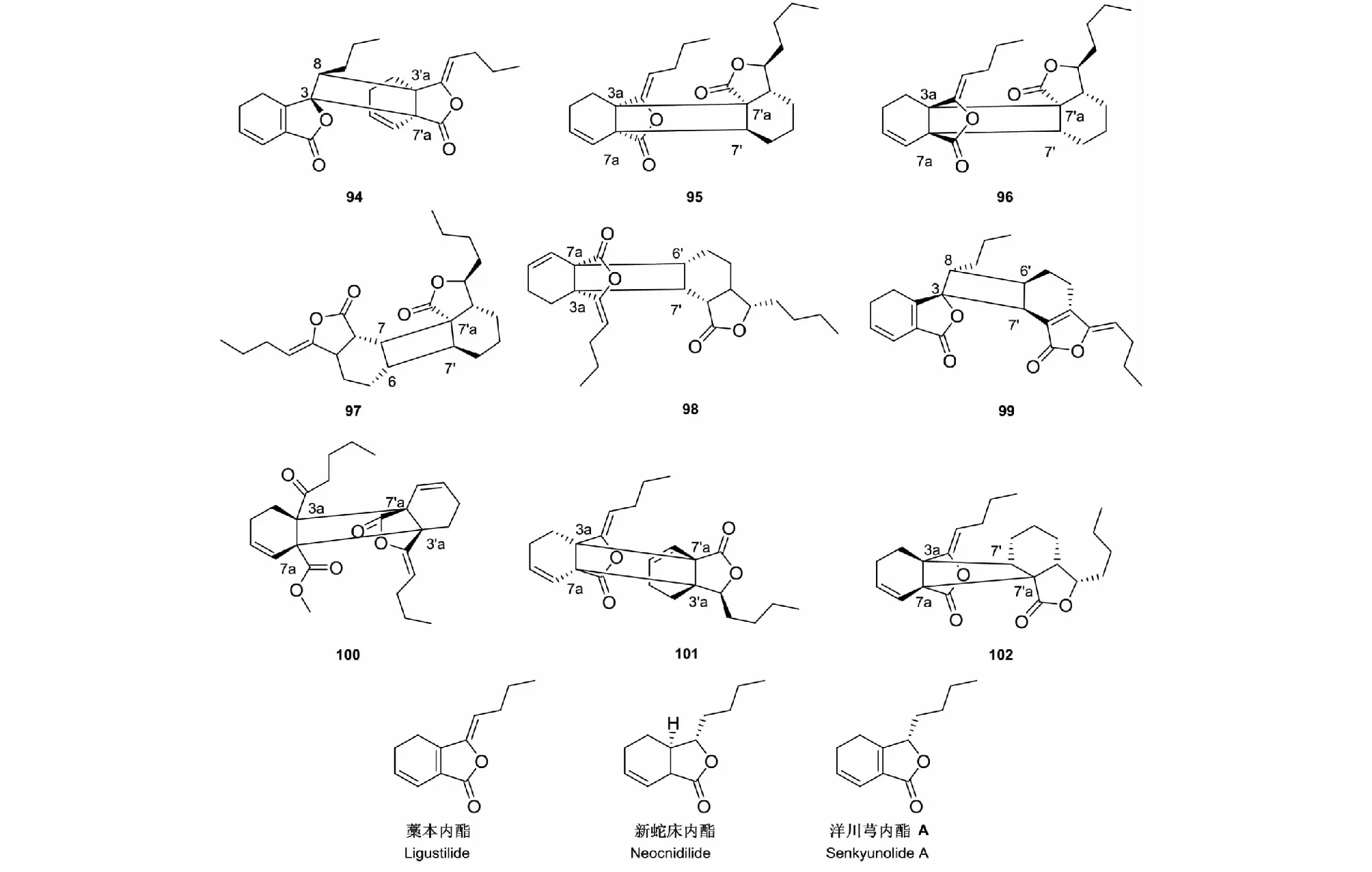
图6 [2π+2π]加成聚合反应型苯酞的结构式

表6 [2π+2π]加成聚合反应型苯酞
2.4 三聚型苯酞
三聚型苯酞化合物通常被认为是由三个苯酞单体通过[2π+2π]加成的方式聚合而成,它们主要分布在伞形科植物当归中,有些化合物聚合单体相同但是构型不同。例如,化合物triligustilide A(104)和triligustilide B(105)都是由三个藁本内酯分别在C-3a,7a和C-6′,7′、C-3′,8′和C-7′′,6′′位置聚合而成。两个化合物唯一不同的是triligustilide A(104)在C-7′′和C-6′′上的构型分别是R和S,而triligustilide B(105)与之相反[15]。化合物106~109的聚合单体都是蒿本内酯和丁基苯酞。Triangeliphthalide A(106)和 triangeliphthalide B(107)在C-3′′和C-8′′具有不同的构型[16],详见图7和表7。目前,从天然植物中分离鉴定的三聚型苯酞类化合物比较少,并且有关其结构特点和药理活性研究的文章更少,因此非常有必要对三聚苯酞类构效关系进行深入系统的研究。

图7 三聚苯酞的结构式

表7 三聚型苯酞类化合物
2.5 苯酞类生物碱
苯酞类生物碱主要分布在紫堇科植物夏天无(C.decumbens)的鳞茎中,还有少量分布在真菌H.fendleriBCC32408和炭球菌D.concentrica中。这类化合物主要涉及苯并吡咯烷酮骨架和苯酞异喹啉杂合体。例如,从真菌H.fendleriBCC32408分离得到的化合物110具有苯并吡咯烷酮骨架,且在苯环中通过醚键与倍半萜相连[25]。化合物111~112也有苯并吡咯烷酮骨架,在C-3位有苯基取代[41]。化合物113~118均为苯酞异喹啉杂合体[19]。苯酞异喹啉杂合体具有完整的四环骨架,它的结构特点主要是苯环和苯酞环各自取代基的差异以及苯酞环某位点构型的不同。如化合物113~118在C-7′位的取代基有羟基、甲氧基、乙氧基,同时化合物113、114和117在C-7′位构型为S,而化合物115、116和118在C-7′位构型为R[19],详见图8和表8。

图8 苯酞类生物碱的结构式

表8 苯酞类生物碱类化合物
3 苯酞类化合物的生物活性研究
苯酞类化合物具有多样的生物活性和药理作用,例如防治脑血管疾病、神经保护、抗肿瘤、抗菌、舒张血管、抗凝、杀虫、抗炎、抗病毒等。其中,苯酞单体类化合物对心脑血管疾病具有显著的药理活性,例如丁苯酞已经被研发为临床药物用于治疗脑梗塞、脑血栓以改善脑梗患者认知功能等疾病[54,55];藁本内酯对Aβ1-40诱导 PC-12 细胞损伤建立的阿尔茨海默症模型具有潜在的治疗作用[56]。
3.1 对脑血管疾病的作用
苯酞类化合物能够促进脑血管微循环和保护脑神经,具有预防和治疗脑血管疾病的潜在活性。其中,丁苯酞已经被开发为胶囊、注射液等多种剂型的药品,在临床中用于治疗脑梗塞、脑血栓等疾病。例如,丁苯酞注射液能够纠正分水岭脑梗死患者脑血流动力学异常,改善分水岭脑梗死患者症状[54],丁苯酞软胶囊能够有效地治疗急性前循环脑梗死患者,且安全性高[55]。丁苯酞联合尤瑞克林能够降低老年急性脑梗死患者神经功能缺损程度,有效调节血清Bcl-2和Caspase-3表达[57]。丁苯酞与舍曲林联合治疗急性脑梗死患者,能够改善急性脑梗死患者认知功能[58]。丁苯酞与奥拉西坦联合治疗急性脑梗死后认知功能障碍,改善患者认知功能,安全有效[59]。苯酞注射液联合巴曲酶[60]、丁苯酞联合阿托伐他汀[61]、丁苯酞软胶囊联合丹参川芎嗪[62]和丁苯酞氯化钠注射液联合脑心通胶囊[63]等都对治疗急性脑梗死患者有一定的效果。基于文献报道[64],S-(-)-丁苯酞对局灶性脑缺血再灌注老鼠细胞凋亡的作用比R-(-)-丁苯酞强。因此推测丁苯酞C-3位的构型对药物防治脑血管疾病活性有一定的影响。但是,丁基苯酞C-3位烷基取代的碳单位以及苯环上的取代基是否影响其防治脑血管疾病的效果仍缺乏系统的研究。另外有文献研究发现[65],苯酞二聚体舒张血管的活性比苯酞单体好以及苯酞类化合物中羟基取代位置对血管舒张活性有一定影响,并且该文献通过激光共聚焦实验推测苯酞类化合物具有血管舒张功能是影响离子通道开放进而抑制钙离子内流引起。
3.2 神经保护作用
化合物28具有抑制乙酰胆碱酯酶的活性(IC502.5 ± 0.2 μmol/L)[35]。Ligusticumside A(46)能提高因氧糖缺少引起神经毒性的SH-SY-5Y细胞的存活率,活性与阳性药丁基苯酞相当,而ligusticumside B(47)则显示出较弱的神经保护作用[24]。Corydecumine B、C和E~G(113、114、116~118)在体外大脑皮层神经元自发钙振荡模型中显示一定的神经保护活性,IC50数值分别为6.8、5.6、11.6、10.2、8.3 和3.1 μmol/L,这可能与C-7′的立体结构以及取代基有关,同时对神经元兴奋性的抑制作用表明,这些化合物可能对癫痫有潜在的治疗作用[19]。
3.3 抗肿瘤作用
5-(3′,3′-dimethylallyloxy)-7-hydroxy-6-methylphthalide(3)对乳腺癌细胞(MCF-7)有中等细胞毒性,IC50数值为29.0 μmol/L;对人肝癌细胞(SMMC-7721)有较强细胞毒性,IC50数值为1.8 μmol/L,推测C-7位上的羟基是活性基团[28]。Chaxiongnolide G(99)对人宫颈癌细胞(HELA)、腺癌人类肺泡基底上皮细胞(A549)、人盲肠腺癌细胞(HCT-8)、人肾癌细胞(KETR3)、人肝癌细胞(BEL-7402)、人口腔癌细胞(KB)、MCF-7和人胃腺癌细胞(BGC-823)细胞显示出具有不同程度的细胞毒活性,其中对 HELA细胞毒性最强[51]。
3.4 抗菌作用
5,7-Dimetoxy-6-(3-methylbut-2-enyl)-isobenzofuran-1(3H)-one(4)具有抗幽门螺杆菌(Helicobacterpylori)的作用(MIC 47.5 μmol/L)[20]。Biscogniphthalide B(14)显示出较弱的抗白色念珠菌FIM709(CandidaalbicansFIM709)的活性(MIC 128 μg/mL),而biscogniphthalide D(9)也显示出较弱的抑制黑曲霉R330(AspergillusnigerR330)活性(MIC 64 μg/mL)[31]。Farnesylemefuranone D(20)、farnesylemefuranone E(21)和farnesylemefuranone F(22)均显示出抑制创伤弧菌QDIO-4(VibriovulnificusQDIO-4)活性(MIC 4 μg/mL)。同时,化合物20和22抑制溶藻弧菌QDIO-7(V.alginolyticusQDIO-7)(MIC 4 μg/mL),化合物22抑制迟缓爱德华氏菌QDIO-8(EdwardsiellatardaQDIO-8)(MIC 4 μg/mL),这表明C-12′处取代基是活性位点,且乙酰氧基取代的化合物的抗菌活性比羟基取代的活性好[26]。(-)-3-Carboxypropyl-7-hydroxyphthalide(34)显示抗枯草杆菌(Bacillussubtilis)、痢疾志贺菌(Shigelladysenteriae)和产气肠杆菌(Enterobacterareogenes)的作用(MIC 12.5~25 μg/mL),(-)-3-carboxypropyl-7-hydroxyphthalide methyl ester(35)有抗E.areogenes的活性(MIC 12.5 μg/mL),C-4′上的羟基或甲氧基为助效团[39]。Fendleral A(70)、fendleral B(71)和fendleral C(74)对抗辣椒炭疽菌(Colletotrichumcapsici)(MIC 6.3~12.5 μg/mL)和蜡样芽孢杆菌(B.cereus)(MIC 1.6-3.1 μg/mL)有一定的抗菌活性[25]。同时,Fendleral A(70)和fendleral B(71)中C-11′位的立体中心以及C-6′的醛基对抗菌活性没有影响。而C-11′为R构型的fendleral C(74)具有抗蜡样芽孢杆菌和辣椒炭疽菌活性,C-11′为S构型的fendlerin A(72)没有抗蜡样芽孢杆菌和辣椒炭疽菌活性。与阳性对照药链霉素、氨苄西林以及左氧氟沙星相比,talaromycolide A(81)显示出很强的抗产气荚膜梭菌(Clostridiumperfringens)活性(MIC 12.5 μg/mL)和抗巨大芽孢杆菌(B.megaterium)活性(MIC 6.3 μg/mL)。同时,talaromycolide B(82)显示出比阳性对照药红霉素和氨苄西林更强的抗B.megaterium的活性(MIC 25 μg/mL),而talaromycolide C(83)显示出比阳性对照药红霉素、链霉素、四环素以及氨苄西林更强的抗C.perfringens活性(MIC 25 μg/mL)[42]。
3.5 舒张血管作用
Chuanxiongdiolide R4(100)和chuanxiongdiolide R5(102)显示出很强的舒张血管作用,作用机制可能与L型电压门控钙离子通道Cav1.2激活阻断有关[53]。
3.6 杀虫作用
5,7-Dimetoxy-6-(3-methylbut-2-enyl)-isobenzofuran-1(3H)-one(4)显示出较强的杀恶性疟原虫(Plasmodiumfalciparum)的作用,IC50数值为8.5 μmol/L[20]。
3.7 抗凝作用
Angesinenolide A(103)显示出潜在的抗凝活性,作用机制可能是抑制纤维蛋白的形成。Angesinenolide B(90)在内源性凝血通道阻止纤维蛋白的形成[14]。
3.8 抗病毒作用
Pestalotiolide A(17)显示出潜在的抗肠道病毒71(Ev71)的作用,IC50数值为27.7 μmol/L。C-6′ 位的乙酰氧基是活性基团[22]。
3.9 抗炎作用
Chuanxiongnolide L1(15)和chuanxiongnolide L2(86)对脂多糖诱导的RAW 264.7巨噬细胞产生的一氧化氮有抑制作用[13]。Triangeliphthalide C(108)对促炎细胞因子(IL-6)的产生有抑制作用。
4 结论
苯酞类化合物是次生代谢产物中一类重要而独特的骨架类型,具有广泛的药理活性,也是重要的中药和药物植物中主要的活性成分之一。例如中药当归具有补血活血、调经止痛、润肠通便等功效。而作为当归最主要的脂溶性有效组分,当归挥发油及其苯酞类化合物(藁本内酯、丁苯酞和丁烯基苯酞等)对降低血脂血压、抑制动脉粥样硬化、扩张血管、保护神经细胞、减轻脑梗死等与心脑血管平滑肌有关的疾病具有明显的药理活性。此外,中药川芎常被用于祛风止痛,活血行气。其中,苯酞类化合物(藁本内酯、洋川芎内酯 A和洋川芎内酯I等)是川芎的主要活性成分,具有抗动脉粥样硬化、保护受损的大脑神经以及增强药物在大脑吸收等药理活性,因此推测苯酞类化合物是川芎对神经系统疾病和心脑血管疾病具有显著调节作用的主要物质基础。
苯酞类化合物的化学性质非常活泼,该类分子能自身或与生物碱发生聚合,形成结构新颖的分子。近年来许多新骨架类型的苯酞类聚合体被陆续报道,推进了苯酞类分子的研究。苯酞类化合物对心脑血管疾病等多种疾病具有显著的活性,特别是对阿尔茨海默病具有潜在的治疗作用。然而,苯酞类分子的生源途径不清晰,聚合苯酞是天然产物还是人工产物尚不确定。此外,苯酞类化合物的构效关系研究不够系统和深入,特别是苯酞分子发生聚合后对活性的影响缺乏研究。迄今为止,也没有系统深入关于苯酞类化合物作用靶点和作用机理的阐述。因此,有必要以活性为导向,多学科交叉,对苯酞类化合物进行深入系统研究,从生源途径、构效关系、作用靶点和作用机制等多角度深入探索,为此类化合物的研究和开发提供科学依据,也为中药的现代化奠定基础。
