天山假狼毒的化学成分研究
2022-09-13何晓艳李小万邱远金石磊岭
何晓艳,李小万,邱远金,张 晶,石磊岭*
1吉林农业大学中药材学院,长春 130118;2新疆维吾尔自治区中药民族药研究所,乌鲁木齐 830002;3新疆农业职业技术学院生物科技分院,昌吉 83110
狼毒始载于《神农本草经》,其性平,味苦、辛,毒性较大;有祛痰、消积、止痛之功效[1],主要用于治疗水肿腹胀,痰食虫积,心腹疼痛,慢性气管炎,淋巴结核,疮癣等[2-5],但在临床使用中十分混乱,伪品较多,正品为瑞香狼毒[6]。天山假狼毒(Stelleropsistianschanica)为瑞香科的假狼毒属植物,与瑞香狼毒在种属上具有一定的亲缘关系,且共有成分较多,在新疆当地被用作中药狼毒伪品使用[7];其高15~30 cm,具有头状花序或极短的穗状花序,根茎木质,黄褐色或淡褐色;生长于海拔1 700~2 000 m的山坡草地,仅分布于我国新疆昭苏县和国外吉尔吉斯斯坦地区,由于独特的地理环境和生长区域使得人们对天山假狼毒的功效成分研究偏少[8,9]。如今从中分离得到的化合物主要有木脂素类、黄酮类、萜类和酚类等化学成分[10-12],但对其药理方面的研究报道还尚属空白。因此,为了进一步研究天山假狼毒的物质基础,本实验对其进行了化学成分研究,并对分离得到的化合物进行细胞毒活性测试,为天山假狼毒的开发利用提供参考。
1 材料与方法
1.1 仪器与材料
Bruker Avance III 600型核磁共振波谱仪(德国Bruker公司);赛默飞世(Thermo Fisher)LTQ-ObitrapX液质联用仪(美国Thermo Fisher公司);Lumtch-K-501半制备液相色谱仪(北京创新通恒有限公司);ZF-5型手提紫外分析仪(上海勤科分析仪器有限公司);RE-2000B型旋转蒸发仪(上海亚荣生化仪器厂);DLSB-5/10低温冷却液循环泵(郑州长城科工贸有限公司);柱色谱硅胶和薄层色谱用硅胶G、H、GF254(青岛海洋化工有限公司);HW-40C凝胶(Toyopearl公司);MCI(日本三菱化学公司);反相硅胶Lichroprep Rp-18(40~63 μm)(日本Daiso有限公司);常规试剂均为分析纯;娃哈哈水;人胃癌细胞株HGC-27(中国科学院上海细胞研究所);RPMI.1640培养基(江苏凯基生物技术有限公司);胎牛血清(美国Hyclone公司);MTT试剂盒(费德生物)。10%磷酸缓冲盐溶液(PBS)、0.25%胰蛋白酶-DETA消化液(北京索莱宝科技有限公司);细胞培养瓶、15 mL离心管(美国CORNING公司)。
天山假狼毒采于新疆昭苏县,经新疆中药民族药研究所贾晓光研究员鉴定为天山假狼毒StelleropsistianschanicaPobed.,凭证标本(20201022)保存在新疆维吾尔自治区中药民族药研究所标本室。
1.2 实验与方法
1.2.1 提取分离
取天山假狼毒根部10 kg,阴干,粉碎,用10倍量95%甲醇加热回流提取3次,每次3 h,合并提取液,回收溶剂,浓缩后得总浸膏2 861 g。总浸膏用水分散后,依次用二氯甲烷、乙酸乙酯各萃取3次,萃取液减压浓缩至干。最终得到二氯甲烷部位85 g,乙酸乙酯238 g,取二氯甲烷部位85 g经硅胶(100~200 目)柱色谱,石油醚-乙酸乙酯(1∶0→0∶1)梯度洗脱得5个流分Fr.1~5。Fr.4(4.7 g)用反相硅胶Lichroprep Rp-18(40~63 μm)柱色谱分离,甲醇-水(50%→100%甲醇)梯度洗脱得到5个组分Fr.4-1~Fr.4-5。Fr.4-2(2.3 g)再经反相材料柱色谱分离,洗脱液得到5个组分Fr.4-2-1~Fr.4-2-5。Fr.4-2-5(0.33 g)经HPLC(YMC-Pack ODS-A,250 mm×10 mm,5 μm,80%甲醇)分离纯化得化合物1(2.7 mg,tR=27 min)、2(4.2 mg,tR=31 min)。Fr.5(13.4 g)进行硅胶柱色谱分离,二氯甲烷-甲醇(1∶0→0∶1)梯度洗脱得5个组分Fr.5-1~5-5。Fr.5-1(0.1 g)析出黄色针状结晶化合物3(3.7 mg)。Fr.5-2(3.6 g)经HW-40C凝胶柱色谱分离,得到6个组分Fr.5-2-1~Fr.5-2-6。Fr.5-2-6(0.8 g)析出白色沉淀为化合物4(4.7 mg),Fr.5-2-2(0.68 g)经HPLC(YMC-Pack ODS-A,250 mm×10 mm,5 μm,80%甲醇)分离纯化得化合物5(5.3 mg,tR= 13 min)。Fr.5-2-3(0.45 g)经HPLC(YMC-Pack ODS-A,250 mm×10 mm,5 μm,45%甲醇)分离纯化得化合物6(2.1 mg,tR= 18 min)、7(1.8 mg,tR= 24 min)、8(3.7 mg,tR= 33 min)、9(3.2 mg,tR= 38 min)。Fr.5-3(4.3 g)经HW-40C凝胶柱色谱分离,得到5个组分Fr.5-3-1~Fr.5-3-5。Fr.5-3-2(0.38 g),经HPLC(YMC-Pack ODS-A,250 mm×10 mm,5 μm,80%甲醇)分离纯化得化合物10(7.2 mg,tR= 30 min)。Fr.5-3-3(0.62 g),经HPLC(YMC-Pack ODS-A,250 mm×10 mm,5 μm,35%甲醇)分离纯化得化合物11(4.3 mg,tR= 10.6 min)、12(2.6 mg,tR= 19 min)、13(3.8 mg,tR= 26 min)。Fr.5-4(2.6 g)经HW-40C凝胶柱色谱分离,得到4个组分Fr.5-4-1~Fr.5-4-4。Fr.5-4-3(0.41 g),经HPLC(YMC-Pack ODS-A,250 mm×10 mm,5 μm,33%甲醇)分离纯化得化合物14(4.3 mg,tR= 12 min)、15(2.6 mg,tR= 46 min)。
1.2.2 细胞毒活性筛选
取对数生长期的HGC-27胃癌细胞,PBS洗去培养液,用0.25%胰酶消化细胞1.5~2 min,终止消化,用细胞计数仪计数后,调整细胞浓度为4×105个/mL,然后每孔取100 μL接种于96孔培养板中,培养箱中恒温过夜,加入配置好的化合物1~15和阳性药DDP溶液继续培养48 h。然后每孔再加入配置好的MTT溶液(浓度为5 mg/mL),置于CO2培养箱37 ℃孵育,孵育4 h后弃去上清液。最后每孔加入150 μL DMSO,避光振荡10 min,用酶标仪检测。在570 nm检测波长下测定每个孔的OD值,计算不同浓度的药物对细胞的抑制率,平行重复3次。抑制率的计算公式为:抑制率=(OD对照-OD给药)/OD对照×100%。IC50值用Excel软件计算。
2 结果
2.1 结构鉴定
化合物1白色无定形粉末;10%浓硫酸-乙醇显红棕色;ESI-MS:m/z529.28[M+H],分子式为C30H40O8。1H NMR(600 MHz,CDCl3)δ:7.65(1H,s,H-1),6.70(1H,dd,J=10.8,4.8 Hz,H-3′),6.06(1H,dd,J=10.8,4.2 Hz,H-4′),5.85(1H,m,H-2′),5.72(1H,d,J=15.6 Hz,H-5′),5.03(1H,s,H-16a),4.92(1H,t,J=1.2 Hz,H-16b),4.43(1H,d,J=3.0 Hz,H-14),4.26(1H,s,H-5),3.89(1H,s,H-10),3.77~3.84(2H,m,H-20),3.46(1H,s,H-7),2.95(1H,d,J=2.4 Hz,H-8),2.50(1H,m,H-11),2.24(2H,m,H-12),2.09(2H,m,H-6′),1.81(3H,q,J=1.2 Hz,H-19),1.80(3H,s,H-17),1.38(2H,m,H-7′),1.20(3H,d,J=7.2 Hz,H-18),1.25~1.28(4H,m,H-8′、9′),0.88(3H,t,J=7.2 Hz,H-10′);13C NMR(150 MHz,CDCl3)δ:161.1(C-1),136.7(C-2),209.5(C-3),72.2(C-4),72.1(C-5),60.3(C-6),65.0(C-7),36.7(C-8),79.5(C-9),48.0(C-10),34.9(C-11),36.4(C-12),84.4(C-13),81.9(C-14),146.1(C-15),111.4(C-16),19.0(C-17),20.4(C-18),10.0(C-19),65.6(C-20),116.4(C-1′),122.7(C-2′),134.8(C-3′),128.8(C-4′),139.0(C-5′),32.7(C-6′),28.7(C-7′),31.3(C-8′),22.5(C-9′),14.1(C-10′)。以上数据与文献报道一致[13],故鉴定化合物1为excoecariatoxin。
化合物2白色无定形粉末;10%浓硫酸-乙醇显红棕色;ESI-MS:m/z545.27[M+H],分子式为C30H40O9。1H NMR(600 MHz,CDCl3)δ:7.60(1H,q,J=1.2 Hz,H-1),6.65(1H,dd,J=10.8,4.8 Hz,H-3′),6.03(1H,m,H-4′),5.84(1H,m,H-2′),5.65(1H,d,J=1.2 Hz,H-5′),5.11(1H,s,H-16a),5.09(1H,s,H-16b),4.73(1H,d,J=2.4 Hz,H-14),4.25(1H,s,H-5),3.90(2H,s,H-20),3.83(1H,d,J=3.0 Hz,H-10),3.78(1H,m,H-7),3.73(1H,d,J=2.4 Hz,H-12),3.53(1H,s,H-8),2.49(1H,m,H-11),2.10(2H,m,H-6′),1.88(3H,s,H-17),1.81(3H,s,H-19),1.38(2H,m,H-7′),1.25~1.28(4H,m,H-8′,9′),1.22(3H,d,J=7.2 Hz,H-18),0.88(3H,t,J=6.6 Hz,H-10′);13C NMR(150 MHz,CDCl3)δ:160.9(C-1),136.6(C-2),209.8(C-3),72.2(C-4),72.1(C-5),60.4(C-6),64.3(C-7),44.6(C-8),78.4(C-9),47.6(C-10),34.9(C-11),77.1(C-12),85.2(C-13),80.7(C-14),145.0(C-15),112.8(C-16),18.7(C-17),19.0(C-18),10.0(C-19),65.0(C-20),116.8(C-1′),128.6(C-2′),134.9(C-3′),131.0(C-4′),139.2(C-5′),32.7(C-6′),28.8(C-7′),31.3(C-8′),22.5(C-9′),14.1(C-10′)。以上数据与文献报道一致[14-15],故鉴定化合物2为12-羟基瑞香毒素。
化合物3黄色针状晶体;ESI-MS:m/z169.05[M+H],分子式为C8H8O4。1H NMR(600 MHz,CDCl3)δ:5.86(1H,s,H-3,6),3.83(3H,s,2×OMe);13C NMR(150 MHz,CDCl3)δ:187.1(C-1),157.3(C-2),107.5(C-3),56.6(2×OMe)。以上数据与文献报道一致[16],故鉴定化合物3为2,5-二甲氧基对苯醌。
化合物4白色粉末;在紫外灯光下显蓝色荧光;ESI-MS:m/z353.08[M+H],分子式为C19H12O7。1H NMR(600 MHz,CDCl3)δ:7.68(1H,d,J=9.6 Hz,H-4′),7.46(1H,d,J=9.0 Hz,H-4),7.42(1H,s,H-5′),7.00(2H,m,H-6′,8′),6.96(1H,d,J=2.4 Hz,H-8),6.84(1H,s,H-5),6.35(1H,d,J=9.0 Hz,H-3′),3.97(3H,s,OMe);13C NMR(150 MHz,CDCl3)δ:160.6(C-2),137.4(C-3),129.3(C-4),104.9(C-5),144.6(C-6),149.0(C-7),107.2(C-8),110.8(C-9),147.8(C-10),159.4(C-2′),114.8(C-3′),143.0(C-4′),129.2(C-5′),113.8(C-6′),157.3(C-7′),103.2(C-8′),114.9(C-9′),155.4(C-10′),56.5(C-OMe)。以上数据与文献报道一致[17],故鉴定化合物4为rutamontine。
化合物5黄色针状结晶;ESI-MS:m/z284.09[M+H],分子式为C16H13NO4。1H NMR(600 MHz,CDCl3)δ:9.42(1H,s,H-1),7.82(1H,s,H-4),7.44(1H,d,J=2.4 Hz,H-5),6.85(1H,d,J=2.4 Hz,H-7),4.03(3H,s,H-16),4.00(3H,s,H-17),2.75(3H,s,H-15);13C NMR(150 MHz,CDCl3)δ:149.7(C-1),164.2(C-3),117.4(C-4),103.4(C-5),164.9(C-6),105.4(C-7),162.7(C-8),180.5(C-9),183.4(C-10),136.9(C-11),115.6(C-12),137.5(C-13),125.4(C-14),25.0(C-15),56.1(C-16),56.6(C-17)。以上数据与文献报道一致[18],故鉴定化合物5为scorpinone。
化合物6无色油状物;ESI-MS:m/z213.12[M+H],分子式为C11H16O4。1H NMR(600 MHz,CDCl3)δ:6.43(2H,s,H-2,6),3.88(6H,s,2×OMe),3.69(2H,q,J=5.4 Hz,H-9),2.65(2H,t,J=7.8 Hz,H-7),1.88(2H,m,H-8);13C NMR(150 MHz,CDCl3)δ:132.9(C-1),146.9(C-3,5),132.7(C-4),104.9(C-2,6),32.2(C-7),34.75(C-8),62.3(C-9),56.5(2×OMe)。以上数据与文献报道一致[19],故鉴定化合物6为dihydrosyringenin。
化合物7白色粉末;ESI-MS:m/z164.09[M+H],分子式为C10H13NO。1H NMR(600MHz,CDCl3)δ:7.31~7.34(2H,t,J=7.8 Hz,H-2,6),7.23~7.25(1H,d,J=7.2 Hz,H-4),7.19~7.21(3H,d,J=7.2 Hz,H-3,5),3.52(2H,q,J=6.0 Hz,H-8),2.82(2H,t,J=6.6 Hz,H-7),1.95(3H,s,H-2′);13C NMR(150 MHz,CDCl3)δ:173.9(C=O),138.9(C-1),128.8(C-3,5),126.6(C-4),128.6(C-2,6),35.6(C-7),40.6(C-8),23.4(C-2′)。以上数据与文献报道一致[20],故鉴定化合物7为N-苯乙基乙酰胺。
化合物8棕色油状物;ESI-MS:m/z359.16[M+H],分子式为C20H22O6。1H NMR(600 MHz,CDCl3)δ:6.90(2H,s,H-2,2′),6.89(2H,s,H-5,5′),6.83(2H,dd,J=1.2,7.8 Hz,H-6,6′),5.61(2H,s,4,4′-OH),4.74(2H,d,J=4.2 Hz,H-7,7′),4.25(2H,m,H-9α,9′α),3.91(3H,s,2×OMe),3.87(2H,dd,J=3.6,9.0 Hz,H-9b,9′b),3.11(2H,m,H-8,8′);13C NMR(150 MHz,CDCl3)δ:132.9(C-1,1′),108.5(C-2,2′),146.6(C-3,3′),145.2(C-4,4′),114.2(C-5,5′),119.0(C-6,6′),85.9(C-7,7′),54.2(C-8,8′),71.7(C-9,9′)。以上数据与文献报道一致[21],故鉴定化合物8为松脂醇。
化合物9黄色油状物;ESI-MS:m/z359.14[M+H],分子式为C20H22O6。1H NMR(600 MHz,CDCl3)δ:6.83(2H,dd,J=4.2,7.8 Hz,H-5,5′),6.61(2H,m,H-2,2′),6.52(1H,dd,J=1.8,6.0 Hz,H-6),6.41(1H,d,J=1.2 Hz,H-6′),4.16(1H,dd,J=1.2,7.8 Hz,H-9′α),3.91(1H,dd,J=1.2,7.8 Hz,H-9′b),3.82(6H,d,OMe),2.97(2H,q,J=9.0 Hz,H-7),2.45~2.63(4H,m,H-7′,8,8′);13C NMR(150 MHz,CDCl3)δ:129.8(C-1),111.4(C-2),146.7(C-3),144.5(C-4),114.4(C-5),122.1(C-6),34.6(C-7),46.6(C-8),178.8(C-9),129.5(C-1′),110.9(C-2′),146.5(C-3′),144.3(C-4′),114.0(C-5′),121.3(C-6′),38.3(C-7′),41.0(C-8′),71.4(C-9′),55.8,55.7(2×OMe)。以上数据与文献报道一致[22],故鉴定化合物9为马台树脂醇。
化合物10白色无定形粉末;10%浓硫酸-乙醇显红棕色;ESI-MS:m/z547.29[M+H],分子式为C30H42O9。1H NMR(600 MHz,CDCl3)δ:7.66(1H,s,H-1),7.44(1H,m,H-3′),7.32(1H,dd,J=9.6,5.4 Hz,H-4′),6.21(1H,s,H-5′),5.92(1H,d,J=15 Hz,H-2′),5.13(1H,s,H-16a),5.08(1H,s,H-16b),4.26(1H,s,H-5),3.89(1H,m,H-14),3.79~3.89(2H,m,H-20),3.79(1H,d,J=1.2 Hz,H-7),3.65(1H,s,H-10),3.16(1H,s,H-8),2.51(1H,m,H-11),2.20(3H m,H-12a,6′),2.13(1H,m,H-12b),1.89(3H,s,H-17),1.78(3H,s,H-19),1.44(2H,m,H-7′),1.13(4H,m,H-8′,9′),1.05(3H,d,J=6.6 Hz,H-18),0.90(3H,s,H-10′);13C NMR(150 MHz,CDCl3)δ:162.3(C-1),134.7(C-2),209.5(C-3),79.5(C-4),70.5(C-5),62.0(C-6),63.5(C-7),37.5(C-8),72.4(C-9),49.8(C-10),39.1(C-11),37.7(C-12),74.0(C-13),77.8(C-14),145.7(C-15),114.1(C-16),9.9(C-17),18.2(C-18),19.0(C-19),65.2(C-20),167.5(C-1′),117.7(C-2′),147.4(C-3′),128.1(C-4′),146.8(C-5′),22.5(C-6′),33.1(C-7′),28.3(C-8′),31.3(C-9′),14.0(C-10′)。以上数据与文献报道一致[23],故鉴定化合物10为vesiculosin。
化合物11无色油状;ESI-MS:m/z259.10[M+H],分子式为C12H18O6。1H NMR(600 MHz,CDCl3)δ:6.55(2H,s,H-2,6),4.10(1H,d,J=8.4 Hz,H-7),3.90(6H,s,3-OMe,5-OMe),3.72(1H,m,H-8),3.55(1H,d,J=9.6 Hz,H-9a),3.35(1H,m,H-9b),3.27(3H,s,7-OMe);13C NMR(150 MHz,CDCl3)δ:128.7(C-1),103.9(C-2,6),147.2(C-3,5),134.6(C-4),84.5(C-7),75.6(C-8),62.4(C-9),56.4(3-OMe,5-OMe),56.7(7-OMe)。以上数据与文献报道一致[23],故鉴定化合物11为threo-8S-7-methoxysyringylglycerol。
化合物12白色粉末;ESI-MS:m/z211.15[M+H],分子式为C11H18N2O2。1H NMR(600 MHz,CDCl3)δ:5.75(1H,br s,NH),4.13(1H,t,J=7.8 Hz,H-9),4.02(1H,dd,J=3.6,6.0 Hz,H-6),3.57(2H,m,H-3),1.01(3H,d,J=6.6 Hz,H-12),0.96(3H,d,J=6.6 Hz,H-13);13C NMR(150 MHz,CDCl3)δ:170.0(C-1),45.5(C-3),22.8(C-4),28.1(C-5),59.0(C-6),166.1(C-7),53.3(C-9),38.6(C-10),24.7(C-11),21.2(C-12),23.4(C-13)。以上数据与文献报道一致[24],故鉴定化合物12为cyclo(D)-pro-(D)-leu。
化合物13白色无定形粉末;ESI-MS:m/z273.15[M+H],分子式为C13H20O6。1H NMR(600 MHz,CDCl3)δ:6.56(2H,s,H-2′,6′),4.21(1H,d,J=8.4 Hz,H-3),3.90(6H,s,2×OMe),3.70(2H,m,H-1),3.59(1H,m,H-2),3.37(2H,m,H-1"),1.09(3H,m,H-2");13C NMR(150 MHz,CDCl3)δ:62.4(C-1),75.4(C-2),82.6(C-3),129.4(C-1′),103.8(C-2′,6′),147.2(C-3′,5′),134.5(C-4′),56.4(C-7′,8′),64.4(C-1"),15.3(C-2")。以上数据与文献报道一致[25],故鉴定化合物13为threo-3-(4-hydroxy-3,5-dimethoxyphenyl)-3-ethoxypropane-1,2-diol。
化合物14白色无定形粉末;ESI-MS:m/z419.17[M+H],分子式为C22H26O8。1H NMR(600 MHz,DMSO-d6)δ:6.69(4H,m,H-2′,6′),4.71(2H,d,J=5.4 Hz,H-2,6),4.32(2H,dd,J=4.2,9.6 Hz,H-4b,8b),3.94(2H,m,H-4α,8α),3.74(12H,d,J=3.0 Hz,4×OMe),2.63(2H,m,H-1,5);13C NMR(150 MHz,DMSO-d6)δ:56.0(C-1,5),84.1(C-2,6),65.0(C-4,8),56.4(4×OMe),129.0(C-1′),107.2(C-2′,6′),148.2(C-3′,5′),133.6(C-4′)。以上数据与文献报道一致[26],故鉴定化合物14为(-)-丁香素脂酚。
化合物15黄色油状物;ESI-MS:m/z377.17[M+H],分子式为C20H24O7。1H NMR(600 MHz,DMSO-d6)δ:8.05(1H,br s,Ar-OH),7.05(1H,d,J=1.8 Hz,H-2),6.98(2H,m,H-2′,5′),6.87(1H,dd,J=1.8,6.6 Hz,H-6),6.76(1H,dd,J=1.8,6.6 Hz,H-5),6.70(1H,d,J=8.4 Hz,H-6′),6.45(1H,d,J=15.0 Hz,H-7′),6.26(1H,m,H-8′),5.32(1H,d,J=3.6 Hz,OH),4.85(1H,t,J=4.2 Hz,OH),4.72(1H,m,H-7),4.69(1H,m,OH),4.26(1H,m,H-8),4.10(2H,m,H-9′),3.80(3H,s,OMe),3.73(3H,s,OMe),3.58(1H,m,H-9b),3.24(1H,m,H-9a);13C NMR(150 MHz,DMSO-d6)δ:133.4(C-1),111.4(C-2),147.4(C-3),145.9(C-4),115.1(C-5),119.5(C-6),71.3(C-7),84.7(C-8),60.5(C-9),130.5(C-1′),110.1(C-2′),150.1(C-3′),148.3(C-4′),115.7(C-5′),119.4(C-6′),129.0(C-7′),129.1(C-8′),62.1(C-9′),55.8,56.0(2×OMe)。以上数据与文献报道一致[27],故鉴定化合物15为threo-1-(4-hydroxy-3-methoxyphenyl)-2-{4-[(E)-3-hydroxy-1-propenyl]-2-methoxyphenoxy}-1,3-propanediol。
化合物1~15结构见图1。
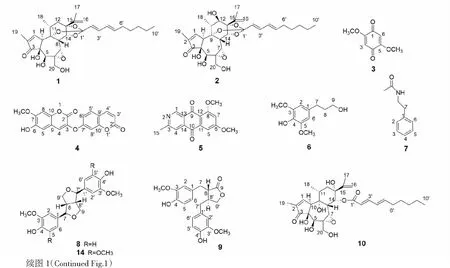
图1 化合物1~15的化学结构
2.2 体外细胞毒活性筛选
对天山假狼毒提取分离得到的15个化合物(50 μmol/L)进行抗肿瘤活性筛选,结果显示在50 μmol/L时,化合物1、2、3和10对HGC-27细胞株的抑制率依次为92.0%、86.8%、87.28%、76.34%,统计学分析显示P<0.05,与空白组相比具有显著差异,其对HGC-27细胞的IC50值分别为14.06、15.23、17.28、27.1 μmol/L(阳性对照药为顺铂,IC50值为8.9 μmol/L),表明化合物1、2、3和10对HGC-27细胞具有较强的抑制活性(见表1)。

表1 化合物1~15对HGC-27的细胞毒活性
3 结论
通过对天山假狼毒进行提取分离,共得到15个化合物,其中1~7、12~15均为首次从假狼毒属植物中分离得到,并对15个化合物进行抗肿瘤活性筛选,结果显示化合物1、2、3和10对HGC-27胃癌细胞具有一定的抑制活性。其中1、2、10为瑞香烷型二萜化合物,表明天山假狼毒中此类化合物可作为潜在的抗肿瘤药物。由于天山假狼毒在新疆偏远地区被作为狼毒的混淆品或伪品使用,但国内外对其研究文献报道并不多,且疗效机制研究也相对不足,因此我们通过研究,进一步丰富了天山假狼毒的化学成分库和抗肿瘤活性作用,为更好地开发利用该植物提供一定的理论基础。
