UPLC-QE-Orbitrap-MS/MS结合网络药理学和实验验证探讨西洋参治疗动脉粥样硬化的作用机制
2022-09-13张学建陶飞燕吴纯洁
何 林,彭 伟,张学建,陶飞燕*,吴纯洁*
1成都中医药大学药学院,成都 611137;2四川中烟工业有限责任公司,成都 610066
动脉粥样硬化(atherosclerosis,AS)是引发血管疾病的主要原因,其病变以动脉部分脂质沉积为特征,伴有平滑肌细胞和纤维基质增殖,逐渐发展为动脉粥样硬化斑块[1]。AS的临床表现包括缺血性心脏病、缺血性中风和外周血管病等[2]。AS的发病机制十分复杂,具有多种信号传导途径,实验和临床研究表明其可能与炎症、氧化应激、先天和适应性免疫、感染等有关。目前倾向于“损伤反应-炎症学说”,性质与炎症相似,但尚无定论[3,4]。
西洋参(Panacis Quinquefolii Radix)是五加科人参属植物的干燥根,含有丰富的人参皂苷[5]。研究表明,多种人参皂苷具有抗炎、免疫调节和保护心血管系统等药理活性[6]。西洋参传统干燥方式为烘干,但干燥后的成品表皮皱缩,颜色焦黄,质地坚硬,切片或粉碎困难。冷冻干燥(冻干)可在低温和真空下将物料脱水干燥。采用冷冻干燥制备的西洋参(freeze-drying Panacis Quinquefolii Radix,FDPQ)表皮平整,颜色鲜亮,质地疏松,复水性好,服用方便,脱水彻底,易于贮藏和运输。此外,FDPQ中人参皂苷Rg1、Re、Rb1的含量总和亦显著高于烘干西洋参[7]。综上,FDPQ在外观品相和内在成分上较烘干西洋参均有优势,具有广阔的市场前景。
课题组前期研究发现,FDPQ可改善动脉粥样硬化小鼠氧化应激损伤,减少主动脉弓部位粥样斑块以及脂质沉积,但机制尚不明确。网络药理学可从系统层面揭示药物对机体的调控作用,为研究中药成分与疾病之间的相互关系提供新的思路[8]。本文拟采用UPLC-QE-Orbitrap-MS/MS技术结合网络药理学和分子对接的方法,探索FDPQ治疗AS的药效物质、作用靶点和潜在通路,并辅以细胞实验进行初步验证,以期为进一步开展相关实验,研究作用机制奠定基础。实验流程设计如图1所示。

图1 研究设计的详细流程图
1 材料和方法
1.1 FDPQ的制备
鲜西洋参从中国吉林省靖宇县购买,由成都中医药大学吴纯洁教授鉴定为五加科人参属植物西洋参(PanaxquinquefoliumL.)的根。将鲜西洋参冷冻干燥,粉碎后过50目分析筛(孔径为0.355 mm)。冷冻干燥工艺:-80 ℃预冻2 h后入仓,真空度抽至10 Pa,温度由-50 ℃升至20 ℃,维持32 h。
1.2 皂苷类成分鉴定
1.2.1 试剂试药
色谱纯甲醇和乙腈购自美国Thermo Fisher Scientific;甲醇、甲酸等分析纯试剂购自成都市科隆化学品有限公司。
1.2.2 供试品溶液制备
精密称取FDPQ粉末1.0 g置具塞锥形瓶中,加入80%甲醇30 mL,超声提取60 min,过滤,取续滤液过0.22 μm微孔滤膜,即得。
1.2.3 UPLC-Q Exactive Orbitrap-MS分析
色谱条件:色谱柱为Thermo ScientificTMAccucoreTMC18(3 mm×100 mm,2.6 μm);流速:0.35 mL/min;柱温:35 ℃;进样量:5 μL;流动相A为0.1%甲酸-乙腈,流动相B为0.1%甲酸-水;梯度洗脱程序为:0~3 min,10% A→20% A;3~25 min,20% A→38% A;25~30 min,38% A→85% A;30~30.1 min,85% A→100% A。
质谱条件:质谱仪为Thermo Scientific Q Exactive-MS高分辨质谱仪(美国Thermo Fisher)。电喷雾离子源,选择正负离子模式(HESI+/ESI-),在100~1 500m/z范围内进行全扫描分析;离子源温度:120 ℃,喷雾电压:3.0 kV;毛细管温度:320 ℃;最大喷射电流:100 A;探针加热器温度:350 ℃;洗脱溶剂温度:400 ℃;鞘气和辅助气体均为氮气,流速分别为35.00 L/min和10.00 L/min。
1.3 网络药理学分析
1.3.1 候选靶点库和蛋白互作网络(PPI)构建
利用SwissTargetPrediction平台预测在FDPQ中鉴定出的皂苷类成分的潜在靶点。以“atherosclerosis”为关键词,从GeneCards数据库中收集疾病相关靶点。对成分靶点和疾病靶点求交集,建立候选靶点库。将候选靶点导入String数据库,选择high confidence(0.700),将生成的文件导入Cytoscape软件(3.8.2),筛选出MCC下的top 50枢纽基因(hub genes),并可视化获得PPI网络图;同时进行网络拓扑分析,计算出“degree”“betweenness centrality”“closeness centrality”值,进而得到核心靶点。使用的数据库和在线分析平台见表1。

表1 数据库和在线分析平台
1.3.2 GO功能和KEGG通路富集分析
利用Metascape平台[9]对筛选出的50个枢纽基因进行基因本体论富集(gene ontology,GO)和京都基因与基因组百科全书通路分析(Kyoto encyclopedia of genes and genomes,KEGG)。均选取P<0.01的结果,并使用微生信云平台对重要结果进行可视化。
1.4 分子对接
利用Discovery Studio(4.5 Client)软件将筛选出的活性成分和靶点进行分子对接。首先,使用“Prepare Ligands”模块生成活性成分的三维结构并加氢。从RCB PDB数据库下载靶点的大分子蛋白质(具有原配体),筛选条件为:Homo sapiens、X-Ray Diffraction,分辨率在0.25~0.40 nm之间。删掉水分后,使用“Prepare Protein”模块去除蛋白多构象,补充非完整的氨基酸残基,为蛋白加氢。拆分蛋白和原配体,利用LibDock方法将原配体和活性成分一同与蛋白进行对接,以LibDockScore评估活性成分和目标蛋白的亲和力。LibDock方法相关参数均为默认设置。
1.5 细胞实验
1.5.1 试剂与材料
胎牛血清(FBS)(批号:O30629)、RPMI1640培养基(批号:8121592)购自美国纽约GIBCO;H2O2(批号:BCCG3062)购自美国sigma;抗生素(青霉素-链霉素溶液)(批号:16D28C16)、PBS缓冲液(批号:16GO2A30)、胰蛋白酶(含EDTA)(批号:17A20167)、CCK-8试剂盒(批号:16H19B60)购自武汉博士德生物;RAPI lysis buffer裂解液(批号:90013B)、超氧化物歧化酶(SOD)(批号:032219190614)和丙二醛(MDA)检测试剂盒(批号:030819190614)、BCA蛋白测定试剂盒(批号:070919919113)购自上海碧云天;JC-1探针(批号:2019042)购自江苏凯基生物;过氧化氢酶(CAT)测定试剂盒(批号:20201218)购自南京建成生物工程研究所;Trizol(批号:213409)购自美国Thermo Fisher;DEPC水(批号:681165)购自上海吉至公司;逆转录试剂盒(批号:S2028)、SYBR Green q-PCR Master Mix试剂盒(批号:S2014)购自苏州宇恒生物。
1.5.2 FDPQ提取物冻干粉制备
精密称取FDPQ粉末适量,按“1.2.2”项下供试品溶液制备方法制备提取液,将滤液减压浓缩至无醇味后,冷冻干燥36 h得到提取物冻干粉,冻干工艺同“1.1”项下。
1.5.3 细胞培养
大鼠嗜铬细胞瘤细胞系PC12细胞购自武汉普诺赛生命科技有限公司。用含10% FBS的RPMI 1640 培养基在环境为37 ℃、5% CO2的培养箱中培养。每三天传代一次,取3到5代的细胞用于实验。
1.5.4 细胞活力测定
采用CCK-8法检测PC12细胞的活力,确定H2O2处理PC12细胞的最佳浓度和时间,以及FDPQ提取物的最佳干预浓度。将处于对数生长期的PC12细胞接种到96孔板中(1×104个细胞/孔)。细胞完全贴壁后,加入不同浓度的FDPQ提取物(5~120 μg/mL)培养24 h,或加入不同浓度的H2O2培养12、24、48 h。干预后更换新的细胞培养液,每孔加入10 μL CCK-8溶液,37 ℃暗箱培养1 h。最后,使用iMARK酶标仪(美国伯乐)在450 nm波长下检测各孔的吸光度(OD)值,计算细胞存活率。在测定FDPQ对H2O2诱导的PC12细胞的影响时,先用FDPQ提取物预处理PC12细胞24 h,再用确定的最佳H2O2浓度和处理时间干预细胞,最后检测干预后的细胞活力。
1.5.5 线粒体膜电位测定
将PC12细胞接种于激光共聚焦培养皿(1×104个细胞/孔),用不同浓度的FDPQ提取物和最佳浓度的H2O2干预后,PBS洗涤细胞3次,加入200 μL的JC-1染色工作液(10 μg/mL),使其能够完全覆盖住细胞表面,避光孵育20 min,吸除残余染液,吸取适量的1×Assay Buffer清洗细胞三次,加入含有DAPI的封闭剂孵育,最后在Olympus IX71倒置荧光显微镜(日本Olympus)下观察,记录图像。
1.5.6 抗氧化酶活性的测定
将PC12细胞配制成细胞悬液,接种于6孔板(每孔1×106个细胞),然后用不同浓度的FDPQ提取物和最佳浓度H2O2处理。干预结束后弃去上清液,用预冷的PBS溶液冲洗细胞3次,用RAPI裂解液对细胞进行裂解,收集细胞总蛋白。按试剂盒说明书测定细胞的SOD、CAT活性和MDA水平;同时用BCA试剂盒测定细胞总蛋白含量。
1.5.7 实时荧光定量PCR(qRT-PCR)检测mRNA表达
通过qRT-PCR法测定PI3K和Akt的mRNA表达。将PC12细胞接种在6孔板中(每孔1×106个细胞),用不同浓度的FDPQ提取物和最佳浓度的H2O2处理。随后收集细胞,使用Trizol Plus RNA纯化试剂盒分离总RNA。使用逆转录试剂盒合成cDNA,SYBR Green q-PCR试剂盒进行cDNA扩增。qRT-PCR分析所用引物见表2。实验结果以2-ΔΔCT的相对定量分析表示。
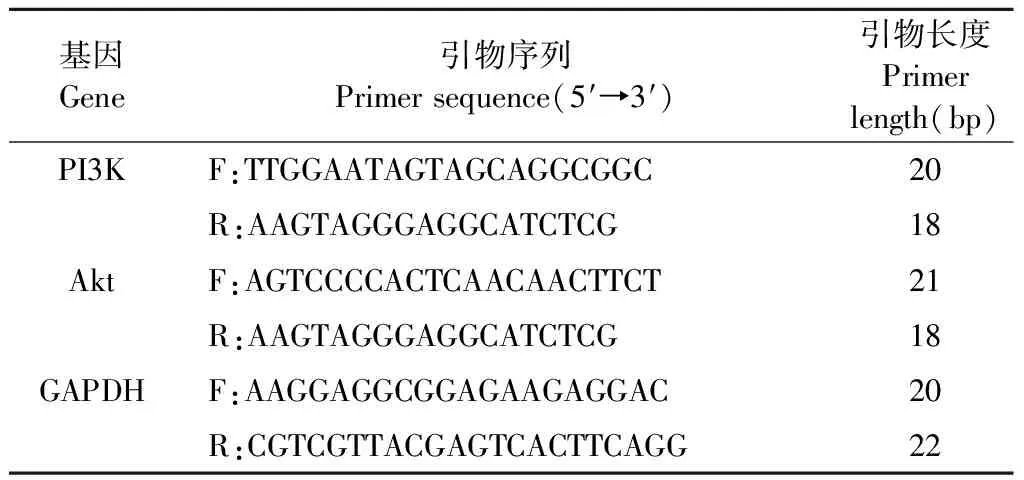
表2 qRT-PCR分析所用基因引物序列
1.5.8 统计和分析
所有数据均使用GraphPad Prism(9.3.1)软件分析,实验结果以平均值±标准差(n= 3)表示。组间差异采用单因素方差分析(one-way ANOVA),P< 0.05表示具有显著差异。
2 结果与分析
2.1 UPLC-Q Exactive Orbitrap-MS/MS鉴定结果
本文使用高分辨质谱对FDPQ皂苷类成分进行分析鉴别。将化合物的相对分子质量、保留时间和二级质谱裂解碎片信息等与Thermo Scientific建立的化合物库(mz Cloud和mz Vault)以及相关文献[10-12]中的进行比对,在FDPQ中鉴定出28种皂苷类化合物。总离子流图见图2,化合物的详细信息见表3。
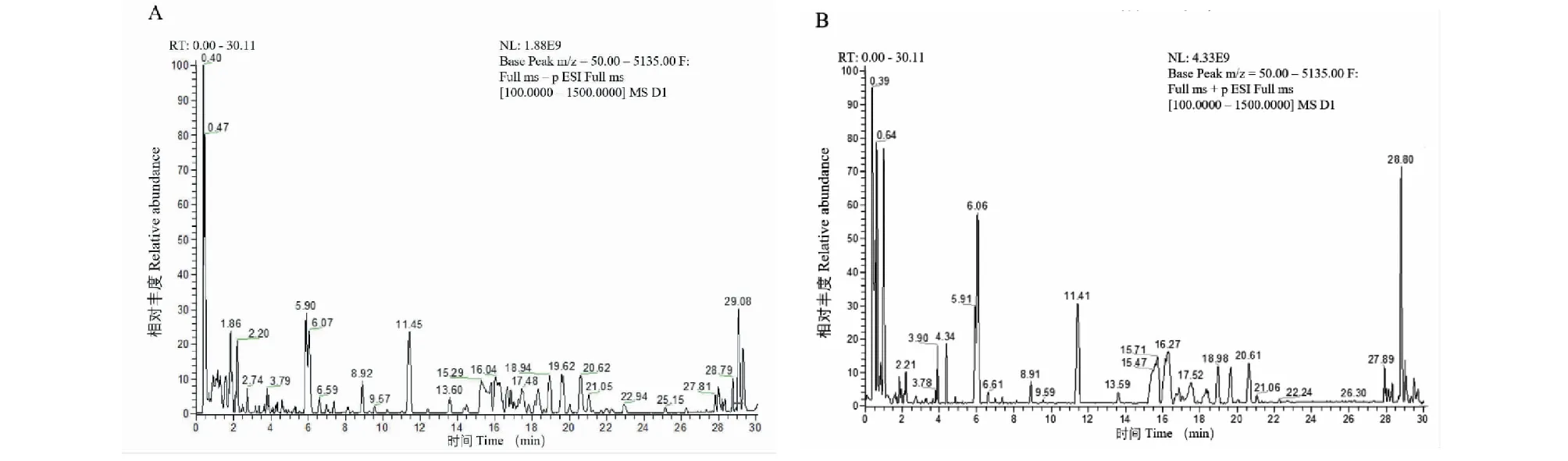
图2 总离子流图
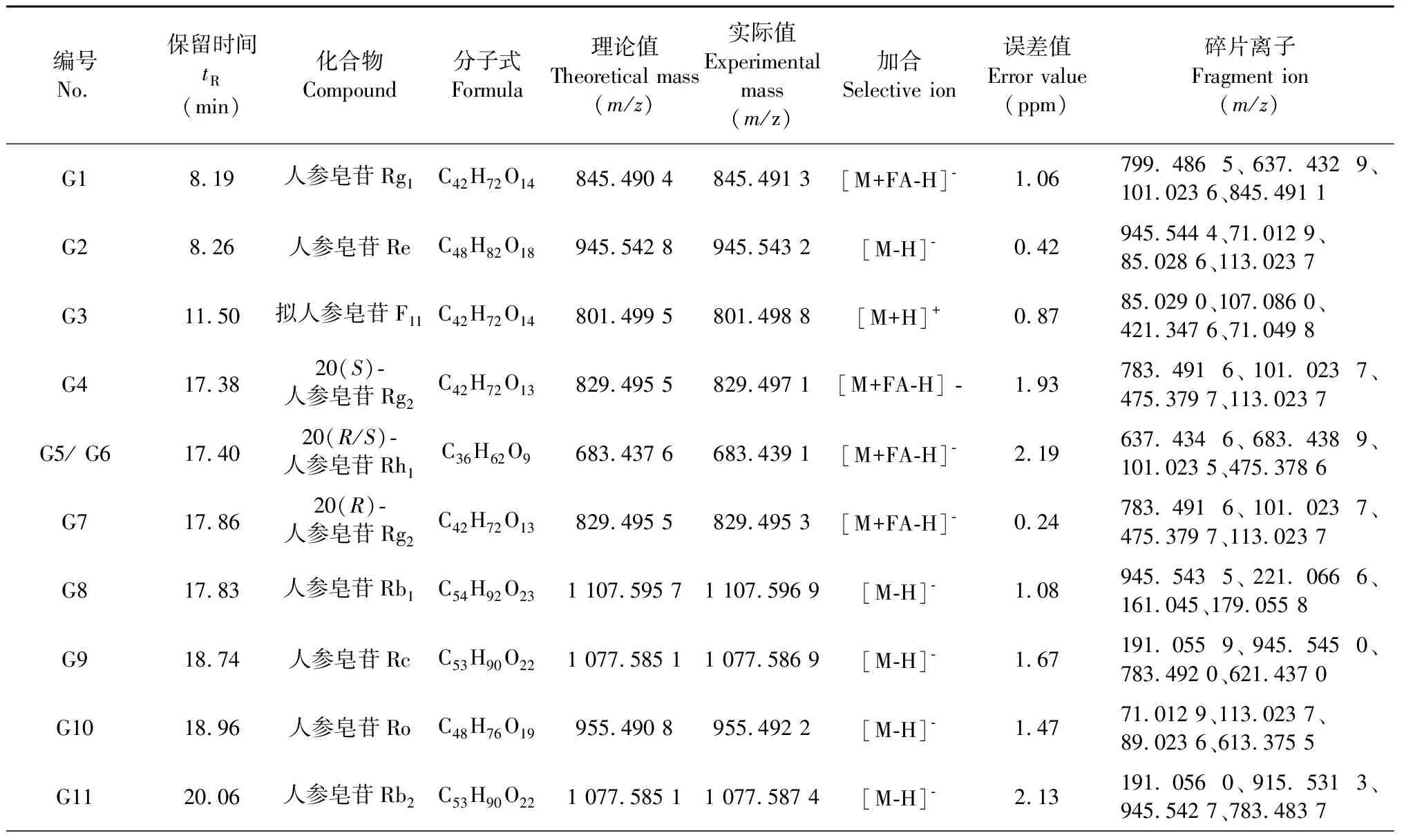
表3 FDPQ中的人参皂苷
2.2 候选靶点库和PPI分析
通过SwissTargetPrediction和GeneCards数据库的筛选,删除重复值后,获得了27个皂苷类化合物的相关靶点157个,疾病相关靶点4 719个。构建韦恩(Venny)图(见图3),得到二者交集靶点117个,作为候选靶点。按“1.3.1”项下的方法,使用Cytoscape软件从候选靶点中筛选出top 50枢纽基因,并可视化获得PPI网络图(见图4)。如图所示,该网络有50个靶点和329条边。以“degree”“betweenness centrality”“closeness centrality”值大于中位数为阈值进行筛选,将获得的21个交集靶点作为核心靶点,结果见表4。“degree”值越高,表明其关联的节点越多,重要程度越高,其中,SRC、STAT3、HSP90AA1、EGFR、MAPK1、JUN、GRB2、AKT1、PIK3CA、VEGFA排名靠前(degree > 21),表明这些靶点可能发挥着重要作用。
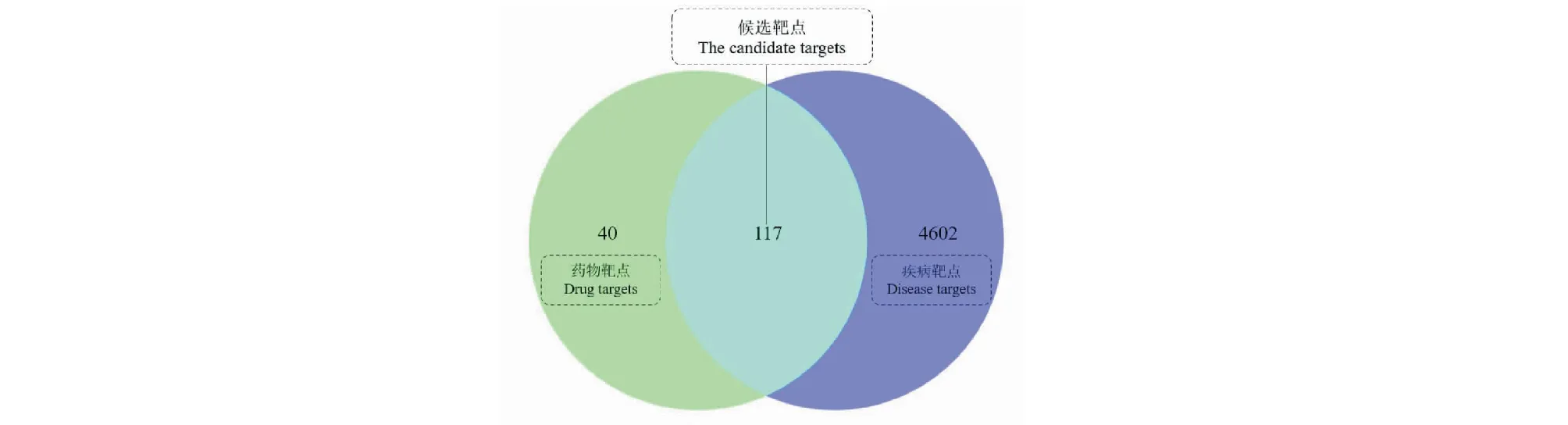
图3 药物和疾病靶点韦恩图
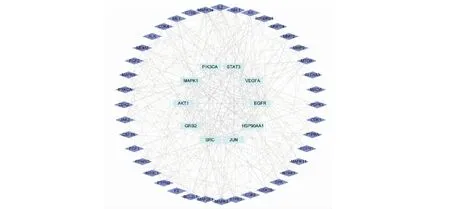
图4 枢纽基因蛋白互作网络
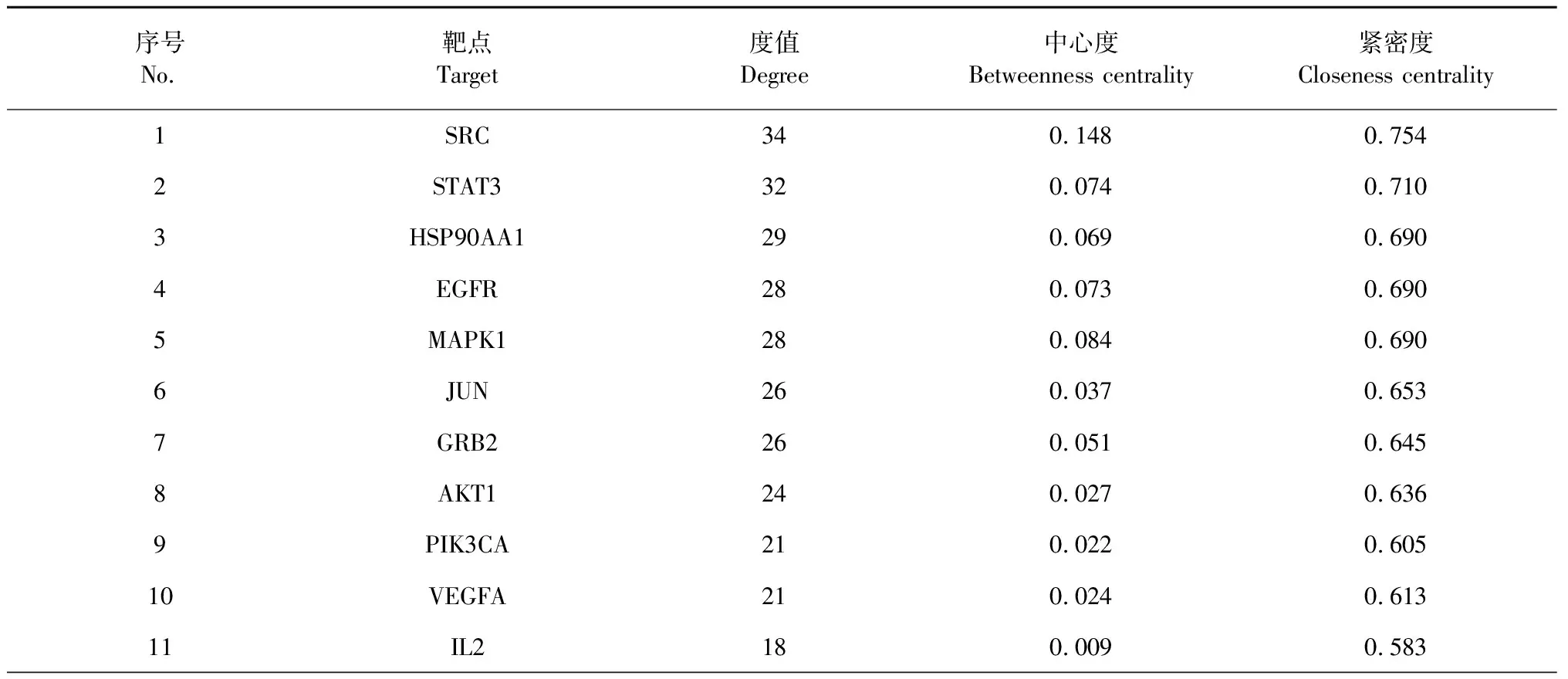
表4 FDPQ治疗动脉粥样硬化的核心靶点及拓扑参数
2.3 GO功能和KEGG通路富集分析结果
为了研究靶基因的生物学功能,对50个枢纽基因进行了三种GO功能分析,包括生物过程(biological processes,BP)、细胞组分(cellular components,CC)和分子功能(molecular functions,MF),将富集显著的结果可视化(P< 0.01),见图5A。BP主要包括跨膜受体蛋白酪氨酸激酶信号通路(transmembrane receptor protein tyrosine kinase signaling pathway)、酶联受体蛋白信号通路(enzyme linked receptor protein signaling pathway)、细胞迁移正向调节(positive regulation of cell migration)等。CC主要有受体复合物(receptor complex)、黏着斑(focal adhesion)、细胞-基质结(receptor complex)等。MF主要涉及蛋白质丝氨酸/苏氨酸/酪氨酸激酶活性(protein serine/threonine/tyrosine kinase activity)、蛋白激酶活性(protein kinase activity)、磷酸转移酶活性(phosphotransferase activity)等。KEGG通路富集分析可说明FDPQ在治疗AS时,作用于何种通路。50个枢纽基因筛选出了15条(P< 0.01)富集显著且与疾病相关性大的信号通路,结果如图5B和表5所示。主要信号通路包括PI3K-Akt信号通路、脂质和动脉粥样硬化相关通路(lipid and atherosclerosis)、MAPK信号通路、VEGF信号通路等。
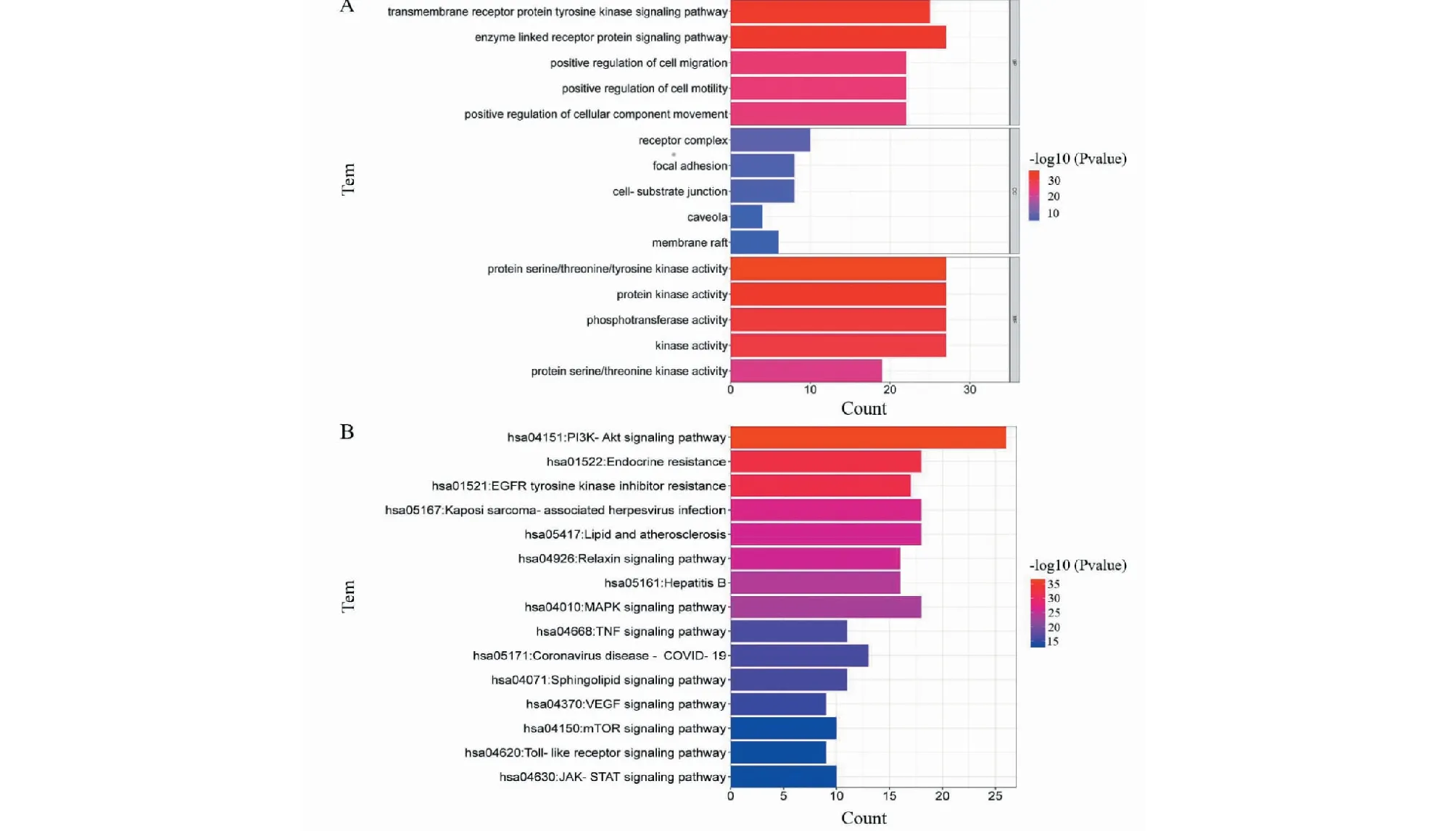
图5 枢纽基因GO(A)和KEGG(B)通路分析
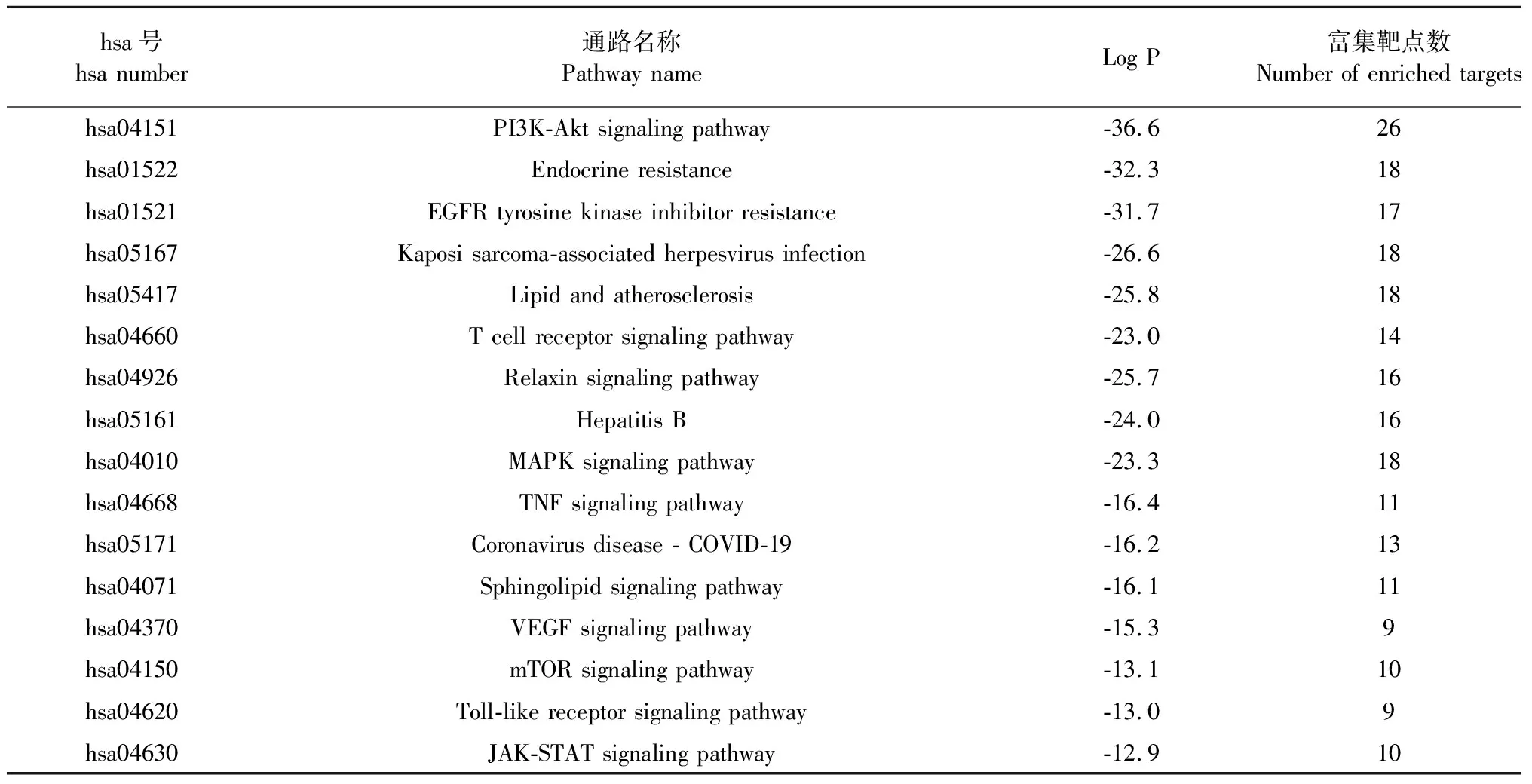
表5 枢纽基因KEGG通路分析
2.4 药物-成分-靶点-疾病-通路网络图
为了进一步筛选FDPQ皂苷类成分治疗AS的作用机制,利用Cytoscape软件构建了药物-成分-靶点-疾病-通路网络图(见图6),直观地展示了各部分间的关系。此网络由90个节点和470条边构成,其中包括动脉粥样硬化(atherosclerosis,AS)(粉色圆角方形节点),西洋参(Panacis Quinquefolii Radix,PQ)(蓝色方形节点),23个皂苷类化合物(紫色圆角方形节点),50个靶点(红色长方形节点)和15条作用通路(绿色V形节点)。以degree值筛选关联紧密的节点。G20、G22、G19、G5、G3、G6度值大,表明人参皂苷Rk3(G-Rk3)、人参皂苷Rh4(G-Rh4)、人参皂苷Rg4(G-Rg4)、20(R)-人参皂苷Rh1(20(R)-G-Rh1)、拟人参皂苷F11(P-F11)、20(S)-人参皂苷Rh1(20(S)-G-Rh1)可能是FDPQ治疗AS的重要成分;STAT3、PIK3CA、MAPK1、AKT1、VEGFA排名靠前,提示他们是治疗疾病的重要靶点;PI3K-Akt信号通路、内分泌抵抗(endocrine resistance)、脂质和动脉粥样硬化相关通路(lipid and atherosclerosis)、MAPK信号通路、VEGF信号通路则是治疗疾病的重要信号通路。
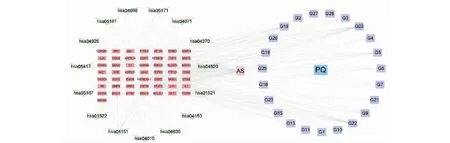
图6 药物-成分-靶点-疾病-通路网络
2.5 分子对接结果和分析
依据前文结果,选择STAT3、PIK3CA、MAPK1、AKT1、VEGFA等靶点与G-Rk3、G-Rh4、G-Rg4、20(R)-G-Rh1、P-F11、20(S)-G-Rh1进行对接,预测靶点和成分间的结合能力,通过与原配体的对接分数进行比较,来评估化合物和靶点蛋白的亲和力。对接分数如表6所示,与原配体相比,6个化合物均与靶点VEGFA(原配体PDB ID:MES)有强烈的亲和力,与靶点PIK3CA(原配体PDB ID:VY4)有较好的或与原配体相似的亲和力;G-Rg4与靶点STAT3(原配体PDB ID:KQV)、MAPK1(原配体PDB ID:KE8)展现出较好的亲和力;20(R)-G-Rh1、P-F11和靶点AKT1(原配体PDB ID:G4K)的亲和力与原配体的相似。因此,推测G-Rk3、G-Rh4、G-Rg4、20(R)-G-Rh1、P-F11可能是FDPQ治疗AS的主要活性成分,PIK3CA、VEGFA是主要的潜在靶点。靶点和活性成分的典型对接结果如图7所示。其中,20(R)-G-Rh1相较于原配体和靶点VEGFA有着最高的对接得分。20(R)-G-Rh1以良好的姿态镶嵌于靶点VEGFA的结合区域中,残基CYS68、ILE46、ASP63、TYP45在对接过程中发挥了重要作用。残基ASP63的羧基与配体的C12羟基氢形成了弱氢键,氢键距离为4.45 nm;TYR45的酚羟基与配体的羟基氢形成了弱氢键,氢键距离为5.48 nm。残基CYS68和ILE46分别在配体的两端发生了疏水相互作用,见图7(E-3)。
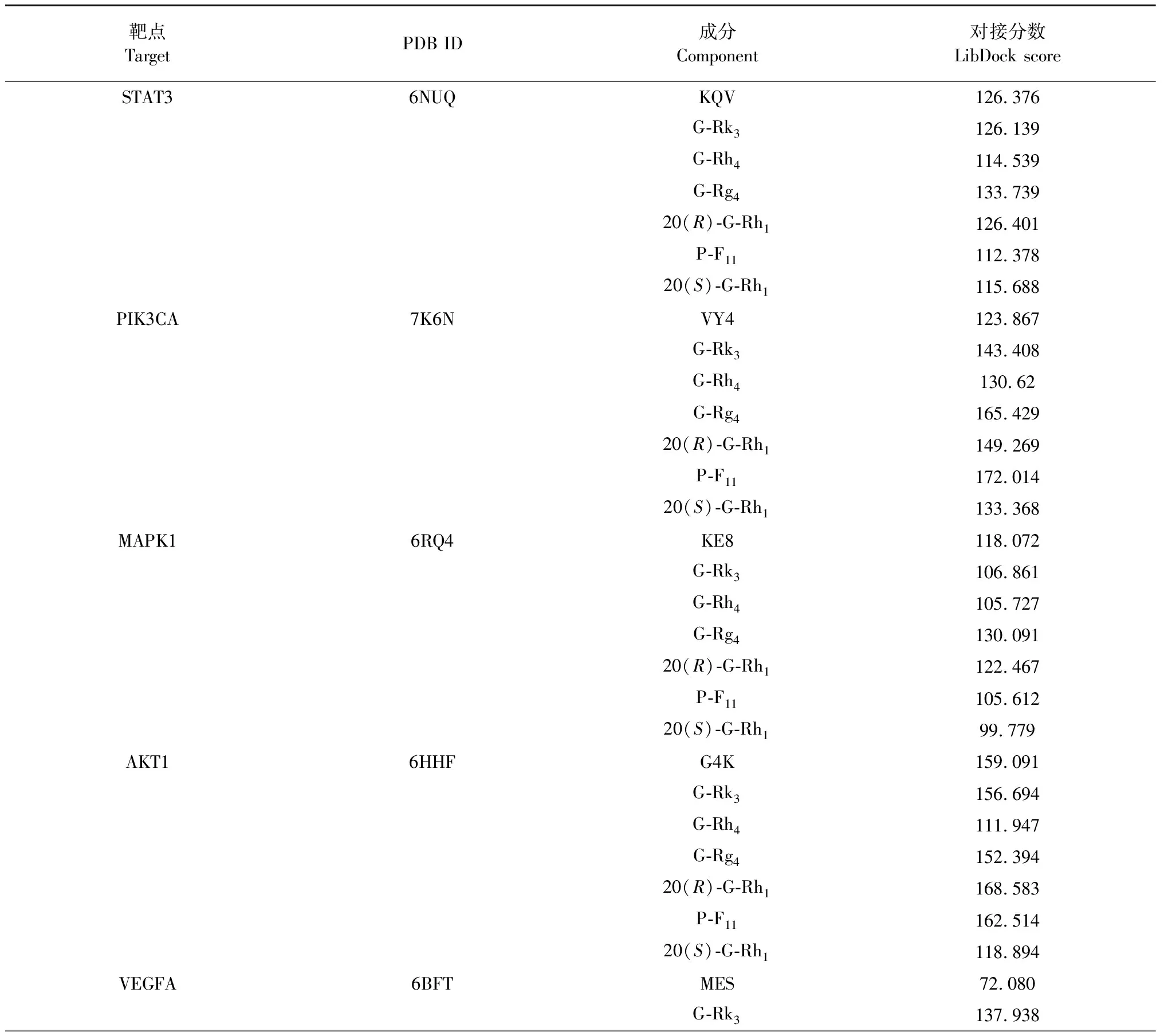
表6 活性成分和关键靶点分子对接结果
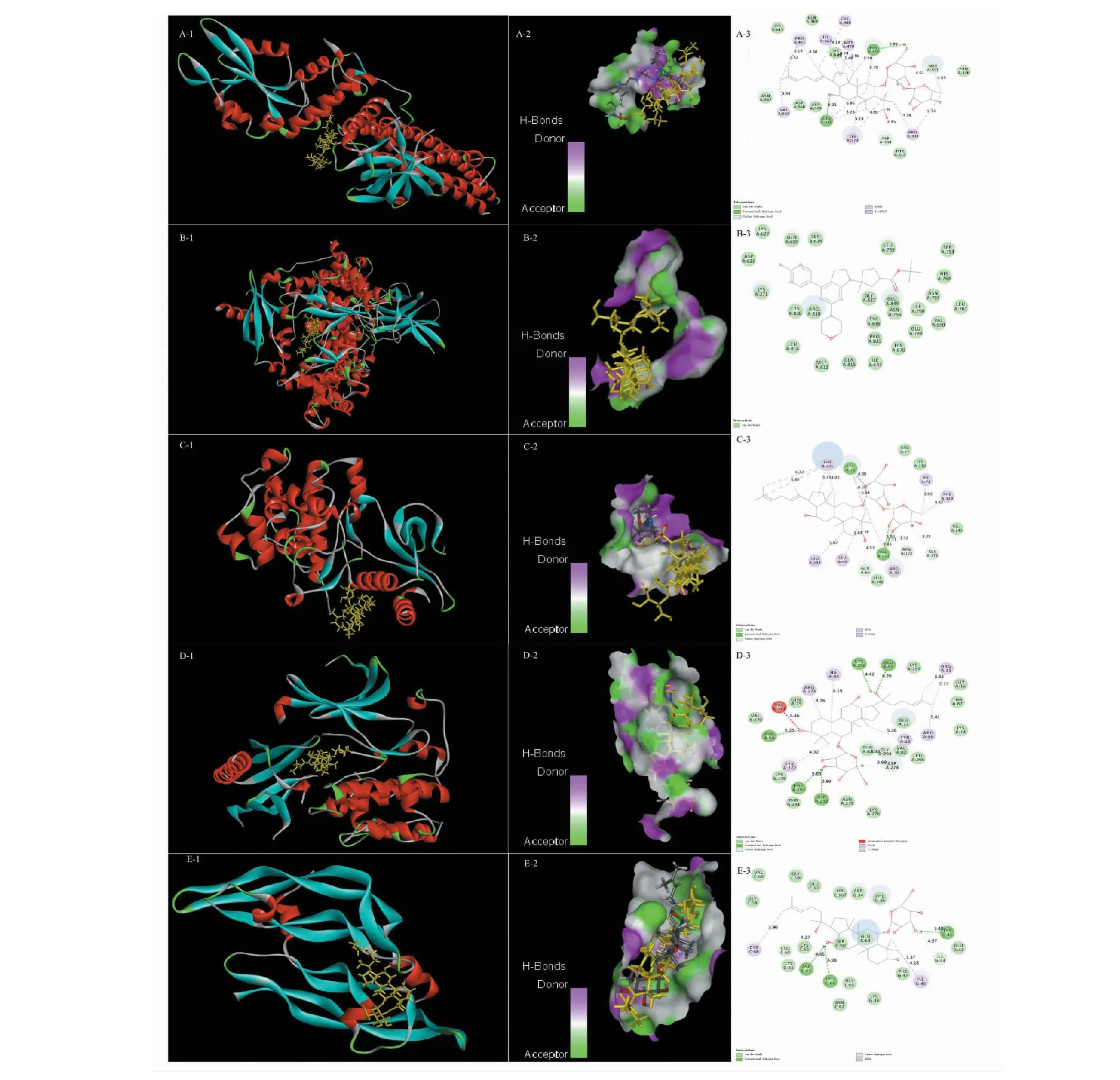
图7 6个活性化合物与5个靶点蛋白的分子对接作用模式
2.6 细胞实验验证结果
2.6.1 FDPQ对H2O2处理的PC12细胞具有保护作用
如图8A所示,FDPQ提取物的浓度在5、10、20、40、60、80、100、120 μg/mL时,对PC12细胞无明显的抑制作用,各组的细胞活力是近似的,说明提取物在该浓度范围内对PC12细胞基本无毒性。因此,我们选择40 μg/mL(低剂量组)、60 μg/mL(中剂量组)、80 μg/mL(高剂量组)作为本研究的干预浓度。图8B显示了不同浓度的H2O2在不同处理时间对PC12细胞活力的影响。40 μmol/L H2O2刺激24 h后,PC12细胞活性下降约40%,因此确定本研究的最佳干预浓度为40 μmol/L,最佳干预时间为24 h。如图8C所示,与模型组相比,FDPQ提取物能增加H2O2处理的PC12细胞的细胞活力,且呈剂量依赖性。表明FDPQ对H2O2诱导的PC12细胞损伤具有改善作用。
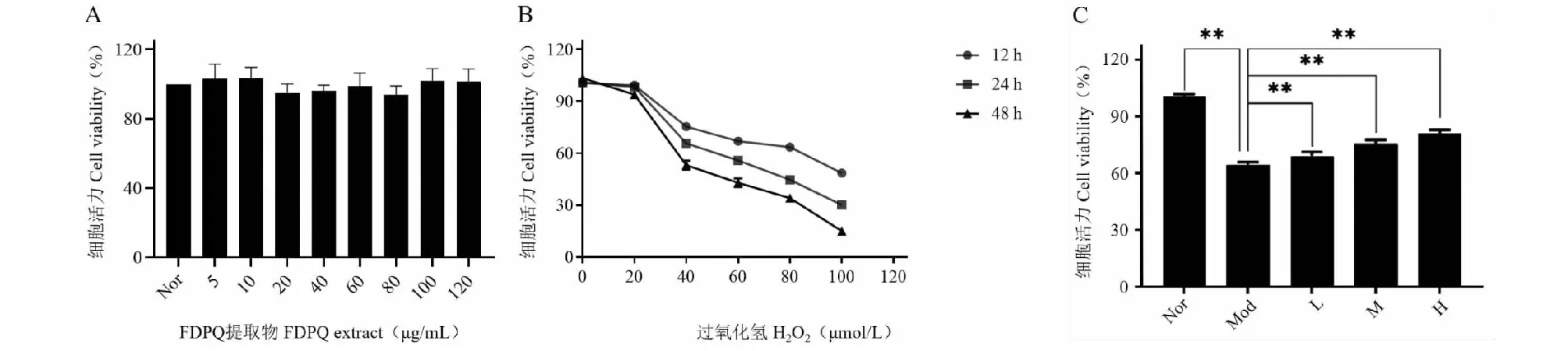
图8 FDPQ对H2O2诱导的PC12细胞的保护作用
2.6.2 FDPQ可升高PC12细胞线粒体膜电位
线粒体膜电位(MMP,ΔΨm)下降被认为是细胞凋亡的早期特征。同时,MMP在维持线粒体正常生理功能方面亦具有重要意义,MMP的降低常被作为线粒体功能障碍的重要指标[13]。JC-1探针是一种理想的荧光探针,广泛用于检测细胞MMP的变化。在正常的生理条件下,JC-1聚集在细胞线粒体的基质中,形成一种能发出红色荧光的聚合物。当MMP被还原时,JC-1不能聚集到线粒体基质上,以单体形式存在,发出绿色荧光。通过比较荧光强度的变化可以检测MMP的变化(见图9)。在H2O2作用24 h后,PC12细胞的红色荧光显著减弱,对应的绿色荧光显著增强,表明细胞发生了MMP损失。但与模型组相比,不同浓度的FDPQ提取物(40、60、80 μg/mL)预处理后,细胞的红色荧光逐渐增强,提示FDPQ可以降低H2O2诱导的MMP损失。
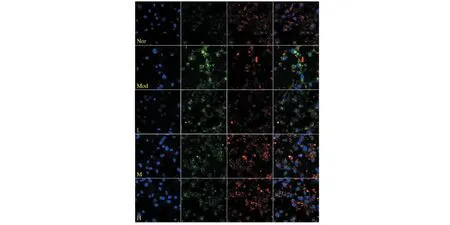
图9 FDPQ对PC12细胞的膜电位的影响
2.6.3 FDPQ可降低H2O2诱导的PC12细胞氧化应激
当细胞出现氧化应激时,细胞内的抗氧化酶系统会被激活,抑制活性氧(ROS)的过度产生,SOD、CAT是重要的活性氧清除酶。MDA是氧化应激引起的脂质过氧化形成的脂质过氧化物,具有细胞毒性,会攻击并破坏细胞膜[14]。MDA水平检测亦可评估细胞内氧化应激水平[13]。因此,为了评价FDPQ对H2O2诱导的氧化应激的影响,我们检测了FDPQ提取物(40、60、80 μg/mL)干预后H2O2诱导的PC12细胞中的MDA的生成以及SOD、CAT的活性。如图10所示,与正常组比较,PC12细胞在H2O2刺激24 h后,细胞内MDA水平显著升高,FDPQ预处理可抑制MDA的产生,并具有浓度依赖性(见图10A)。此外,H2O2刺激可降低细胞中抗氧化酶CAT、SOD的活性,FDPQ预处理可以提高这些酶的活性(见图10B、10C)。上述结果表明,FDPQ可通过提高活性氧清除酶的活性来降低H2O2诱导的PC12细胞氧化应激。
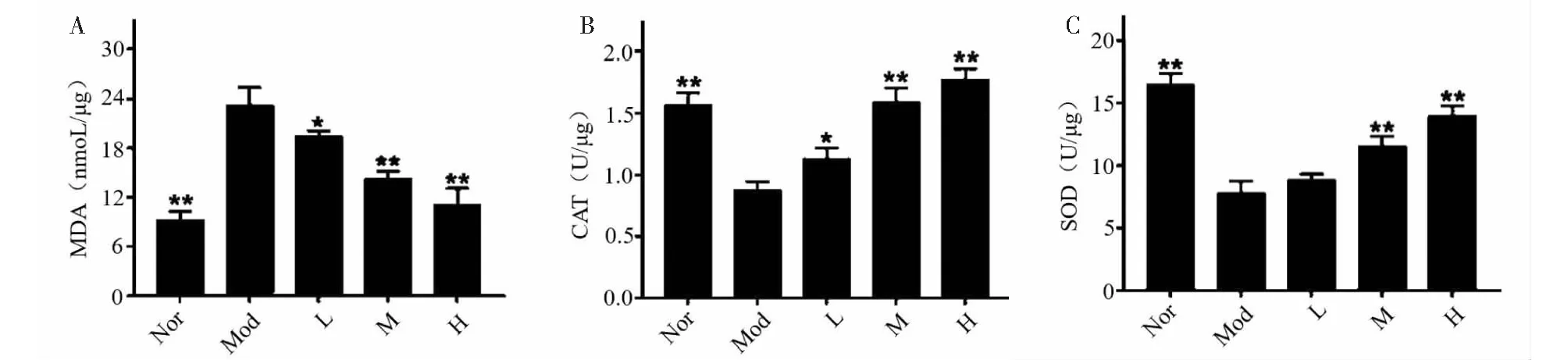
图10 FDPQ对H2O2诱导的PC12细胞的MDA水平(A)、抗氧化酶CAT(B)、SOD(C)的活性的影响
2.6.4 FDPQ可上调相关基因的mRNA表达
为了阐明FDPQ对H2O2诱导的PC12细胞氧化损伤的保护作用的分子机制,采用qRT-PCR检测相关基因的mRNA表达。如图11所示,与正常组相比,H2O2诱导后,PI3K、Akt的mRNA表达显著下调。不同浓度的FDPQ提取物(40、60、80 μg/mL)预处理PC12细胞后,这些基因的mRNA表达较模型组上调,且具有浓度依赖性。提示FDPQ可能通过调控PI3K/Akt的表达来改善H2O2诱导的PC12细胞的氧化损伤。

图11 FDPQ对H2O2诱导的PC12细胞中PI3K(A)和Akt(B)的mRNA表达的影响
3 讨论与结论
目前,每年死于缺血性心脑血管疾病的人数居全球首位,以AS引起的心肌梗塞和脑梗塞是死亡率最高的血管类疾病[15]。课题组前期研究发现,FDPQ或具有干预或治疗动脉粥样硬化的作用。FDPQ相较于传统烘干西洋参,部分皂苷类成分含量有所提高,但由于干燥方式机理的不同,尚不确定皂苷类成分种类是否改变;同时,中药数据库中有效成分的信息来源单一,甚至陈旧,不能全面、及时地反映FDPQ中所含成分[16]。因此,本文先通过UPLC-QE-Orbitrap-MS/MS鉴定出FDPQ中的皂苷类成分,再以网络药理学结合分子对接探索其治疗AS的药效物质和作用机制,并辅以细胞实验进行初步验证。
UPLC-Q Exactive Orbitrap-MS/MS分析鉴定出了28种人参皂苷,包括人参皂苷Rb1、Rc、Rd等原人参二醇型,人参皂苷Re、Rh1、Rg4等原人参三醇型以及奥克梯隆型的拟人参皂苷F11。基于数据库的筛选,获得FDPQ治疗AS的候选靶点117个,包括STAT3、EGFR、MAPK1、AKT1、PIK3CA、VEGFA等21个核心靶点。表明FDPQ治疗AS具有多成分、多靶点的特点。药物-成分-靶点-疾病-通路网络分析显示,人参皂苷Rk3、人参皂苷Rh4、人参皂苷Rg4、拟人参皂苷F11、20(R/S)-人参皂苷Rh1等成分关联的靶点较多,可能是FDPQ治疗AS的重要成分。现有研究表明人参皂苷Rk3具有抗氧化、抗凋亡和抗炎作用,可显著降低NF-κB、TNF-α、IL-6和IL-1β等炎症因子的表达,显著降低血清中AST和ALT水平,减少氧化应激发生[17]。人参皂苷Rg4可显著清除ROS,抑制ROS诱导的p38丝裂原活化蛋白激酶(MAPK)的激活,有助于维持内皮细胞的完整性[18]。拟人参皂苷F11是西洋参的特有成分,研究表明其可通过减轻自噬/溶酶体缺陷和抑制钙超载,对中风起到神经保护作用,亦可通过激活BDNF/TrkB通路,改善脑卒中后长期神经功能损伤,促进脑卒中后神经发生,尤其是在缺血性脑卒中的慢性康复中有着巨大的潜在作用[19]。GO和KEGG富集结果提示FDPQ治疗AS的机制主要与PI3K-Akt信号通路、内分泌抵抗(endocrine resistance)、脂质和动脉粥样硬化相关通路(lipid and atherosclerosis)、MAPK信号通路、VEGF信号通路等相关,显示出FDPQ治疗AS具有多靶点、多途径的特点。分子对接结果表明活性成分与潜在靶点具有较好的结合活性,网络药理学的分析结果具有一定的可靠性。
越来越多的研究支持AS是一种始于血管内皮损伤的慢性炎症疾病[20],相关炎症是由促炎细胞因子、炎症信号通路、生物活性脂质和黏附分子介导的。近年来的研究证实,PI3K/Akt信号通路在炎症反应中起着重要作用。PI3K是一类特异性催化磷脂酰肌醇脂类物质的蛋白激酶,Akt是一种丝氨酸/苏氨酸蛋白激酶,又称蛋白激酶B。PI3K特异性催化PI产生的PIP3可使Akt完全活化,从而引起PI3K/Akt信号传导通路的级联反应,如调节NF-κB、TNF-α、IL-6和IL-1β等炎症因子的释放[21]。调控这些信号通路可以达到抑制炎症反应,改善氧化应激损伤,减轻脂质沉积和内皮损伤的作用[22]。NF-κB通路的激活在炎症反应中起着重要作用[23]。蛋白激酶MAPK是转导信号引起细胞反应的重要物质。MAPK家族亚系p38MAPK应激敏感性激酶被激活后,可通过磷酸化或促炎细胞因子(如TNF-α)来活化NF-κB,NF-κB被激活后亦通过其产生的促炎细胞因子反向激活p38MAPK,二者间的双向作用加速了AS的发展[24]。血管内皮生长因子(VEGF)由多种细胞分泌,并与内皮细胞中的同源酪氨酸激酶VEGF受体(VEGFR-1、VEGFR-2、VEGFR-3)结合,产生各种下游效应,促进新生血管的形成及血管内皮细胞的生长,进而促进心脏或脑组织缺血再灌注后的功能恢复[25]。VEGF-Akt是经典的促进内皮细胞增殖、抑制细胞凋亡和促进血管新生的信号通路。研究显示,VEGF通过下游的PI3K-Akt信号级联,以BAD途径抑制细胞凋亡,以mTORC2和FOXO1促进内皮细胞增殖和血管新生[26]。在本研究中,对筛选出的可能机制展开了体外细胞实验验证,结果表明FDPQ可升高H2O2诱导的PC12细胞的线粒体膜电位,提高SOD、CAT等抗氧化酶的活性,降低细胞内MDA水平,同时上调PI3K/Akt的表达,提示FDPQ治疗动脉粥样硬化可能与其改善氧化损伤、抑制凋亡和炎症有关。
本研究初步阐释了FDPQ治疗AS多成分、多靶点、多途径的作用机制,但仍需进一步的实验验证。同时,本研究的另一个局限性是未包括多糖、蛋白质等大分子化合物,亦需要进一步的研究。
