玫瑰花中新唢呐草素I的分离、含量测定和体外活性研究
2022-09-13萨仁高娃苏龙嘎才仁拉毛齐和日玛
萨仁高娃,苏龙嘎,才仁拉毛,齐和日玛
1内蒙古医科大学民族医药创新中心;2内蒙古医科大学药学院,呼和浩特 010110
玫瑰(RosarugosaThunb.),多年生落叶灌木,属于蔷薇科蔷薇属植物。野生玫瑰分布于东亚温带地区,原产于我国北部,朝鲜,日本及堪察加半岛和鄂霍次克海亚北极区地带[1]。玫瑰花为玫瑰的干燥花蕾,其味甘、微苦、性温、有疏肝理气、和血调经的功能,可用于治疗肝胃气痛、食少呕恶、月经不调、带下、跌扑伤痛、风湿痹痛[2-5]等。玫瑰花作为药食同源植物,在我国各地均有栽培种植,主要产区在山东平阴县、甘肃苦水镇、新疆和田地区、陕西渭南市、江苏铜山县、北京妙峰山等[6]。
玫瑰花的主要化学成分为酚类化合物[7]、挥发油[8]、多糖[9]、黄酮[10,11]和鞣质[12]等,其中,主要研究集中在玫瑰花瓣中酚类化合物及其抗氧化活性[13-15]的研究,而对其他成分的药理作用和生物活性的研究甚少[16]。
可水解鞣质化合物是一类由酚酸及其衍生物与葡萄糖或多元醇通过苷键或酯键而形成的化合物。其药理作用包括抗氧化、抗肿瘤、抗病毒、抑菌、降血糖、抗过敏、抗脂质过氧化等多种生物活性[17,18]。前期研究中报道新疆和田玫瑰中发现了包括新唢呐草素I的几种具有糖苷酶抑制作用的可水解鞣质化合物,其总含量为干燥玫瑰花瓣中约占3%~5%[19]。Okuda等[20]首次从日本野生玫瑰中分离出新唢呐草素I。据报道,新唢呐草素I具有抗痤疮和抗炎活性[21]、保肝和抗氧化作用[22]、抗菌作用[23]。
本研究从内蒙古阿尔山区生产的玫瑰花中分离新唢呐草素I,鉴定其结构,对不同产地玫瑰中新唢呐草素I的含量进行测定,考察了其对α-葡萄糖苷酶的活性抑制作用和抗氧化活性,为筛选降低餐后血糖的玫瑰花保健品的开发应用提供理论基础。
1 材料与方法
1.1 材料与试剂
阿尔山玫瑰花(Q/ATY006-2012)、长白山玫瑰花(Q/JMY00015)、北京玫瑰花(Q/YXS HT001)、新疆于田玫瑰花(Q/HSM000 IS-2014)、新疆和田玫瑰花(GB/T19598)、甘肃苦水玫瑰花(Q/SGT0005S)、山东平阴玫瑰花(GB/T19696)、湖南南山玫瑰花(Q/YSNJ0001S)、云南昆明重瓣玫瑰花(Q/KXY0002S)、云南金边玫瑰(Q/CYC00035)、法兰西玫瑰(Q/CYC00035)均购自内蒙古天盛蒙中医药有限公司。
α-葡萄糖苷酶(美国Sigma,批号G5003-100UN);阿卡波糖(北京拜尔药业有限公司,国药准字H19990205);DPPH(1,1-二苯基-2-三硝基苯肼,美国Sigma)。
1.2 仪器
高效液相色谱仪(Shimadzu LC-20303 3D);半制备高效液相色谱仪(Waters 2487);AVANCE NEO600 MHz核磁共振仪(Bruker Biospin AG);超高效液相色谱/质谱联用仪(Waters XEVO G2-XS Q-Tof);KQ-500DE超声波清洗器(昆山市超声仪器有限公司);TELSTAR Cryodos 冻干机(西班牙泰事达公司);Fliter Max F5酶标仪(美国Molecular Devices);NUAIRE培养箱(美国NUAIRE)。
1.3 提取分离及结构鉴定
1.3.1 提取与分离
称取玫瑰花粉末1.0 kg,加入50%乙醇1 L,混匀,浸泡24 h,过滤,反复提取3次,合并滤液,减压浓缩至约200 mL。再用等量乙酸乙酯萃取3次,合并乙酸乙酯可溶部分,浓缩,冷冻干燥,得玫瑰花多酚提取物129.0 g。取玫瑰花多酚提取物10.0 g,进行Diaion HP-20(4.6 cm×45.7 cm)柱色谱分离,依次用水、50%乙醇、乙醇、丙酮洗脱,得到4个洗脱部分,浓缩,冻干。经高效液相色谱分析,选取50%乙醇洗脱部分,用水溶解采用Sephadex LH-20(4.6 cm × 45.7 cm)柱,以系统梯度水-乙醇不同比率(100∶1→0∶1)洗脱,对55%乙醇洗脱部分进行3~4次分离,高效液相色谱分析,得到富含多酚的乙醇洗脱液,合并,浓缩,再用半制备液相色谱柱进行分离纯化,得到化合物1(47.9 mg)。半制备高效液相色谱条件:色谱柱:Waters T01741S 06(7.8 mm × 300 mm);进样量:1 mL;流速:3.0 mL/min;检测波长:280 nm;流动相:纯水(A)-乙腈(B),采用二元梯度洗脱(0~5 min,100%→90% A;5~5.10 min,90%→77.5% A;5.10~12 min,77.5% A;12~12.10 min,77.5%→0% A;12.10~17 min,0% A;17~17.10 min,0%→90% A;17.10~20 min,90% A)。
1.3.2 结构鉴定
采用核磁共振仪(NMR)和质谱(Tof-Mass)解析,进行结构表征。质谱条件:毛细管电压:3.0 kV(正离子)/2.5 kV(负离子);取样电压:80 V;源抵消电压:80 V;离子源温度:130 ℃;雾化温度:450 ℃;锥孔气:100 L/h;脱溶气:800 L/h;数据采集模式:MSEContinuum;质量范围:100~1 200 Da。
1.4 新唢呐草素I的含量测定
1.4.1 色谱条件
色谱柱:Inertsil ODS-4(4.6 mm×150 mm,5 μm);柱温:40 ℃,进样量:20 μL,流速:1.0 mL/min,检测波长:280 nm;流动相:纯水加0.1%甲酸(A)-乙腈加0.1%甲酸(B),采用二元梯度洗脱(0~4 min,100%A;4~10 min,100%→85%A;10~18 min,85%→80%A;18~22 min,80%→70%A;22~28 min,70%→50%A;28~30 min,50%→0%A;30~32 min,0%→100%A)。
1.4.2 标准曲线的绘制
称取“1.3.1”项下方法分离纯化的新唢呐草素I 25.0 mg,溶于50%乙醇定容于25 mL,用50%乙醇稀释至五个不同浓度(20.0、40.0、50.0、60.0、80.0 μg/mL),0.45 μm滤头过滤,按“1.4.1”项下色谱条件进行测定,绘制标准曲线。
1.4.3 玫瑰花中新唢呐草素I含量的测定
分别取11个不同产地的玫瑰花,把花柄、花托、花萼、雌雄蕊等清理干净后,花瓣粉碎,过100目筛子,备用。取玫瑰花粉末200.0 mg,加40 mL 50%乙醇溶解,超声提取30 min,离心20 min(3 500 r/min,室温),取上清液,加50%乙醇定至50 mL,0.45 μm滤头过滤,按“1.4.1”项下色谱条件进行测定。
1.5 玫瑰花的体外活性评价
1.5.1 样品制备
称取上述玫瑰花粉末2.0g,加200 mL 50%乙醇溶解,按“1.4.3”项下方法提取2次,上清液合并,浓缩,冷冻干燥,得玫瑰花提取物。
1.5.2 抑制α-葡萄糖苷酶活性的测定
采用pNPG法测定11种玫瑰花提取物对α-葡萄糖苷酶的抑制作用[24-26]。分别准确称取玫瑰花提取物0.10、0.15、0.20、0.25、1.25 mg,用50%乙醇溶液溶解分别定容到10 ml,得到浓度为10、15、20、25、125 μg/mL的样品溶液。96孔培养皿里加12 mm pNPG培养基80 μL,分别加10 μL上述5个不同浓度的样品溶液(n= 3),再加α-葡萄糖苷酶溶液10 μL,在405 nm波长下测定其吸光度,然后放进37 ℃培养箱里培养20 min,再次测定其吸光度。阳性对照品为0.1 mg/mL阿卡波糖溶液,空白对照品为纯水。根据抑制率公式计算样品抑制率,从而推算其半数抑制浓度值(IC50)。
抑制率=[A空白-(A样品-A样品空白)]/A空白×100%
式中,A空白为空白对照溶液吸收度;A样品为样品对α-葡萄糖苷酶作用后的吸收度数值;A样品空白为样品吸收度数值。
1.5.3 清除DPPH自由基活性的测定
称取玫瑰花提取物10.0 mg,用50%乙醇溶解定容到10 mL,得到1.0 mg/mL样品溶液,再用50%乙醇分别稀释得到浓度为1.0、0.5、0.1、0.05、0.025 mg/mL的溶液。精密吸取样品溶液20 μL,加1,1-二苯基-2-三硝基苯肼(DPPH,125 mmol/L)180 μL,混匀,在避光条件下,冰块中静置20 min,在517 nm下测定其吸光度。空白对照溶液为同样体积的50%乙醇加125 mmol/L DPPH溶液。使用其吸光度计算DPPH的清除率,从而推算其IC50。
DPPH的清除率=[1-(A样品-A样品空白)/A空白]×100%
式中,A样品为样品对DPPH作用后的吸光度,A样品空白为样品吸光度,A空白为DPPH空白对照溶液吸光度。
2 结果
2.1 化合物的结构解析和纯度分析
化合物1黄色粉末;HR-ESI-MS:m/z787.081 3[M + H]+,分子式为C34H26O22。1H NMR(600 MHz,DMSO-d6)δ:6.88(2H,s,HI-2′,6′a),6.87(2H,s,HI-2′,6′b),6.80(2H,s,HII-2′,6′a),6.75(2H,s,HII-2′,6′b),6.38(1H,s,H-3′′a),6.36(1H,s,H-3′′b),6.23(1H,s,H-3′′′a),6.20(1H,s,H-3′′′b),5.68(1H,t,J= 9.8 Hz,H-3a),5.53(1H,t,J= 9.8 Hz,H-3b),5.37(1H,d,J= 1.5 Hz,H-1a),5.16(1H,dd,J= 9.8,1.5 Hz,H-6a),5.11(1H,dd,J= 9.8,1.5 Hz,H-6b),5.04(1H,dd,J= 9.8,8.1 Hz,H-2a),4.98(1H,dd,J= 9.8,8.3 Hz,H-2b),4.94(1H,d,J= 1.5 Hz,H-1b),4.90(1H,dd,J= 9.8,6.3 Hz,H-5a),4.87(1H,dd,J= 9.8,6.3 Hz,H-5b),4.54(1H,t,J= 9.8 Hz,H-4a),4.33(1H,t,J= 9.8 Hz,H-4b),3.82(1H,d,J= 9.8 Hz,H-6a),3.75(1H,dd,J= 9.8,1.5 Hz,H-6b);13C NMR(151 MHz,DMSO-d6)δ:95.7(C-1a),90.4(C-1b),71.3(C-2a),70.7(C-2a),73.3(C-3a),72.9(C-3b),70.5(C-4a),70.3(C-4b),72.2(C-5a),72.2(C-5b),66.2(C-6a),62.8(C-6b),119.3(CI-1′),109.0(CI-2′,6′),146.0(CI-3′,5′),138.6(CI-4′),166.4(CI-7′),119.1(CII-1′),109.0(CII-2′,6′),144.8(CII-3′,5′),138.5(CII-4′),165.7(CII-7′),115.0(C-1′′),124.9(C-2′′),107.2(C-3′′),144.5(C-4′′,6′′),136.2(C-5′′),168.3(C-7′′),115.3(C-1′′′),124.5(C-2′′′),106.7(C-3′′′),143.4(C′′′-4′′′,6′′′),136.2(C-5′′′),167.9(C-7′′′)。将上述波谱数据与文献[20,27]比较,鉴定化合物1为新唢呐草素I(结构式见图1)。化合物1的纯度以归一化法推算,互变异构体峰1的相对峰面积为26.64%;互变异构体峰2的相对峰面积为68.84%,总相对峰面积为95.48%。
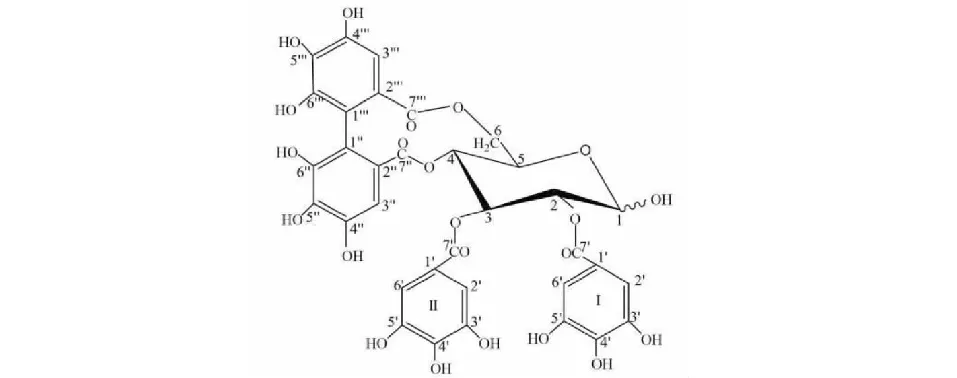
图1 新唢呐草素I结构式
2.2 新唢呐草素I含量测定
2.2.1 标准曲线的绘制
分别以新唢呐草素I互相异构体的峰面积为纵坐标(Y),对照品浓度为横坐标(X),绘制回归曲线,回归方程分别为Y=51 915X-141 156(R2= 0.999 4)、Y= 63 016X-233 878(R2= 0.998 7),在0.2~0.8 mg/mL范围内线性关系良好(见图2)。
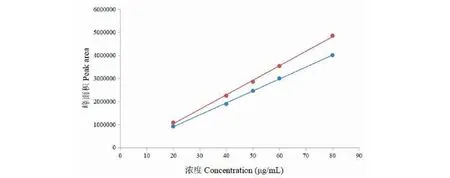
图2 新唢呐草素I互变异构体的标准曲线
2.2.2 玫瑰花中的新唢呐草素I含量的测定
11个不同产地的玫瑰花分别经过超声处理后,采用高效液相色谱仪进行分析。结果得出,玫瑰花提取物中新唢呐草素I的分离度较好,色谱图见图3。11个不同产地玫瑰花提取物均含有新唢呐草素I,其含量普遍较高(如表1所示),1 g干燥玫瑰花中含有7.75~73.75 mg新唢呐草素I,含量为0.8%~7.4%。其中云南重瓣玫瑰花中新唢呐草素I含量最高,新疆于田玫瑰中含量最低。
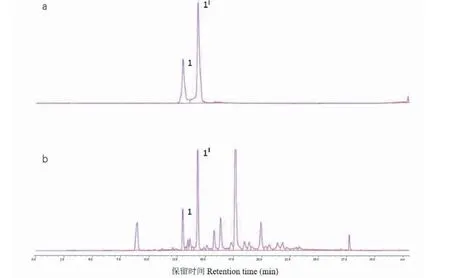
图3 新唢呐草素I(a)和玫瑰花提取物(b)的液相色谱图
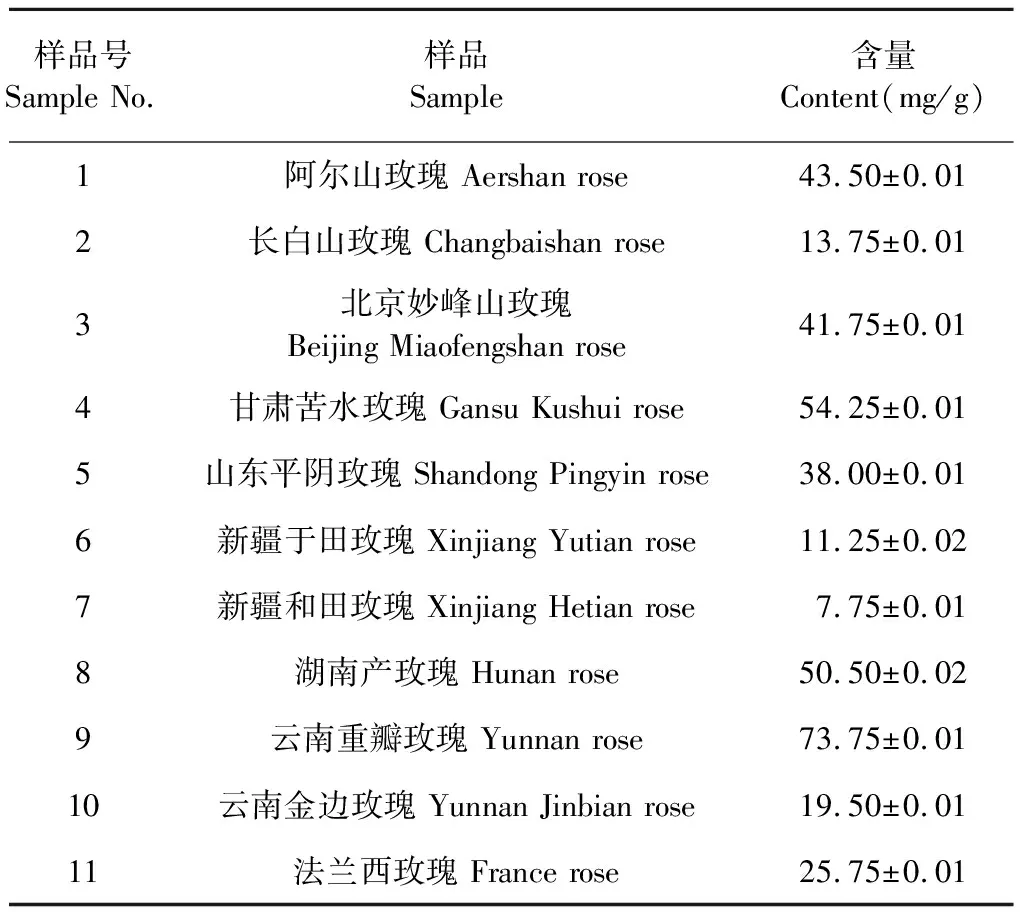
表1 玫瑰花中新唢呐草素I的含量测定结果
2.3 体外活性评价
2.3.1 抑制α-葡萄糖苷酶的活性评价
对11个不同产地玫瑰花提取物进行α-葡萄糖苷酶抑制活性评价实验,结果如表2所示,11个不同产地玫瑰花提取物对α-葡萄糖苷酶均显示较强的抑制活性,其中甘肃苦水玫瑰的IC50为14.73 μg/mL,而新疆和田玫瑰对α-葡萄糖苷酶的抑制作用最弱,IC50为40.96 μg/mL。阳性药阿卡波糖对α-葡萄糖苷酶抑制活性IC50为38.00 μg/mL,而新唢呐草素I对α-葡萄糖苷酶抑制活性IC50为10.00 μg/mL,对α-葡萄糖苷酶抑制活性比阳性药阿卡波糖高3.8倍。
2.3.2 抗氧化活性评价
玫瑰花提取物的抗氧化活性评价结果如表2所示,不同产地玫瑰花提取物均有抗氧化活性,其中北京妙峰山玫瑰的抗氧化作用最强,其IC50为102.1 μg/mL,而新疆和田玫瑰抗氧化作用最弱,其IC50为379.9 μg/mL。
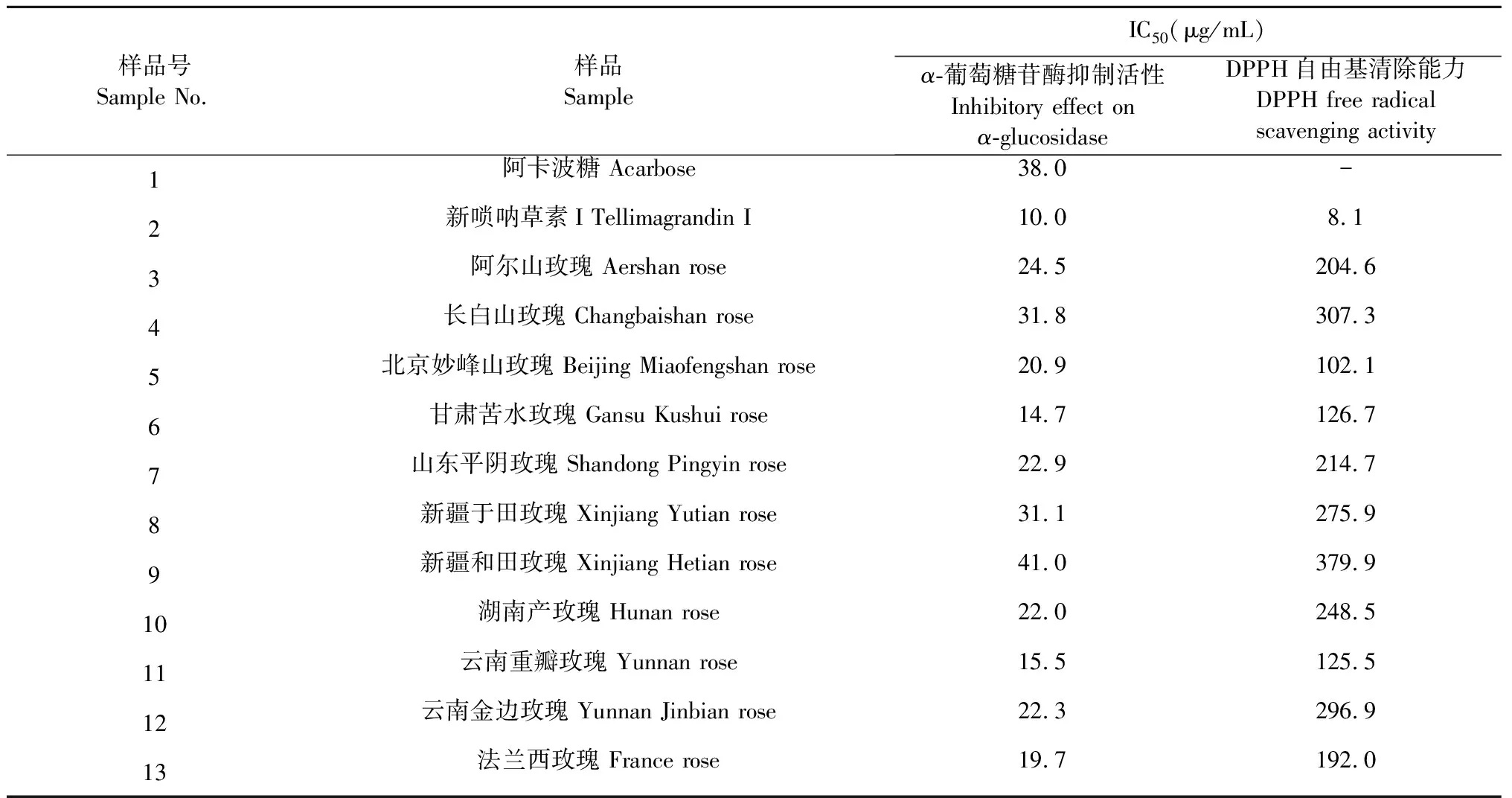
表2 玫瑰花的抑制α-葡萄糖苷酶活性和DPPH自由基清除能力评价结果
3 讨论与结论
本文采用葡聚糖凝胶(Sephadex LH-20)柱层析和半制备高效液相色谱法,从阿尔山玫瑰提取物中分离制备了一种可水解鞣质类化合物-新唢呐草素I,是葡萄糖的2、3位上的没食子酰基和4、5位上的HHDP(hexahydroxydiphenyl)基组成的鞣花鞣质。该化合物葡萄糖的端基为游离羟基,在液相色谱仪分析,280 nm波长下检测到两个峰。以pNPG为底物的酶抑制剂评价实验发现新唢呐草素I相对于阿卡波糖(IC50为38.00 μg/mL)有较强的抑制作用,其IC50为10.0 μg/mL。而DPPH自由基清除能力评价实验显示,新唢呐草素具有较强的抗氧化活性,其清除DPPH自由基的半数清除率IC50为8.1μg/mL。
玫瑰花中富含大量可水解鞣质类化合物,主要含有新唢呐素I、新唢呐素II、玫瑰素A、玫瑰素B、玫瑰素D、木麻黄鞣亭、木麻黄素、异木麻黄素等化合物[7,12],其中新唢呐草素I的含量为最高[7,12]。这些可水解鞣质类在酸、碱、酶的作用下,水解为小分子酚酸类化合物和糖或多元醇。本研究中,对11个不同产地玫瑰花进行新唢呐草素I的含量测定,结果发现均含有新唢呐草素I,并且含量为0.8%~7.4%,由此可见,新唢呐草素I为玫瑰花中可水解类化合物中含量比较高的主要成分之一。体外活性实验中,不同产地玫瑰花提取物均对α-葡萄糖苷酶有抑制活性和清除DPPH自由基活性,并且除了新疆和田玫瑰,其他10个产地的玫瑰花对α-葡萄糖苷酶的抑制活性均高于阳性药阿卡波糖,表明玫瑰花药材中存在具有α-葡萄糖苷酶抑制功能的化学成分,可作为玫瑰花的新功能开发潜力的有效成分。通过本研究可以证明,新唢呐草素I是玫瑰花中抑制α-葡萄糖苷酶活性和抗氧化活性成分之一。不同产地玫瑰花提取物中新唢呐草素I的含量越高,相应提取物的α-葡萄糖苷酶抑制活性和清除DPPH自由基活性有增加的趋势,但无显著性差异,表明无量效关系,这可能是玫瑰花中具有其他新唢呐草素I结构类似而活性相近的鞣质类化合物或酚酸类化合物的不同而引起的,故进一步研究玫瑰花中其它酚类成分是有必要的。
