姜黄素通过抗氧化应激保护成骨细胞功能的作用机制研究
2022-09-13赵容山梁伟坚邓炜聪林正江曾昕明洪永昌
赵容山,梁伟坚,邓炜聪,林正江,曾昕明,洪永昌
东莞市人民医院手外科,东莞 523000
骨质疏松症是最常见的骨退行性疾病之一,其主要特点是骨量低、骨微结构改变和骨折风险增加,严重影响了老年人尤其是绝经后妇女的生活[1-3]。成骨细胞负责骨形成,破骨细胞参与骨吸收。骨质疏松症的病理生理学基础是破骨细胞吸收增加,而成骨细胞功能障碍,导致骨形成减少和净骨丢失[4,5]。研究表明,氧化应激是骨质疏松症的关键致病因素,过度氧化引起的成骨细胞功能障碍进而导致成骨不足是骨质疏松症发生发展过程中净骨丢失的重要原因[6,7]。氧化应激不仅抑制成骨细胞分化和增殖还诱导细胞死亡[8-10]。因此,通过药物干预减轻氧化应激有助于保护成骨细胞的功能并减少其死亡,对改善骨质疏松症有一定作用。
姜黄素(curcumin,Cur)是姜黄根茎中的一种黄色物质,具有抗炎、抗氧化、抗菌和抗癌的作用,常被用作香料和强效草药[11]。据Li等[12]报道,Cur预处理通过消除活性氧(reactive oxygen species,ROS)对GSK3β-Nrf2信号通路的抑制作用减少成骨细胞凋亡并维持其分化功能。此外,3D打印支架释放的脂质体Cur对体外骨肉瘤(骨癌)细胞具有明显的细胞毒性,但促进成骨细胞(健康骨细胞)的存活和增殖[13]。然而,目前关于Cur对氧化应激状态下成骨细胞增殖的影响及其对成骨细胞氧化-还原系统的调节机制尚未明确。因此,本研究采用过氧化氢(H2O2)诱导氧化应激构建成骨细胞功能障碍模型,并通过观察Cur对细胞活性、增殖、分化及氧化-还原系统的调节作用,阐明Cur保护氧化应激状态下成骨细胞功能的作用机制。
1 材料与方法
1.1 仪器
生物安全柜(Thermo Fisher公司,1384 A2型);CO2细胞培养箱(Thermo Fisher公司,371型);倒置显微镜(Nikon公司,LV150N型);高速冷冻离心机(Thermo Fisher公司,X1R型);电热恒温鼓风干燥箱(上海精宏实验设备有限公司,DHG-9030A型);电热恒温震荡水槽(上海精宏实验设备有限公司,DKZ-2型);酶标仪(Thermo Fisher公司,Multiskan FC型);成像系统(上海天能生命科学有限公司,Tanon-5200Multi型)。
1.2 药品与试剂
成骨细胞完全培养基(上海赛百慷生物技术股份有限公司,Lot:2020032501)。胎牛血清(美国Gibco公司,Lot:2176404);β-甘油磷酸酯(上海阿拉丁生化科技股份有限公司,Lot:D1809035);抗坏血酸(德国默克公司,Lot:SLBN3833V);碱性磷酸酶染液(南京建成生物工程研究所,Lot:20200112);CCK-8细胞活力检测试剂盒(南京建成生物工程研究所,Lot:20200328);总抗氧化能力检测试剂盒(ABTS法,Lot:20200716)(南京建成生物工程研究所,Lot:20200724);丙二醛测定试剂盒(TBA法)(南京建成生物工程研究所,Lot:20200502);总超氧化物歧化酶测定试剂盒(WST-1 法)(南京建成生物工程研究所,Lot:20201025);过氧化氢酶测定试剂盒(南京建成生物工程研究所,Lot:20211127);碱性磷酸酶测定试剂盒(南京建成生物工程研究所,Lot:20200315);茜素红S染色液(0.2%)(北京索莱宝科技有限公司,Lot:20200423);β-actin抗体(澳大利亚Affinity公司,Lot:67c9910);p-p38 MAPK抗体(澳大利亚Affinity公司,Lot:40s1057);Wnt5a抗体(澳大利亚Affinity公司,Lot:56a9800);β-catenin抗体(澳大利亚Affinity公司,Lot:52i2198)。
1.3 细胞
将新生SD大鼠置于75%的酒精中浸泡2 min,用眼科剪及镊子分离颅骨,用眼科剪将其剪碎,然后转移至离心管中,分别加入0.1%的Ⅰ型、Ⅱ型、Ⅳ型胶原酶和中性蛋白酶,于4 ℃消化过夜;次日将组织过100目筛网,收集滤液,1 000 r/min,离心5 min,弃上清,用完全培养基重悬细胞沉淀,接种至25 cm2细胞培养瓶,在37 ℃,5% CO2条件下培养,每3天换液1次;细胞生长至90%融合时,用含EDTA的0.25%胰酶消化传代。细胞接种于细胞爬片,生长至80%~90%汇合时取出爬片进行ALP染色,用冷丙酮固定10 min,然后分别用孵育液在37 ℃孵育5 h,2%硝酸钴浸泡5 min,1%硫酸铵浸泡2 min,最后冲洗、干燥、封固。在显微镜下观察ALP染色情况,胞质呈现灰黑色颗粒或块状沉积则为成骨细胞。
1.4 方法
1.4.1 氧化应激模型构建与药物处理
依照文献中构建成骨细胞氧化应激模型的方法处理体外培养的大鼠成骨细胞[14],分为6个实验组:(1)正常对照组(normal control,NC),在正常条件下培养;(2)H2O2处理组(H2O2),用50 μmol/L终浓度的H2O2处理细胞;(3)1.25 μmol/L Cur预处理组(H2O2+1.25 μmol/L Cur),用1.25 μmol/L的Cur预处理12 h后,再用50 μmol/L终浓度的H2O2处理细胞;(4)2.5 μmol/L Cur预处理组(H2O2+2.5 μmol/L Cur),用2.5 μmol/L的Cur预处理12 h后,再用50 μmol/L终浓度的H2O2处理细胞;(5)5 μmol/L Cur预处理组(H2O2+5 μmol/L Cur),用5 μmol/L的Cur预处理12 h后,再用50 μmol/L终浓度的H2O2处理细胞;(6)10 μmol/L Cur预处理组(H2O2+10 μmol/L Cur),用10 μmol/L的Cur预处理12 h后,再用50 μmol/L终浓度的H2O2处理细胞。
1.4.2 成骨细胞增殖检测
通过检测H2O2处理后24、48和72 h大鼠成骨细胞的活力评估各组细胞的增殖情况。按照CCK-8细胞活力检测试剂盒的步骤,在相应的时间点往96孔细胞培养板的每孔加入10 μL CCK-8溶液,37 ℃孵育2 h后,用酶标仪检测450 nm波长的吸光度值(OD450 nm)。
1.4.3 总抗氧化能力(total antioxidant capacity,T-AOC)检测
按照总抗氧化能力(T-AOC)检测试剂盒的说明书步骤配制反应液,室温反应6 min后,检测405 nm波长的OD值。根据标准曲线计算各样品的T-AOC。
1.4.4 丙二醛(malondialdehyde,MDA)含量测定
按照MDA测定试剂盒的说明书步骤配制反应液,95 ℃水浴40 min,取出后流水冷却,4 000 r/min,离心10 min,取上清,检测532 nm波长的OD值,根据以下公式计算MDA含量:
MDA含量(nmol/mL)=[(OD测定-OD对照)/
(OD标准-OD空白)]×标准品浓度×稀释倍数
1.4.5 过氧化物歧化酶(superoxide dismutase,SOD)活性测定
按照总SOD测定试剂盒的说明书步骤配制反应液,37 ℃孵育20 min,检测405 nm波长的OD值。先计算出SOD抑制率(IRSOD),然后根据IRSOD计算出SOD活性,计算公式如下:
IRSOD=[(OD对照-OD对照空白)-(OD测定-
OD测定空白)]/(OD对照-OD对照空白)×100%
SOD活性(U/mL)=(IRSOD/50%)×
反应体系稀释倍数×样品稀释倍数
1.4.6 过氧化氢酶(catalase,CAT)活性测定
按照CAT测定试剂盒的说明书步骤配置相关试剂,与样本混匀后在37 ℃反应1 min,在405 nm处测定OD值,然后根据以下公式计算CAT活性:
CAT活性(U/mL)=[(OD对照-OD测定)/
(60×样品量)]×271×稀释倍数
1.4.7 碱性磷酸酶(alkaline phosphatase,ALP)活性测定
按照ALP测定试剂盒的说明书步骤配制反应液,37 ℃水浴15 min后加入显色剂,检测520 nm波长的OD值,然后根据以下公式计算ALP活性:
ALP活性(U/mL)=
[(OD测定-OD空白)/(OD标准-
OD空白)]×标准品浓度×100 mL×样品稀释倍数
1.4.8 诱导成骨分化及茜素红染色
大鼠成骨细胞接种于细胞培养六孔板中,70%汇合时添加5 mmol/L的β-甘油磷酸酯和100 mg/mL抗坏血酸诱导成骨分化,每天更换1次分化培养基,持续1周。六孔板中的细胞用PBS洗3次后,4%多聚甲醛固定20 min;用双蒸水洗3次;将水完全吸干净后慢慢加入茜素红S染色液,常温下染色30 min;弃去染料,用双蒸水洗5次。
1.4.9 免疫印迹(Western blotting)
提取成骨细胞的总蛋白进行SDS-PAGE,然后转PVDF膜,封闭后,用1∶500稀释的β-actin、p38 MAPK、Wnt5a和β-catenin抗体在4 ℃孵育18 h;次日用TBST洗膜3次,用HRP标记的二抗在室温孵育1 h;TBST清洗3次后,加入ECL显影。
1.4.10 统计学分析
2 结果
2.1 大鼠成骨细胞鉴定
ALP为一类磷酸酯酶,是成熟成骨细胞的标志性酶。本实验采用金属沉淀法显示ALP的分布,此法以天然存在的β-甘油磷酸钠为底物,经ALP水解释放出磷酸,立即被钙离子沉淀为磷酸钙,再次被置换为磷酸钴,最终被硫化液置换为灰黑色沉淀。如图1所示,ALP存在于95%以上的细胞被染成灰黑色,说明本实验分离和培养的细胞即为成骨细胞。

图1 成骨细胞鉴定
2.2 Cur对大鼠成骨细胞活力和增殖的影响
NC组的成骨细胞活力随着培养时间的延长逐渐增强,说明细胞处于良好的增殖状态,用H2O2处理后,细胞活力显著降低(P< 0.001)(见图2),而且随着培养时间的延长细胞活性逐渐降低,提示由H2O2介导的氧化应激不仅抑制成骨细胞增殖,还诱导其死亡。与H2O2组相比,除了1.25 μmol/L的Cur在48 h开始起作用,其它浓度的Cur(2.5~10 μmol/L)在24、48和72 h均显增加细胞活性(P< 0.05)(见图2),而且胞活性也随着培养时间的延长而增加,说明Cur除了保护成骨细胞抵御氧化损伤,还可以促进氧化应激状态下的成骨细胞增殖。

图2 成骨细胞活性及增殖检测
2.3 Cur对氧化应激的影响
SOD和CAT是内源性抗氧化酶,对机体和细胞的氧化-还原平衡维持起重要作用,过度氧化应激则可促进脂质发生氧化,生成MDA。与NC组比较,H2O2组的T-AOC、SOD和CAT水平显著降低,而MDA水平显著升高(P<0.001)(见图3),说明50 μoml/L终浓度的H2O2可以刺激成骨细胞发生过度氧化应激。各浓度的Cur(1.25~10 μmol/L)预处理均可以抑制氧化应激,表现为T-AOC、SOD和CAT水平显著升高,MDA水平显著降低(P<0.01)(见图3),而且对MDA生成的抑制作用具有剂量依赖性,说明该药物具有良好的抗氧化活性。

图3 成骨细胞的氧化还原指标检测
2.4 Cur对成骨细胞分化功能的影响
通过比较各组细胞的ALP活性及诱导分化后矿化钙结节的形成情况评估Cur对成骨细胞分化功能的影响。如图4所示,H2O2处理后成骨细胞的ALP活性显著降低(P< 0.001),而且矿化钙结节(茜素红S染色阳性)明显减少;1.25~5 μmol/L的Cur均可以显著上调ALP的活性(P< 0.05),并促进矿化钙结节形成,提示Cur可以保护氧化应激状态下的成骨细胞分化功能。

图4 成骨细胞的分化功能评估
2.5 Cur对p-p38 MAPK和Wnt信号通路的影响
通过Western blotting检测各组p-p38 MAPK和Wnt信号通路的表达,分析Cur保护氧化应激状态下成骨细胞功能的可能机制。如图5所示,H2O2处理后成骨细胞的p-p38 MAPK蛋白表达水平显著升高,而Wnt5a和β-catenin显著降低(P< 0.001);不同浓度的Cur则可以下调p-p38 MAPK并上调Wnt5a和β-catenin的水平(P< 0.05),提示Cur可能通过调节p38 MAPK和Wnt信号通路保护成骨细胞功能。
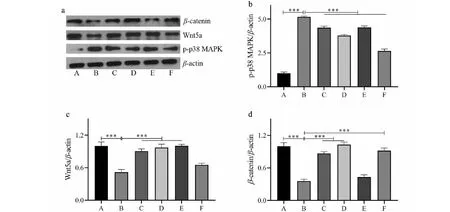
图5 各组p-p38 MAPK、Wnt5a和β-catenin的蛋白表达水平比较
3 讨论与结论
氧化应激损伤是骨质疏松症和/或骨坏死的主要病理之一,在培养液中加入H2O2诱导成骨细胞功能障碍是一种已建立的模拟骨质疏松症的细胞模型[12,15,16]。H2O2是一种常见的活性氧(ROS),其半衰期长且容易穿透各种质膜,因此可诱发明显的脂质氧化、蛋白质损伤和DNA断裂,最终导致细胞死亡和功能障碍[17]。本研究采用H2O2处理大鼠原代成骨细胞,致使细胞活性降低,增殖率和分化率减少,同时伴随氧化还原失衡,说明成骨细胞氧化应激损伤模型构建成功。
目前治疗骨质疏松症的药物主要包括双膦酸盐、激素疗法、选择性雌激素受体调节剂、降钙素、地诺单抗、钙和维生素D补充剂[18]。最近,合成代谢药物如特立帕肽,雷奈酸锶,罗莫昔单抗已经上市[17]。一项网络荟萃分析研究表明,不同的药物对不同部位的骨质疏松具有不同疗效[18]。此外,一些药物的安全性问题和不良副作用也需要引起重视[19,20]。因此,研究人员通过筛选天然药物的药效以期寻找有效且副作用小的骨质疏松治疗方法。目前研究发现,天然抗氧化剂(如Cur、白藜芦醇、山茶等)可以提供更安全有效的替代性治疗策略[17]。但是Cur改善骨质疏松的作用机制尚未完全明确。因此,本研究旨在从氧化还原和信号通路方面探讨Cur保护成骨细胞抗氧化应激损伤的机制。我们的实验数据表明,各浓度的Cur均可抑制H2O2介导的过度氧化并促进应激状态下的成骨细胞增殖,说明其安全且有效发挥药理效应的浓度范围较广。
细胞组织的抗氧化能力有赖于其内源性抗氧化系统对ROS的清除,但在病理状态下,细胞组织的清除能力减弱导致细胞的成分发生氧化损伤进而引起功能障碍[21,22]。在成骨细胞氧化损伤模型中,T-AOC和SOD水平降低代表细胞的抗氧化能力减弱,而MDA水平升高则提示细胞的脂质成分发生过度氧化。用梯度浓度的Cur干预后,氧化还原失衡有所改善。这些发现说明,Cur可能一方面通过自身的还原基团直接中和ROS,另一方面通过上调内源性抗氧化酶如SOD的活性间接清除ROS。氧化应激还通过激活p38 MAPK引起组织和细胞损伤[22],p38 MAPK的磷酸化水平代表其激活状态。Western blotting结果显示,不同浓度的Cur均可以抑制H2O2介导的p38 MAPK磷酸化,提示Cur对p38 MAPK激活的抑制作用可能参与其保护成骨细胞抗氧化损伤的机制。然而,由于不同类型的内源性抗氧化系统失衡导致产生的ROS种类不同,因而对细胞存活、死亡和功能的影响存在差异,我们将在今后的研究中进一步深入探究骨质疏松症的氧化还原调控机制。
本研究还发现,Cur可以改善H2O2对成骨细胞分化功能的抑制,表现为矿化钙结节增多且ALP活性升高,这与Li等[12]的研究报道一致。Cur预处理后的成骨分化能力增强可能与细胞增殖及ALP活性升高有关。然而,10 μoml/L的Cur并未表现出显著的促成骨分化作用,提示维持良好的细胞活性与增殖能力可能更有利于成骨细胞的分化功能。此外,ROS作为一种信号分子也发挥其生理学功能,过度抗氧化可能反而不利于细胞的正常功能[23]。10 μoml/L的Cur预处理虽然能很好地抑制脂质过度氧化,但对内源性抗氧化系统的保护作用不及低浓度Cur明显,因此,当Cur在动物和人体水平应用时应掌握适当的剂量。Wnt信号通路已被证实在成骨分化过程中起正性调控作用[24]。过多的ROS可促进Wnt/β-catenin通路中的关键基因转录转变为受FoxO调控,最终抑制成骨细胞增殖、分化和矿化,从而形成骨质疏松症[25]。我们通过Western blotting进一步探讨了Cur保护成骨细胞分化功能的可能机制,发现Cur可以逆转H2O2介导的Wnt5a和β-catenin表达下调,说明Cur可能通过调节Wnt/β-catenin信号通路促进氧化应激状态下成骨细胞的增殖、分化和矿化。
综上所述,本研究采用梯度浓度的Cur预处理大鼠成骨细胞,观察其对氧化应激导致成骨细胞功能障碍的改善作用,并初步阐明其作用机理。今后,尚需要对Cur等天然化合物进行更深入的应用基础及临床研究,才能为研发安全且有效的抗骨质疏松治疗策略提供理论依据。另外,Cur的用药剂量、给药方式、药物代谢、药效评价等也是值得探讨的科学问题。
