经颅微电流刺激对抑郁症患者睡眠的影响
2022-09-13武文珺李艳吴迪蔡敏王化宁
武文珺,李艳,吴迪,蔡敏,王化宁
(空军军医大学西京医院心身科,陕西 西安 710032)
抑郁症是自杀的重要因素,为社会带来巨大负担。尽管目前有药物治疗可以选择,然而,治疗效果并不尽如人意,且因多种不良反应而被一部分患者拒绝使用。物理治疗作为重要的治疗方式,其副作用轻微,耐受性高,越来越被更多的患者接受。经颅微电流刺激(cranial electrotherapy stimulation,CES)自1970年以来被广泛应用于神经精神领域的治疗,微电流通过耳部传导到大脑,调节脑网络连接,从而达到治疗的目标。CES已被证实对抑郁症具有治疗作用,但其原理仍未完全明确[1]。失眠是抑郁症最主要的临床症状之一,睡眠的改善对于失眠抑郁症乃至绝大多数抑郁症患者的康复有重要意义。本研究以探讨CES疗法与抑郁症患者睡眠改善的相关性,进而探讨其对抑郁症患者失眠症状的影响。
1 对象与方法
1.1 对象
收集2018年4月至2020年4月空军军医大学西京医院心身科门诊就诊患者64例。纳入标准:①符合《国际疾病分类》第10版中抑郁症诊断;②年龄18~55岁;③17项汉密尔顿抑郁量表(Hamilton Depression Scale,HAMD)总分≥17分。排除标准:①既往有躁狂或轻躁狂发作的症状;②重大躯体疾病史;③有精神活性物质使用史。
本研究方案及知情同意书均通过空军军医大学西京医院医学伦理委员会审批(许可证号:XJYY-LL-FJ-002)。在入组前将该研究所存在的可能风险及受益,具体研究计划以及后续随访要求充分告知患者和家属。所有患者表示理解并签署纸质版知情同意书后开始随机分组、进行试验。
1.2 方法
1.2.1 干预方法 CES组在抗抑郁药草酸艾司西酞普兰(丹麦灵北,来士普)治疗基础上接受CES治疗;常规组口服草酸艾司西酞普兰进行治疗,10 mg/d起始,根据患者病情可加量至最大治疗量20 mg/d。治疗期间可适当使用苯二氮卓类药物,不可进行其他物理治疗。
CES治疗:采用经颅微电流刺激仪(American Neuro Fitness LLC)。周一至周五每日治疗2次,每次治疗30 min,电流强度范围为0.5~2 mA,持续4周,共40次。强度设定为患者能接受的强度,即感到耳垂有微微针刺感。
1.2.2 评价方法 于基线、8周末采用多导睡眠图检查患者睡眠质量,使用多导睡眠图仪(北京太阳电子科技有限公司)记录监测。所有被试在专门的睡眠实验室按照其正常作息时间接受整夜睡眠呼吸监测。进行多导睡眠检查当日禁止饮酒、茶和咖啡等影响兴奋性的物质。由经过专门睡眠医学培训的医生分析睡眠指标,包括睡眠潜伏期、总睡眠时间、睡眠效率、各睡眠期时间、各睡眠期比例、入睡后总觉醒时间、微觉醒次数等。于基线、4周末、8周末进行HAMD-17评分。
1.2.3 统计学分析 运用SPSS 19.0软件进行统计学分析,数据以¯x±s表示,采用t检验、重复测量的方差分析(α=0.05),P<0.05表示差异具有统计学意义。
2 结果
2.1 基线时两组患者睡眠监测指标比较
共64例患者完成治疗及随访。常规组30(男9、女21)例,年龄(40.16±8.50)岁,病程(2.43±0.56)年,HAMD评分(24.2±4.2)分,草酸艾司西酞普兰治疗剂量(15.2±2.3)mg。CES组34(男11、女23)例,年龄(38.91±9.86)岁,病程(2.39±0.42)年,HAMD评分(24.8±4.5)分,草酸艾司西酞普兰治疗剂量(15.0±2.1)mg。两组患者性别、年龄、病程、HAMD评分和药物治疗剂量比较,差异无统计学意义;两组患者睡眠潜伏期、总睡眠时间、睡眠效率、非快速眼球运动睡眠1期(non-rapid eye movement,stage 1,N1)、N1比例、非快速眼球运动睡眠2期(non-rapid eye movement,stage 2,N2)、N2比例、快速眼球运动(rapid eye movement,REM)期、REM比例比较均无统计学差异(表1)。
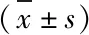
表1 基线时两组患者睡眠监测指标比较
2.2 8周末两组患者睡眠监测指标比较
8周末CES组睡眠潜伏期较常规组缩短,总睡眠时间、N2期时间及REM期延长,睡眠效率升高,N2期比例和REM比例增加(均P<0.05,表2)。
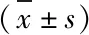
表2 8周末两组患者睡眠监测指标比较
2.3 两组患者HAMD评分比较
CES组与常规组干预后HAMD评分均降低;8周末CES组HAMD评分较常规组结果比较,差异有统计学意义(P<0.05,表3)。
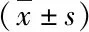
表3 两组患者HAMD评分比较
3 讨论
本研究结果显示,治疗8周末CES组较常规组睡眠潜伏期缩短,总睡眠时间延长,睡眠效率增加,N2期、REM期睡眠时间和比例增加,组间比较差异有统计学意义。由于N2期是较N1期更深的睡眠状态,因此CES组较常规组更好地改善睡眠。本研究结果也显示两组患者干预前后慢波睡眠比例和REM潜伏期无显著差异。慢波睡眠减少和REM潜伏期缩短是抑郁症患者重要的生理指标,在治疗过程中甚至症状缓解后是稳定、不可逆的,具有跨状态稳定性,说明睡眠结构的改变是抑郁症患者的一个重要生理指标。结果同时提示,4周末两组HAMD评分均较基线降低,组间比较无统计学差异。8周末两组HAMD评分均降低,但CES组HAMD评分较常规组显著降低,差异有统计学意义。说明随着睡眠改善,抑郁症状也随之相应改善,而CES组较常规组对抑郁症状的改善更优,提示CES对抑郁症患者的睡眠及抑郁症状均有改善作用,在较长时间治疗后CES的治疗作用更加显著。
失眠是抑郁症的危险因素,患有失眠的患者容易患抑郁症,失眠严重的患者也预示着抑郁症症状的加重[24]。因此,失眠的改善,对抑郁症的治疗起到重要的作用,在治疗过程中,关注失眠及睡眠效率的改善,有助于抑郁症的治疗[58]。
在过去的十年中,越来越多的精神科医生将CES纳入临床实践,因其无创,几乎没有副作用,对抑郁、焦虑、失眠、双相障碍或其他器质性精神障碍均有疗效[911]。CES被认为会影响已知的调节情绪的皮层下大脑结构,例如网状激活系统、丘脑、下丘脑以及边缘系统,可能的机制是通过刺激下丘脑垂体轴调节疼痛信息、神经递质功能和激素产生的区域,引起脑电图的显著变化,α相对功率增加,δ相对功率降低[12]。增加的α值与改善的放松程度和心理警觉性或清晰度有关,从而改善睡眠和抑郁情绪[13]。
功能磁共振成像研究表明,CES到达了大脑的所有皮层和皮层下区域,产生的变化类似于抗焦虑药物引起的变化[14]。现已发现CES治疗可诱发精神疾病中涉及的神经激素和神经递质的改变:β内啡肽、肾上腺皮质营养激素和血清素的大量增加;褪黑激素和去甲肾上腺素的适度增加,胆碱酯酶、γ氨基丁酸和脱氢表雄酮的适度或未量化的增加,以及皮质醇的适度减少[1416]。
本研究样本量较小,且易与其他医学干预混杂,需要更进一步、大样本量的临床研究来证实CES对失眠及抑郁的作用。
