Parkin通过抑制神经元内铁死亡信号减轻机械性神经元损伤
2022-09-13武秀权吕伟豪费晓炜豆雅楠
武秀权,吕伟豪,费晓炜,吴 霜,何 鑫,豆雅楠,郇 宇,贾 博,费 舟
(空军军医大学西京医院神经外科,陕西 西安710032)
创伤性脑损伤(traumatic brain injury,TBI)作为临床上常见的急危重症之一,其致死率和致残率均较高[1]。TBI的核心是神经元损伤,大量的神经元损伤导致后期神经功能缺失。TBI包括原发性脑损伤和继发性脑损伤,临床医务人员的主要任务是防治继发性脑损伤[2],因而,针对继发性损伤防治的新方法一直是研究的热点。
铁死亡是近年发现的一种独特的细胞死亡模式,不同于凋亡、坏死及自噬性死亡,该过程没有核形态变化、DNA片段化和胱天蛋白酶活化,也不能被其他细胞死亡抑制剂所逆转[3]。研究证实,铁死亡与神经退行性疾病和急性神经损伤背景下的神经元转归密切相关[45]。然而,有关TBI后神经元铁死亡信号改变及作用的报道较少,相关机制有待进一步阐明。
Parkin是与神经退行性疾病密切相关的一个蛋白质分子,其突变会导致早发性帕金森病,本质是一种E3泛素连接酶,广泛参与细胞内线粒体自噬、蛋白降解及转录调控等过程[6]。研究表明,Parkin可在急性缺血性卒中发挥神经保护作用[7],而其与TBI的关系尚未阐明。因此,本研究利用小鼠原代皮层神经元机械性损伤模型,探究伤后Parkin的表达、作用及其对铁死亡信号的调控机制。
1 材料与方法
1.1 材料
C57BL/6孕鼠(孕15~16 d)32只由空军军医大学实验动物中心提供。动物饲养于23~25 ℃恒温环境中,光照条件为12 h黑暗/12 h光照连续循环,给予小鼠充足水和食物。处理动物严格遵守空军军医大学实验动物中心制定的实验动物使用指南。
1.2 方法
1.2.1 原代皮层神经元培养 取孕15~16 d C57BL/6小鼠1只,脱臼处死后,严格无菌操作,逐层小心剪开皮肤皮下组织、腹膜,分离胎盘胎鼠,收集胎鼠脑组织。显微镜下去除脑膜,分离皮层,并转移至预冷培养基中。用虹膜剪剪碎皮层,加入适量2.5 g/L胰酶溶液,混匀后放置于细胞孵箱,消化20~25 min,每隔5 min摇动培养皿1次。将消化过的皮层组织与适量培养基混匀,并通过75 μm细胞筛网,收集细胞悬液。调整细胞密度,种板。4~6 h后,用含B27的Neurobasal培养基给神经元换液,并每隔2~3 d换液。7 d后待神经元成熟,做相应处理。
1.2.2 机械性神经元损伤模型和分组 本研究在MUKHIN等[8]建立的离体神经元机械性损伤模型基础上,进一步改进和完善相关流程。以10 μL的微量移液器枪头于培养皿内划割,造成机械性损伤,划伤道宽度为1.2 mm,两相邻划伤道间隔3.5 mm。依据预先在培养皿底面画好的标记线(16培养皿)划割神经元,标记线均匀分布在培养皿底面,保证细胞损伤程度和范围一致。实验分为对照组、损伤组、损伤+Parkin过表达慢病毒组及损伤+对照病毒组,每组使用8只小鼠。
1.2.3 免疫荧光 3 mL/L的Triton X-100溶液破膜10 min,破膜后各组加适量驴血清封闭1 h。PBS漂洗细胞爬片,洗3~5遍,每遍持续3~5 min,洗完后各组加适量一抗(Parkin:Gennetex公司,货号为GTX39745,稀释比例为1∶200),湿盒置于4 ℃过夜孵育。PBS漂洗细胞爬片,洗3~5遍,每遍持续3~5 min,洗完后各组加适量二抗,室温孵育2~3 h。PBS漂洗细胞爬片,洗3~5遍,每遍持续3~5 min。洗完后用DAPI染液衬染细胞核,染色6~10 min。PBS漂洗、封片,激光共聚焦显微镜下拍照观察。
1.2.4 Western blotting 按照配胶试剂盒说明书要求,配制80~120 g/L分离胶及60 g/L浓缩胶。加样孔中分别加入预染Marker及蛋白样品,每孔20~40 μg,电泳时设置上层胶恒压90 V、下层胶恒压120 V,直至蓝色线条下降至玻璃板底端。电泳结束后,将夹子置于预冷转膜液中,向夹子黑面上依次放置海绵衬垫、双层滤纸、电泳凝胶、聚偏二氟乙烯膜、双层滤纸、海绵衬垫,建立转膜条件,设置恒压100 V,转膜90 min。然后将条带置于装有封闭液的平皿中,摇床设定50~60 r/min,封闭1 h。封闭结束后,用一抗稀释液稀释一抗(Parkin:Gennetex公司,货号为GTX39745,稀释比例为1∶500;GPX4:CST公司,货号为52455S,稀释比例为1∶800;ACSL4:Abcam公司,货号为ab155282,稀释比例为1∶300;GAPDH:Abcam公司,货号为ab8245,稀释比例为1∶1 000),并将抗体稀释液及条带装入封膜袋中,4 ℃冰箱过夜。冰箱取出封膜带后,将条带取出并置于装有吐温磷酸缓冲液的平皿中,摇床设定70~80 r/min,洗3~4遍。然后用二抗稀释液稀释二抗,将条带置于装有二抗稀释液的抗体孵育盒中,摇床设定50~60 r/min,避光孵育1 h。孵育结束后进行发光检测,利用Image J图像处理软件进行灰度统计分析。
1.2.5 慢病毒转染 本实验所需的过表达慢病毒载体均委托上海吉凯化学基因公司构建,慢病毒分别于细胞培养第7日感染神经元,感染指数为10,感染72 h后予以换液,培养第10日予以造模处理。
1.2.6 细胞活力检测 细胞活力检测基于CCK-8测定法,并采用细胞增殖与毒性检测试剂盒(七海公司,中国上海)进行检测。96孔板接种细胞悬液(200 μL/孔),并进行相应处理。处理结束后,各孔加入20 μL反应液,混匀。并设置空白对照组及背景对照组。在细胞培养箱中继续孵育2 h。酶标仪检测各处理组A450 nm值,并计算各组相对细胞活力。
1.2.7 活性氧(reactive oxygen species,ROS)检测 配制2,7二氯二氢荧光素乙酰乙酸(2′,7′-dichlorodihydro fluorescein diacetate,H2DCFDA)(赛默飞公司,中国苏州)储存液(2 mmol/L),溶剂为二甲基亚砜;配制H2DCFDA工作液(5 μmol/L),溶剂为常规培养基。吸除各处理组培养基,加入适量H2DCFDA工作液,细胞培养箱中避光孵育1 h。吸除工作液,PBS洗3遍。荧光酶标仪检测各组荧光强度(激发波长480 nm,发射波长530 nm),并计算ROS含量。
1.2.8 脂质过氧化(lipid peroxidation,LPO)水平检测 本实验采用测定丙二醛(malondialdehyde,MDA)及4羟基壬烯醛(4-hydroxynonenal,4-HNE)相对含量检测LPO水平,严格根据试剂盒说明书进行实验(MDA检测试剂盒:碧云天公司,中国上海;4-HNE试剂盒:西唐公司,中国上海),使用酶标仪测定各组A值,并利用试剂盒所提供的标准品绘制标准曲线,计算各实验组MDA及4-HNE相对含量。
1.2.9 Fe2+水平检测 加裂解液裂解各处理组细胞,置于摇床裂解2 h后,把细胞刮下待用;按照Fe2+检测试剂盒(普利莱公司,中国北京)步骤检测各组细胞Fe2+水平。
1.2.10 总谷胱甘肽(total glutathione,GSH)检测 PBS洗涤各处理组细胞,用细胞刮刀把细胞刮下,离心收集细胞,弃上清;按照GSH试剂盒(碧云天公司,中国上海)的步骤检测各组细胞内GSH水平。
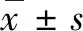
2 结果
2.1 机械性损伤后神经元内Parkin表达上调
免疫荧光染色结果显示,对照组Parkin表达水平较低(图1A),机械性损伤24 h后,Parkin表达增加(图1B)。进一步通过Western blotting检测发现,机械性损伤后Parkin表达上调,在伤后24 h出现峰值(图2A~B)。考虑到Parkin表达水平在伤后24 h水平最高,后续实验均以此时间点作为条件。
A:对照组;B:损伤 24 h组。标尺为20 μm。图1 机械性损伤后神经元Parkin免疫荧光染色

A:Western blotting检测;B:Parkin表达水平定量结果。aP<0.05 vs 对照组。图2 机械性损伤后神经元Parkin的Western bloting检测
2.2 Parkin减轻机械性损伤导致的细胞活力下降及氧化应激
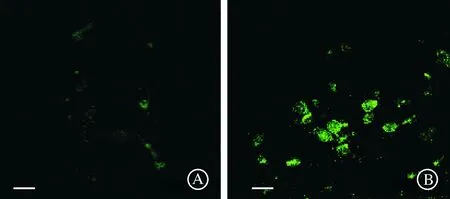
通过检测细胞活力发现:与对照组相比,损伤组细胞活力下降;与损伤+对照病毒组相比,Parkin可减轻损伤所导致的细胞活力下降(P<0.05,图3A)。进一步ROS检测结果显示,与对照组相比,损伤组ROS水平增加;与损伤+对照病毒组相比,Parkin可减轻损伤所导致的ROS增加(P<0.05,图3B)。
A:神经元机械性损伤24 h后细胞活力检测;B:神经元机械性损伤24 h后ROS检测。aP<0.05 vs 对照组;cP<0.05 vs 损伤+对照病毒组。图3 细胞活力和ROS检测
2.3 Parkin减轻LPO
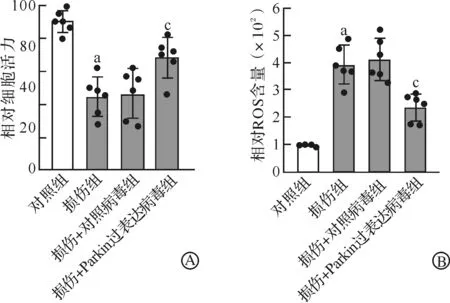
通过检测LPO标志物MDA和4-HNE发现,与对照组相比,损伤组LPO水平增加(P<0.05,图4);与损伤+对照病毒组相比,Parkin可减轻损伤所导致的LPO水平增加(P<0.05,图4)。
A:神经元机械性损伤24 h后MDA检测;B:神经元机械性损伤24 h后4-HNE检测。aP<0.05 vs 对照组;cP<0.05 vs 损伤+对照病毒组。图4 LPO检测
2.4 Parkin通过GPX4/ACSL4途径抑制胞内铁死亡信号
通过检测细胞内Fe2+水平发现,与对照组相比,损伤组Fe2+增加;与损伤+对照病毒组相比,Parkin可减轻损伤所导致的Fe2+增加(P<0.05,图5A)。进一步GSH检测结果显示,与对照组相比,损伤组GSH水平减少;与损伤+对照病毒组相比,Parkin可增加神经元内GSH水平(P<0.05,图5B)。Western blotting检测发现,与对照组相比,损伤组ACSL4表达增加、GPX4表达减少;与损伤+对照病毒组相比,Parkin可缓解损伤所导致的ACSL4表达增加和GPX4表达减少(P<0.05,图5C~E)。
3 讨论
TBI是临床上常见的急性脑损伤之一,其致病机制复杂,除外力导致的原发性损伤外,炎症、缺氧、缺血、离子紊乱等引起的继发性脑损伤是目前防治的关键[9]。继发性脑损害最终导致神经元损伤,进而引起神经功能丧失,因此,寻找内源性神经保护因子变得尤为重要。本研究发现,Parkin作为一种重要的神经保护蛋白分子可有效减轻机械性神经元损伤,其保护机制与铁死亡信号通路密切相关。
本研究首先发现,Parkin在损伤后表达水平上调,这与文献[10]报道一致,表明Parkin可能是神经元抵抗多种损害的一种内源性神经保护机制。本研究同时也发现,机械性损伤24 h后Parkin出现峰值,该时间点与WU等[11]的研究结果类似。另有研究发现,用解偶联剂处理胶质细胞,Parkin在伤后6 h出现表达高峰[12],这提示在不同的损伤模型和不同的细胞模型下,Parkin发挥的作用可能存在差别,具体机制仍需进一步深入研究。
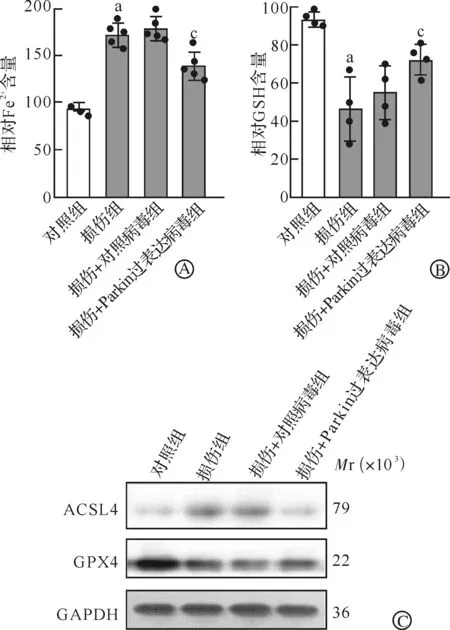
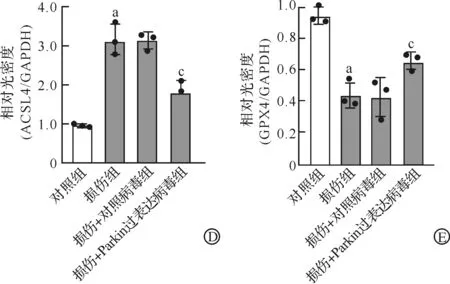
A:神经元机械性损伤24 h后Fe2+检测;B:神经元机械性损伤24 h后胞内GSH检测;C~E:神经元机械性损伤24 h后Parkin对铁死亡信号通路调控分子GPX4和ACSL4蛋白表达水平的影响。aP<0.05 vs 对照组;cP<0.05 vs 损伤+对照病毒组。图5 神经元铁死亡信号通路检测
本研究还发现,Parkin可通过减轻氧化应激和LPO起神经保护作用,这与前期研究结果一致[1314]。上述调控作用可能与Parkin的E3泛素连接酶性质以及靶向降解或修饰参与线粒体和内质网代谢的关键分子(ATF4、MFN2等)有关。此外,Parkin也是线粒体自噬经典途径PINK1-Parkin通路上的枢纽分子,而线粒体自噬与神经元内氧化应激密切相关。
重要的是,本研究发现,Parkin可通过调控ACSL4/GPX4铁死亡信号轴减轻机械性神经元损伤。铁死亡与TBI密切相关,ACSL4广泛参与脑创伤后神经元损害[15],但Parkin究竟如何调控ACSL4仍需进一步研究。本研究发现,Parkin可调控GPX4和GSH代谢,而GSH是神经元内重要的一类抗氧化物质,但这种调控是直接还是间接,仍需要进一步研究。至今尚未有研究公开报道Parkin与铁死亡之间的调控关系,但铁死亡与自噬关系密切,前期研究发现自噬通路枢纽分子如Beclin 1参与调控铁死亡进程[16],而Parkin作为自噬关键调控分子之一,因此,自噬可能在Parkin与铁死亡间发挥“纽带作用”。
本研究存在以下不足:第一,本研究主要利用小鼠原代皮层神经元开展离体研究,证据说服力有待通过在体动物研究进一步加强;第二,本研究主要通过过表达Parkin开展分子机制研究,而敲低Parkin或敲除Parkin对神经元的影响仍不得而知,研究有待进一步完善。
