ABHD6抑制剂WWL70对小鼠高原颅脑损伤后神经功能的保护作用
2022-09-13张昊阜子武秀权葛俊苗蒋晓帆
张昊阜子,武秀权,邹 鹏,廖 丹,葛俊苗,罗 鹏,蒋晓帆
(空军军医大学西京医院神经外科,陕西 西安 710032)
颅脑创伤(traumatic brain injury,TBI)是一种临床常见的创伤性疾病,占全身各部位创伤的9%~21%,但致死率及致残率均处于首位[1]。青藏高原常住人口超过1 000万,依照我国国情,十分有必要加强对高原人群健康的关注[2]。高原地区空气稀薄、氧分压低,可引起机体低氧[3],这使得高原环境下的TBI具有特殊性,需要进一步深入研究探讨。内源性大麻素系统中的α/β水解酶结构域6(α/β hydrolase domain 6,ABHD6)是一种具有丝氨酸水解酶活性的膜蛋白分子,主要表达在富含免疫细胞的组织和中枢神经系统[4],而内源性大麻素系统是一种脂质信号转导系统,在中枢神经系统功能的调节中起重要作用[5]。既往的研究证实,选择性ABHD6抑制剂可能改善TBI和其他神经退行性疾病的预后[6]。本研究以高原TBI后应用ABHD6抑制剂为干预模式,探讨ABHD6抑制剂WWL70对小鼠高原TBI伤后神经功能的保护作用。
1 材料与方法
1.1 材料
本实验采用8周龄左右健康雄性C57小鼠,由空军军医大学实验动物中心提供。领取小鼠后,动物饲养温度控制在20~25 ℃,实验室明暗交替时间为12 h ∶12 h,自由进食与饮水。所有动物实验均经空军军医大学动物伦理委员会批准(许可证号:20210421)。C57小鼠适应性喂养1周后,将60只小鼠随机分为平原组(Sham组)、高原组(HA组)、平原TBI组(TBI组)、高原TBI组(TBI+HA组)、高原TBI溶剂组(TBI+HA+DMSO组)和高原TBI抑制剂组(TBI+HA+WWL70组),每组10只。
1.2 方法
1.2.1 高原TBI模型的建立 本实验采用可控皮层局灶性打击模型模拟TBI损伤。沿颅骨正中线纵行切开头皮分离至颅骨,对矢状缝右旁2.0 mm、冠状缝后2.0 mm处颅骨进行钻孔,形成直径约4.0 mm的圆形骨窗,保持局部硬脑膜完整。随后使用PCI3000精细颅脑损伤器(Hatteras公司,美国)配合直径3.0 mm的金属棒撞击骨窗,撞击深度1.0 mm、撞击持续时间120 ms、撞击速度3 m/s,造成右侧大脑皮层局灶性损伤,然后将小鼠头皮缝合。在小鼠完成TBI造模后,将HA组、TBI+HA组、TBI+HA+DMSO组和TBI+HA+WWL70组放入小型动物实验用环境模拟舱(由空军军医大学军事生物医学工程学系与苏州市利安特医疗设备有限公司联合研制),在模拟海拔6 000 m缺氧条件下进行连续饲养,Sham组、TBI组置于当地(西安)海拔约400 m进行饲养。
1.2.2 药物干预 ABHD6抑制剂WWL70按照10 μg/g的浓度、10 μL/g的剂量进行小鼠腹腔给药,对照溶剂DMSO按照100 ng/g的浓度、10 μL/g的剂量进行小鼠腹腔给药,给药时间为TBI造模后1、3、5、7 d。给药时需将小动物模拟舱恢复至当地海拔高度,需给药的动物从舱内取出后给药,其他动物仍放置在舱内,待给药完成后将模拟舱恢复至模拟海拔6 000 m的缺氧环境。
1.2.3 运动功能检测 ①平衡木实验:平衡木装置由长120 cm、宽30 cm、悬挂于离地30 cm的横梁组成。在造模前训练小鼠在横梁上行走,并且选择在50个步态中表现出小于5次错误的小鼠进行后续实验分组。在造模后1、7、14、28 d进行平衡木实验,并记录每50个步态出现错误的次数。②转棒实验:将小鼠置于直径为10~15 cm的滚筒上,初始转速为5 r/min,逐渐增加转速至40 r/min,直至小鼠从滚筒上掉下为止,小鼠在滚筒上坚持奔跑的时间为衡量小鼠运动功能的标准。在造模后1、7、14、28 d进行转棒实验,并记录小鼠从开始奔跑到掉落的潜伏时间。
1.2.4 认知功能检测 ①旷场实验:旷场实验装置为开口的黑色木盒(内部场地大小为81 cm × 81 cm,高28 cm),盒底漆成纵横各3条白线(宽3 mm),从而形成16个等大的方格(每格大小20 cm × 20 cm)。将小鼠放入4个拐角方格中,让其自由探索环境5 min。在造模后14、28 d进行旷场实验,并记录走出方格的潜伏期、跨越方格总数和周边时间。②高架十字迷宫实验:高架十字迷宫包括50 cm×10 cm的两个相对开臂和两个50 cm×10 cm×40 cm的相对闭臂,闭臂的上部是敞开的。迷宫中央有一个10 cm×10 cm的开阔部,迷宫距离地面50 cm高。迷宫上方安装录像监控器,以录制动物在迷宫中的活动情况。将实验动物放入迷宫中央区,头朝开臂,并注意此后每只实验动物均放在同一位置。同时开启摄像监控器记录5 min内实验动物开臂和闭臂的进入次数及进入各臂的时间。开臂进入次数百分比=开臂进入次数/(开臂进入次数+闭臂进入次数),开臂滞留时间百分比=开臂滞留时间/(开臂滞留时间+闭臂滞留时间)。在造模后14、28 d进行高架十字迷宫实验,并记录开臂进入次数百分比和开臂滞留时间百分比。
1.2.5 HE染色 将小鼠脱颈处死后,在冰上迅速分离全脑,浸泡于40 g/L多聚甲醛溶液内,待完全固定后对各组小鼠脑组织进行HE 染色,在光镜下观察其病理改变。每组选取 5个400倍海马CA1区视野进行拍照,并记录变性锥体细胞数。
2 结果
2.1 模拟高原环境加重小鼠TBI后的运动功能障碍
在建立高原TBI小鼠动物模型后,分别在伤后1、7、14、28 d进行平衡木实验和转棒实验,检测小鼠运动功能改变。在正常海拔高度条件下,与Sham组相比,TBI后1、7 d会出现步态错误增加和转棒掉落潜伏期缩短(P<0.01),TBI后14、28 d无明显差异,表明TBI后的运动功能损伤可自行恢复。而在模拟6 000 m海拔高度条件下,与HA组相比,TBI+HA组在伤后1、7、14、28 d均出现步态错误增加和转棒掉落潜伏期缩短(P<0.01);与TBI组相比,TBI+HA组在伤后14、28 d运动功能明显下降(P<0.01),表明高原缺氧环境会抑制损伤后神经功能恢复(图1)。
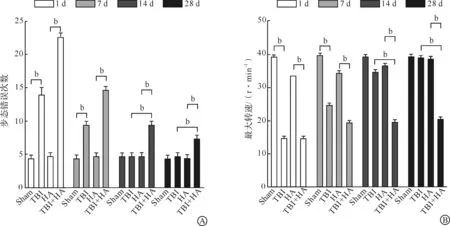
A:平衡木实验;B:转棒实验。Sham:平原组;TBI:平原创伤性脑损伤组;HA:高原组;TBI+HA:高原创伤性脑损伤组。bP<0.01。图1 正常海拔、高原情况下TBI后的平衡木与转棒实验
2.2 模拟高原环境引起小鼠TBI后的认知功能损害
进一步的高架十字迷宫实验和旷场实验显示,与Sham组相比,正常海拔高度下小鼠在TBI后14、28 d的开臂进入次数百分比、开臂滞留时间百分比、总运动距离和内区运动百分比均未见明显改变。而在模拟6 000 m海拔高度条件下,与HA组相比,TBI+HA组在伤后14、28 d均出现开臂进入次数百分比和开臂滞留时间百分比下降(P<0.01)、总运动距离以及内区运动百分比下降(P<0.01);与TBI组相比,TBI+HA组在伤后14、28 d认知功能明显下降,表明高原缺氧环境会导致TBI后出现明显的认知功能损害(P<0.01,图2)。
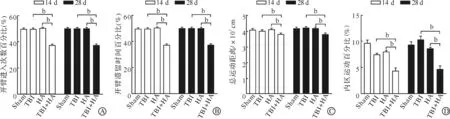
A~B:高架十字迷宫实验;C~D:旷场实验。Sham:平原组;TBI:平原创伤性脑损伤组;HA:高原组;TBI+HA:高原创伤性脑损伤组。bP<0.01。图2 高原环境TBI对小鼠认知功能的影响
2.3 ABHD6抑制剂WWL70促进高原TBI后神经功能的恢复
通过腹腔注射WWL70抑制ABHD6活性,对模拟6 000 m海拔高度下小鼠TBI后运动功能恢复情况进行检测。与TBI+HA+DMSO组相比,TBI+HA+WWL70组在伤后7、14、28 d步态错误减少、转棒掉落潜伏期延长(P<0.01)。与TBI+HA+DMSO组相比,TBI+HA+WWL70组在伤后14 、28 d开臂进入次数百分比和开臂滞留时间百分比增加(P<0.01)、总运动距离和内区运动百分比增加(P<0.01)。上述结果表明,抑制ABHD6活性可明显改善高原缺氧环境导致的运动及认知功能障碍(图3)。
2.4 抑制ABHD6可减轻高原TBI导致皮层和海马区域神经元损伤
根据上述神经功能学实验结果,可以初步认定高原低氧环境会加重TBI后的神经功能损害。进一步对TBI+HA+DMSO组和TBI+HA+WWL70组在伤后28 d进行脑组织HE染色检测,明确结构与功能改变之间的相关性。在TBI+HA+DMSO组小鼠运动皮层功能区可观察到椎体神经元细胞发生变性、结构紊乱,而TBI+HA+WWL70组运动皮层功能区的变性椎体神经元细胞数量明显减少。同时,在小鼠海马区也可观察到TBI+HA+WWL70组的变性神经元较TBI+HA+DMSO组数量明显减少。这些结果提示,ABHD6抑制剂改善高原TBI后神经功能与减轻脑组织神经元变性有关(图4)。

A:高原创伤性脑损伤抑制剂组运动皮层功能区;B:高原创伤性脑损伤溶剂组运动皮层功能区;C:高原创伤性脑损伤抑制剂组海马区;D:高原创伤性脑损伤溶剂组海马区。HE×400。图4 运动皮层与海马神经元HE染色
3 讨论
在我国,高原地区地理位置突出,面积广阔且人口众多,对高原TBI进行深入研究具有重大意义。但目前对高原TBI的伤情特点及救治策略的研究仍相对薄弱,对它的病理生理机制了解也十分有限。因此,需要进行大规模临床实验研究,并不断改善救治指南、方案,方可提高救治成功率、改善预后、提高生存质量。高原缺氧环境下发生的急性TBI可能较平原严重,如果创伤前伴有其他高原特发疾病,将致使TBI病情表现更加复杂和严重,治疗更加棘手。高原TBI发生后,脑的结构、神经元的组织病理表现是否发生改变,颅内压、脑血流、脑组织氧分压、脑细胞微环境的代谢等生理、生化状况将会产生哪些变化,这些都需要我们进一步深入研究探讨,更加了解高原TBI的病理生理机制,为临床治疗提供理论基础。
对于中枢神经系统,以往的研究主要关注ABHD6在神经元中的作用及机制,特别是作为突触后2-AG的主要水解酶,参与调节神经元内源性大麻素系统[7]。此外,作为突触后膜蛋白分子,ABHD6是AMPA受体(AMPA receptor,AMPAR)复合体的重要组成部分,可抑制AMPAR向突触后膜转位和AMPAR的兴奋性[8]。由于ABHD6广泛表达,其在不同组织中的生理和病理作用需要在细胞、动物和临床研究中彻底阐明[7]。ABHD6在神经炎症途径[910]和自身免疫[1112]中起着潜在的调节作用,有望成为神经系统疾病干预的新靶点[13]。ABHD6抑制剂已在镇痛、抗焦虑、抗炎以及其他领域取得一定进展[6],其在中枢神经系统疾病治疗中的潜在作用正在逐渐被探索。
已有研究证实,ABHD6抑制剂对TBI患者有益。在TBI中,兴奋毒性、神经炎症和氧化应激介导的继发性损伤部分是由于2-AG增加不足,无法抵消这些病理过程[14]。WWL70是ABHD6抑制剂,可改善TBI小鼠的运动协调和工作记忆能力,但不影响空间学习或记忆损伤[15]。本实验初步证明在模拟海拔6 000 m低压低氧环境下,低氧影响TBI小鼠海马组织的正常生理结构以及行为学指标。使用WWL70干预后,高原TBI小鼠运动功能有所提高,认知能力明显改善。WWL70对高原TBI小鼠的预后及脑功能防护具有一定的促进作用。尽管WWL70已被用于探索ABHD6抑制剂在TBI中的作用,但仍需应用遗传工具和更具选择性的ABHD6抑制剂进行验证[15]。
