基于入院指标的新型风险评分模型在成年重型颅脑损伤预后评估中的价值
2022-09-13贺亚龙殷安安武秀权蒋晓帆
贺亚龙,殷安安,何 鑫,武秀权,蒋晓帆,费 舟,林 伟
(空军军医大学西京医院神经外科,陕西 西安 710032)
颅脑损伤(traumatic brain injury,TBI)的发生率和致死率极高,其救治充满挑战,尤其是重型颅脑损伤(severe traumatic brain injury,sTBI)[1]。近20年来,国内外学者对sTBI的研究逐步深入并取得了巨大的进步,但其临床救治效果仍不乐观,且缺乏早期、简单、准确的预后评估方法[23]。格拉斯哥昏迷评分(Glasgow Coma Scale,GCS)是最常用和最重要的评估TBI预后的指标,在一定程度上可以预测sTBI患者的神经功能缺损情况及死亡率[4]。但愈来愈多的研究发现TBI的预后不仅仅取决于患者GCS,还与入院影像学检查以及血液检验结果等因素密切相关[58]。尽管有研究提出S100B、神经元特异性烯醇化酶等一系列TBI特异性的生物标志物与患者预后相关[910],但其检测过程复杂,且耗时长、成本高,临床推广难度较大。因此,建立新型预后评估体系将有助于改善TBI患者治疗,具有十分重要的应用前景。本研究拟通过分析入院常规采集的临床和生化指标,构建基于多项参数的新型风险评分模型,以实现对sTBI患者预后的早期、简单、准确、综合的评估。
1 对象与方法
1.1 对象
回顾性收集空军军医大学西京医院神经外科自2011年10月至2020年10月收治的sTBI患者439例。纳入标准:①GCS≤8分;②年龄≥18岁;③有明确颅脑外伤史;④发病至入院≤24 h;⑤法定监护人已签署知情同意书。排除标准:①晕厥后倒地受伤,无法排除自发性脑出血;②入院1 d内死亡;③住院治疗过程中自动放弃治疗。患者人口学资料及临床信息已在相关参考文献[11]中详细报道。
1.2 方法
1.2.1 治疗方案 在纳入本次研究的患者中,接受手术治疗329例,非手术治疗110例。手术治疗:依据患者具体病情,参考国内成人sTBI手术治疗的相关专家共识[12],选取开颅血肿清除术、脑室外引流术、去骨瓣减压术等手术治疗方案。非手术治疗:依据患者具体病情,给予镇静、镇痛、降低颅压、预防癫痫、维持脑灌注压、维持离子平衡、营养支持等对症治疗,以及预防下肢深静脉血栓、肺部感染、早期康复训练介入等治疗方案[13]。
1.2.2 评价指标的收集 记录患者年龄、入院后首次GCS及入院后首次基本生命体征指标(如心率、体温、平均动脉压);入院0.5 h内留取肘静脉血液送西京医院检验科,进行血常规、离子、肾功能及凝血功能检测,采集血糖、血钾、血钠、肌酐、尿素氮、血小板计数 (platelet count,PLT)、凝血酶原时间国际标准化比值 (prothrombin time-international normalized ratio,PT-INR)、凝血酶原时间(prothrombin time,PT)及部分凝血活酶时间(activated partial thromboplastin time,APTT)。
1.2.3 预后评估及分组 根据出院时GCS将纳入本次研究的患者分为:①预后不良组(1~3分);②预后良好组(4~5分)。具体评分如下:1分,死亡;2分,植物生存状态;3分,重度残疾,无法独立生活;4分,轻度残疾,能在保护下工作;5分,正常生活。
1.2.4 风险评分模型的构建与评估 设定sTBI患者预后分组为状态变量,各项入院指标为检验变量,利用受试者工作特征(receiver operating characteristic,ROC)曲线分析各指标与预后分组之间的关系,将ROC曲线分析中P<0.05的入院指标纳入多因素logistic回归模型中,筛选能够独立影响sTBI患者预后分组的入院指标并计算对应的回归系数,构建基于这些入院指标和回归系数的线性数学组合,即多因素风险评分模型;采用约登指数和欧式指数确定最佳分组界值;采用ROC分析计算风险评分模型评估sTBI患者预后分组的准确度和敏感度。
1.2.5 统计学分析 采用SPSS 19.0和GraphPad Prism 5.0软件进行统计学分析,计量资料用¯x±s表示,采用两独立样本t检验进行组间比较;计数或等级资料以率(%)表示,采用2检验进行组间比较。在多因素logistic回归模型中,采用基于似然比检验的向前法筛选自变量,以比值比描述自变量与结局的关系。在ROC曲线模型中,采用ROC曲线下面积(area under ROC curve,AUC)比较各检验变量对状态变量的判断效能。在所有统计模型中,P<0.05表示差异有统计学意义。
2 结果
2.1 sTBI患者入院资料和预后分组情况
纳入的439例成人sTBI患者中,男性364例(82.9%),女性75例(17.1%),年龄(48.2±16.3)岁。入院时GCS:3分(118例,26.9%);4分(41例,9.3%);5分(21例,4.8%);6分(169例,38.5%);7分(12例,2.7%);8分(78例,17.8%)。入院首次心率(92.4±24.0)次/min、体温(37.0±0.5)℃、平均动脉压(97.7±14.4)mmHg。入院首次血糖(9.0±3.9)mmol/L、血钠(139.3±5.3)mmol/L、血钾(3.7±0.5)mmol/L、肌酐(89.8±49.9)μmol/L、尿素氮(5.6±2.5)mmol/L、PLT(184.9±85.7)×109/L、APTT(26.1±1.9)s、PT(12.1±1.9)s、PT-INR(1.0±0.2)。根据出院时患者格拉斯哥预后评分(Glasgow Outcome Scale,GOS),预后不良组348例,预后良好组91例。文献[11]报道:与预后良好组比较,预后不良组患者的年龄更高且基础疾病更多(P<0.05),其他因素包括性别、受伤方式、是否存在多发伤、颅内异物及脑疝情况、是否手术等差异无统计学意义(P>0.05)。
2.2 筛选对sTBI患者预后分组具有判断意义的入院指标
ROC曲线分析显示:对sTBI患者预后分组具有显著判断意义的入院指标包括患者年龄、GCS、心率、血糖、肌酐、尿素氮、血钾、APTT、PT及PT-INR等(均P<0.05,表1)。

表1 ROC曲线分析
2.3 构建和评估用于判断sTBI预后分组的风险评分模型
将ROC曲线分析中P<0.05的入院指标纳入多因素logistic回归分析,结果显示年龄、GCS、血糖及PT-INR是sTBI患者预后分组的独立影响因素(表2)。
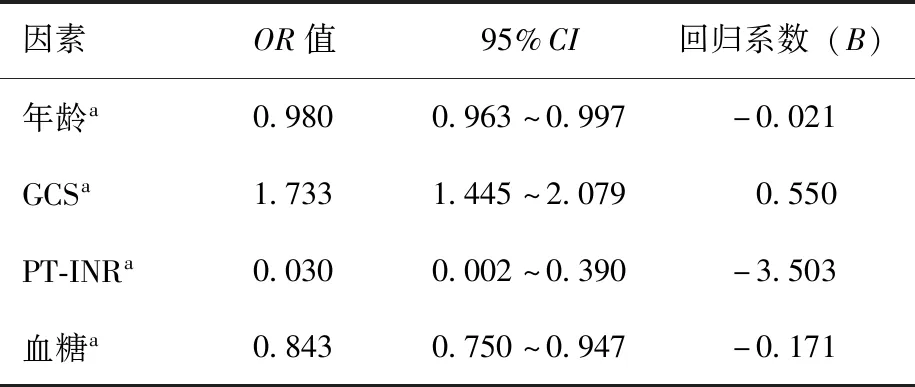
表2 多因素logistic回归分析
绘制年龄、GCS、血糖及PT-INR的ROC曲线(图1),并按如下公式构建风险评分方程:风险评分=入院GCS×0.550+入院血糖(mmol/L)×(-0.171)+入院PT-INR×(-3.503)+年龄(岁)×(-0.021)。
按照上述公式计算每位sTBI患者的风险评分,并将评分带入ROC曲线分析,结果显示:风险评分用于判断sTBI预后分组时,其AUC为0.807(95%CI:0.754~0.860,P<0.01;图1)。

图1 入院年龄、血糖、GCS及PT-INR评估sTBI患者预后分组的ROC曲线
通过计算设定最佳分组界值为-2.221,此时风险评分模型判断sTBI患者预后分组的AUC为0.752(95%CI:0.689~0.814,P<0.01);准确度:0.822;敏感度:0.670;约登指数:0.492;欧式指数:0.141(图2)。

图2 多因素风险评分模型评估sTBI患者预后分组的ROC曲线
3 讨论
由于sTBI病情复杂、进展迅速、临床预后差、救治难度高[1],因此,早期、简单、准确的预后评估方法对于临床救治十分重要。长期以来,神经外科医师一直在努力探寻简单易行的sTBI预后评估方法,以优化治疗策略,改善临床预后。本研究通过ROC曲线分析筛选出对sTBI患者预后分组具有显著判断意义(P<0.05)的入院参数,如患者年龄、GCS、心率、血糖、肌酐、尿素氮、血钾、APTT、PT、PT-INR。联合多因素logistic回归分析进一步确定年龄、GCS、血糖、PT-INR是影响患者预后判断的独立风险因素。因此,基于上述4项入院指标构建多参数风险评分模型,即风险评分=入院GCS×0.550+入院血糖(mmol/L)×(-0.171)+入院PT-INR×(-3.503) +年龄(岁)×(-0.021)。随后利用ROC模型检测该模型对sTBI患者预后的评估效能,发现该模型(AUC:0.807)显著优于单因素指标,包括入院GCS(AUC:0.744)、血糖(AUC:0.675)、PT-INR(AUC:0.653)以及年龄(AUC:0.581)等。为了方便临床使用,我们计算该模型的最佳分组界值为-2.221,并以此作为风险评分的分组界值,ROC曲线分析显示二分类后该模型在评估sTBI预后时仍展现出良好的判断效能(AUC:0.752;准确度:0.822;敏感度:0.670)。综上所述,本研究结果表明,基于年龄、入院GCS、血糖、PT-INR 4项参数的新型风险评分模型能够有效地评估sTBI预后。
入院GCS:入院GCS能够反映患者原发TBI的严重程度,是影响TBI患者预后的重要因素,其应用已十分成熟[4,7]。但需要注意的是,在某些特殊情况下GCS的应用会受到限制,例如对于气管插管、镇静或严重眶周肿胀的患者,其准确性往往受到影响[14];此外,GCS不能反映包括呼吸模式、脑干反应在内的精细体征变化,因此,GCS有时对于病情判断并不够准确[15]。综上所述,我们需要对基于GCS的sTBI预后评估体系进行补充、优化。
年龄:sTBI患者随年龄增长,其机体代谢水平降低,重要脏器功能衰退,其脑组织对缺血、缺氧耐受力下降,脑细胞自我修复能力减退,因此,老年sTBI患者往往病情进展迅速,预后较差。CHANTAL回顾性分析了5 600例sTBI患者年龄和预后的相关性,结果显示,小于35岁的患者不良预后和死亡的发生率分别为21%和39%,而55岁以上年龄组则上升至74%和52%,且每增加10岁其预后不良的概率增加40%~50%[16]。国内多项回顾性研究以及我们前期相关研究结果也证实了年龄是影响sTBI患者预后的重要影响因素,即年龄越大,预后不良风险越高[11,1718]。因此,上述研究均支持年龄因素是评估sTBI预后的重要参数。
血糖:高血糖是TBI后加重继发性脑损伤的重要因素,其可通过增加乳酸生成直接损伤脑组织,并可促进CO2生成、升高颅内压间接损害脑组织[1920]。sTBI患者往往会出现严重的应激反应,激活交感神经并导致儿茶酚胺大量释放[21]。儿茶酚胺的释放会促进胰高血糖素的分泌,最终升高血糖浓度[22]。国内外多项研究证实血糖程度可以反映TBI的严重程度,帮助判断sTBI预后[11,2324]。因此,本研究将入院血糖作为重要参数纳入sTBI预后评估体系。
凝血功能:TBI后血脑屏障破坏,大量组织因子的暴露导致机体凝血、纤溶和抗凝途径异常激活,破坏出血和凝血平衡,导致凝血功能障碍,可加重继发性脑损害[19,25]。既往研究表明TBI患者出现凝血功能异常的比例高达35.2%,与患者预后不良显著相关[26]。本研究结果显示入院PT-INR作为凝血功能的代表,是sTBI患者预后分组的独立影响因素,因此,我们亦将入院PT-INR纳入sTBI预后评估体系。
虽然近年来有研究提出S100B、神经元特异性烯醇化酶等一系列TBI特异性的生物标志物与TBI损伤程度密切相关,在评估TBI患者预后方面具有重要意义[910],但这些标记物的检测往往过程复杂、耗时长、成本高,临床推广难度较大。除患者年龄和GCS外,本研究所纳入的血糖及PT-INR检测均为临床常规检测项目,具有方便、快捷、经济等优势。综上所述,基于4项入院参数的新型风险评分模型代表了一种快速、准确的sTBI预后评估方法,未来如果能通过前瞻性研究方式在独立来源的患者队列中得到验证,该模型将有望为真实临床场景中sTBI患者的伤情判断、预后评估、治疗优化等提供有力指导。
