13C-尿素呼气试验诊断幽门螺杆菌准确率的影响因素*
2022-09-13潘慧陈毓岱郑晓玲何利平
潘慧 陈毓岱 郑晓玲 何利平
幽门螺旋杆菌(Hp)是全球公认的第一致癌因子,全球约44.3%的人群感染了这种微生物[1]。它是慢性胃炎、消化性溃疡、胃腺癌、MALT淋巴瘤等胃、十二指肠疾病的主要病因。成人及时诊断和根除Hp,可阻断胃黏膜的炎症变化,防止黏膜萎缩、肠化及不典型增生等癌前病变的发生、发展[2-3]。
Hp检测方法多种,尿素呼气试验(UBT)方法具有无创、方便、快速等优点,诊断准确性较高,其敏感性和特异性为96%~100%和93%~100%,是诊断Hp的常用方法[4-5]。然而,UBT方法因受检测药物剂型、疾病不同状态及药物排空时间等影响,可出现Hp的误诊或漏诊[6]。胃镜前服用祛黏液药物,术中注气、送水等操作可引起胃肠蠕动加快,胃排空增强,胃黏膜表面分泌物减少等变化,为进一步评估胃镜操作、药物剂型及胃黏膜萎缩状态对UBT检测的影响,本研究对福建省立金山医院接受麻醉胃镜检查的200例无Hp治疗史患者进行横断面分析,以探讨13C-UBT诊断Hp准确率的影响因素。
1 资料与方法
1.1 一般资料
回顾性分析2019年2月-2021年9月在本院行麻醉胃镜检查且无Hp治疗史患者200例。纳入标准:首次行麻醉胃镜检查及Hp检测,且无Hp治疗史。排除标准:既往胃切除术后;1个月内有抗生素、铋剂或2周内有PPI服药史;急性上消化道出血。男105例,女95例;平均年龄(48.11±13.63)岁。
1.2 方法
1.2.1 检查方法 所有患者均进行麻醉胃镜检查前20 min口服达克罗宁胶浆(10 ml/支)和链霉蛋白酶(20 000单位/袋)各一份,选用奥林巴斯电子胃镜检查系统(主机:CV-290,胃镜:GIF-H260),于胃窦部取黏膜组织活检1块(大小约2 mm×2 mm)行快速尿素酶试验(RUT)检测Hp,另择其胃窦或胃体黏膜活检1块行组织病理苏木精-伊红染色(HE)检测Hp或行血清Hp抗体检测。胃镜检查前组及胃镜检查后组患者,分别在胃镜检查前或胃镜检查后2~3 h内进行13C-UBT。
1.2.2 判定标准 Hp判别诊断金标准:RUT、组织病理HE染色或血清Hp抗体诊断Hp,任何一项检测结果呈阳性则诊断为Hp阳性,所有检测方法均为阴性,则诊断为Hp阴性。13C-UBT:服用尿素(13C)试剂,颗粒剂型或胶囊剂型[海得威生物科技,含尿素(13C)75 mg],收集受试者服药30 min前后两次呼气,其服药30 min后检测值DOB≥4,为Hp阳性,DOB<4,则Hp为阴性。
1.2.3 胃黏膜萎缩程度 根据木村-竹本(C-O)分类法标准可以将内镜下胃黏膜萎缩程度分为:闭合性萎缩(C型:C1~C3)和开放性萎缩(O型:O1~O3)。萎缩程度及范围分级分别为:C1~C2(轻度),C3~O1(中度),O2~O3(重度)[7]。
1.2.4 分组情况 按照金标准将所有患者分为Hp+组和Hp-组,收集两组一般资料(性别、年龄、胃镜前后13C-UBT检测情况、胃黏膜萎缩程度、颗粒型胶囊型使用情况)。
1.3 统计学处理
本研究数据采用SPSS 22.0统计学软件进行分析和处理,计量资料以(±s)表示,计数资料以率(%)表示,组间比较采用Pearson χ2检验。Logistic回归分析胃镜检查前后、尿素剂型、C-O萎缩程度对13C-UBT诊断Hp准确性的影响,P<0.05为差异有统计学意义。
2 结果
2.1 两组一般资料
按照金标准将其分为Hp+组(113例)和Hp-组(87例),见表1。
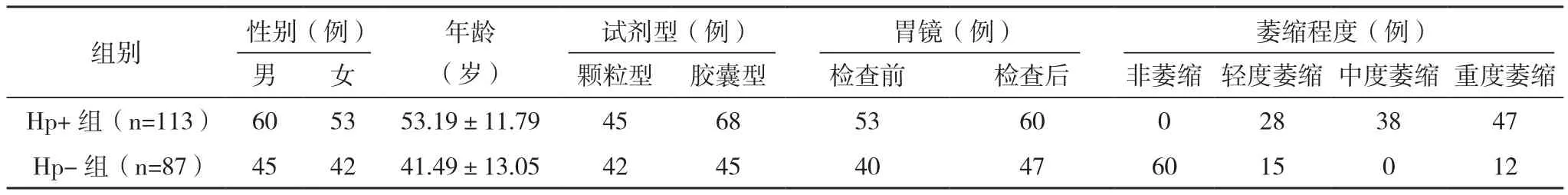
表1 两组一般资料
2.2 13C-UBT诊断Hp准确性的单因素分析
胃镜检查前93例和胃镜检查后107例,胃镜检查前及胃镜检查后13C-UBT诊断Hp的准确率分别为96.77%、82.24%,敏感度分别为94.34%、68.33%,胃镜检查前行13C-UBT诊断Hp的准确率高于胃镜检查后(χ2=10.731,P=0.001)。颗粒型尿素试剂87例,胶囊型尿素试剂113例,颗粒型和胶囊型尿素试剂13C-UBT诊断Hp的准确率分别是97.70%和82.30%,敏感度分别为95.56%和70.59%,颗粒型尿素试剂13C-UBT诊断Hp的准确率高于胶囊型尿素试剂(χ2=11.908,P=0.001)。黏膜重度萎缩59例和非重度萎缩141例(轻度43例,中度38例,非萎缩60例),黏膜重度萎缩13C-UBT诊断Hp的准确率低于非重度萎缩黏膜(χ2=19.915,P=0.000),见表 2。
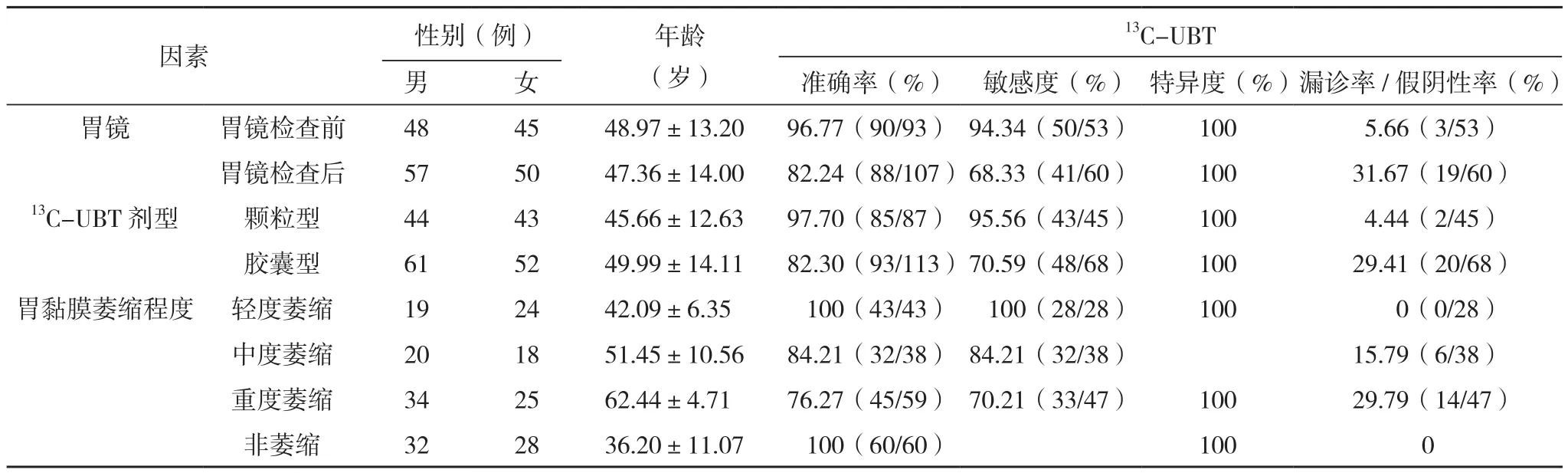
表2 13C-UBT准确性的单因素分析
2.3 13C-UBT诊断Hp准确性的多因素分析
Logistic回归分析结果,胃镜检查后、胶囊型尿素试剂及重度萎缩黏膜是13C-UBT诊断Hp准确率下降的危险因素(P<0.05),见表3。
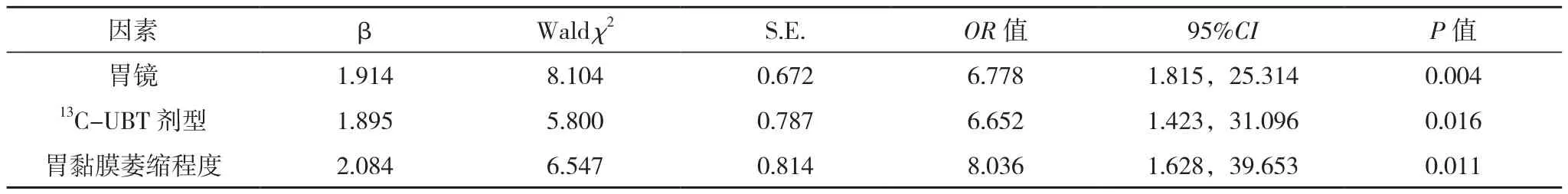
表3 13C-UBT诊断Hp准确性的多因素分析
3 讨论
Hp是胃癌最常见的致癌因子,其常用诊断有方法多种[8-9]。RUT具有快速、经济特点,是胃镜检查时最常用的Hp检测方法。Hp分布呈灶性聚集特点,随胃黏膜萎缩方向由胃窦迁移至胃体,伴黏膜萎缩加重,Hp定植密度降低,单一的、有创的RUT检测Hp易出现假阴性结果[5]。组织学检查仍是诊断Hp最常用的检测方法之一,其主要优点是不仅可以完成胃黏膜状态评估和癌前病变的诊断,同时HE染色可直接显示细菌分布状态。组织学诊断的特异性可高到100%,其敏感性受到取材质量、部位、数量、大小等影响,胃黏膜萎缩、肠化,Hp定植密度降低,Hp组织学诊断敏感性会下降[10]。血清抗体在Hp感染3~4周后出现在血液中,其检测不受近期使用质子泵抑制剂,抗生素和铋制剂,胃肠道出血,或胃黏膜萎缩等的影响[5]。广泛用于人群Hp筛查或既往无Hp治疗史对象[11]。本研究使用RUT、组织病理学或血清学等不同原理的两种/三种方法联合检测Hp作为“金标准”,可增强本研究结果的可靠性。
胃镜是食管、胃十二指肠病变的首选检查方法,不仅实现了胃黏膜病变肉眼可视诊断,而且可通过术中胃黏膜活检做病理组织学及细胞学检查。本研究所有对象均进行金标准检查,胃镜检查前行13C-UBT诊断Hp的准确率高于胃镜检查后(χ2=10.731,P=0.001),Logistic分析其优势比OR值大于1,提示胃镜操作后是造成UBT检测Hp准确率下降的危险因素(P<0.05)。患者胃镜后胃肠道蠕动加快,胃排空增强,尿素与黏膜接触时间缩短,且患者术前口服链霉蛋白酶配方液可有效祛除胃腔内黏液,降低胃黏膜表面尿素酶浓度,减弱尿素与尿素酶化学反应强度,是胃镜操作后13C-UBT检测Hp准确率下降的可能因素。
UBT为无创Hp检测方法,是Hp治疗后监测的首选检查方法,分为13C-UBT或14C-UBT两种。其工作原理:患者摄入含13C或14C标记的尿素,Hp会产生尿素酶将其分解为氨和13C/14C标记的二氧化碳,二氧化碳被吸收到血液,进入肺部,并随呼出的空气排出体外[4]。本研究分析两种不同剂型尿素试剂:胶囊型和颗粒型对13C-UBT检测Hp准确率的影响,颗粒型尿素试剂13C-UBT诊断Hp的准确率高于胶囊型尿素试剂组(χ2=11.908,P=0.001)。Logistic回归分析优势比OR值大于1,提示胶囊型尿素试剂是造成13C-UBT检测Hp准确率下降的危险因素(P<0.05)。推测可能是与胶囊或其内容物在胃腔内停留时间缩短,尿素与黏膜接触的时间缩短,胃排空增快等有关。是否可通过缩短服药前后两次呼气时间或降低DOB检测阈值来提高胶囊型13C-UBT诊断准确性,尚需进一步研究[12]。
胃黏膜萎缩程度在13C-UBT诊断Hp准确率的影响分析,黏膜重度萎缩13C-UBT诊断Hp的准确率低于非重度萎缩黏膜(χ2=19.915,P=0.000),其优势比OR值大于1,提示黏膜重度萎缩是造成13C-UBT检测Hp准确率下降的危险因素(P<0.05)。胃黏膜萎缩Hp定植密度减少,尿素酶浓度降低,是尿素酶方法检测Hp漏诊发生的可能原因。对于重度萎缩黏膜,采用多种方法联合检测Hp,可提高诊断的准确性[9]。
本研究存在不足:(1)本研究未对胃镜操作时间进行分析,不排除胃镜操作时长对胃肠蠕动的影响,继而干扰UBT结果。(2)胃黏膜活检部位未统一,RUT及组织学检查Hp取材部位未统一,胃黏膜萎缩状态不同,胃窦或胃体部Hp定植密度尚存在差异,不排除活检取材部位差异对结果的偏倚。(3)本研究为横断面回顾性分析,不排除选择性偏倚对研究结果的影响可能。
综上分析,胃镜操作后、胶囊尿素试剂及黏膜重度萎缩是13C-UBT诊断Hp准确率下降的危险因素。为提高13C-UBT诊断Hp准确性,建议胃镜检查前进行13C-UBT检查,同时可选择颗粒型尿素试剂用于13C-UBT检测Hp以提高诊断准确性。
