自拟益气养阴消癥通络方对糖尿病肾病的影响
2022-09-13文静刘妍
文静 刘妍
糖尿病肾病(diabetic nephropathy, DN)是一种常见于糖尿病患者的慢性并发症,也是导致终末期肾病(end stage renal disease, ESRD)发生的主要原因[1]。近些年随着我国糖尿病患者总人数的增加,DN所致ESRD也明显升高,给患者家庭及社会造成严重的影响。目前西医尚缺少治疗DN的特效方法,多采取综合措施延缓患者病情发展,但效果仍无法令人满意[2]。相关研究认为,微炎症反应、氧化应激在DN发生、发展过程中占有重要地位,而中药复方具有多途径、多靶点的药理效应作用,对治疗DN具有重要的临床意义[3]。中医理论认为DN属于“消渴病”“水肿”等范畴,尽管存在不同的病理机制,但均总属于本虚标实[2]。潜江市中心医院采用自拟益气养阴消癥通络方治疗DN患者,对于减轻患者微炎症状态及氧化应激具有较好的效果,现报道如下。
1 资料与方法
1.1 一般资料
90例DN患者均为本院肾病风湿科2018年7月-2020年12月收治的患者,纳入标准:(1)均符合文献[4]DN的相关诊断标准;(2)年龄均大于18岁。排除标准:(1)对方剂中的中药成分有严重过敏反应;(2)合并有炎症感染反应、免疫系统疾病、恶性肿瘤疾病;(3)合并有其他肾脏疾病;(4)合并有心、肝、脑等重要脏器疾病;(5)近期服用对肾脏功能有明显损伤药物。所有患者遵循数字表法随机分为对照组和观察组,各45例。两组患者基线资料比较,差异无统计学意义(P>0.05),有可比性,见表1。两组患者治疗前均详细了解研究方案并签字。本研究方案经潜江市中心医院伦理委员会审核批准通过。
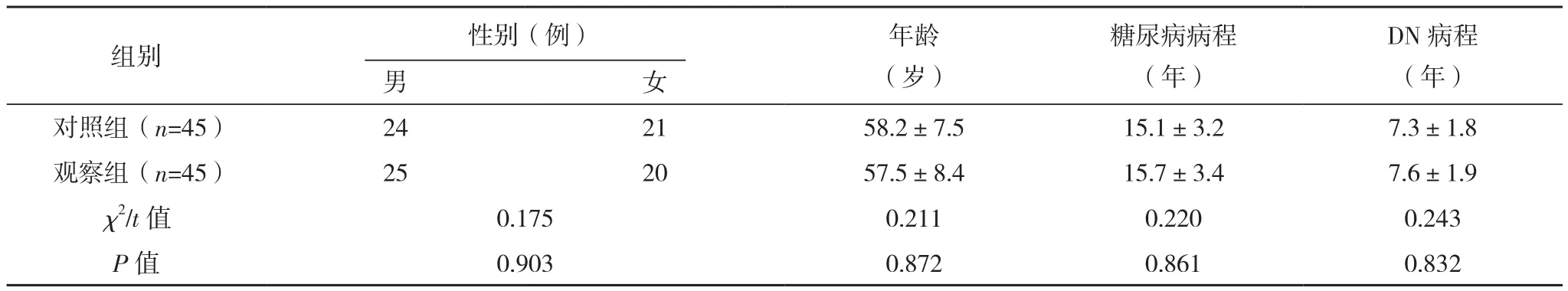
表1 两组基线临床资料比较
1.2 方法
对照组患者入院后均予以卫生宣传教育、制订科学合理的饮食方案、控制血糖平稳状态(胰岛素,江苏万邦生化医药股份有限公司,国药准字H32020614,皮下注射,剂量根据血糖、病情、尿糖等从小剂量开始)、控制血压平稳状态(厄贝沙坦片,杭州赛诺菲制药有限公司,国药准字J20171089,口服,0.15 g/次,1次/d开始,可适当增加剂量至0.3 g/次,1次/d)、调节血脂(阿托伐他汀钙,辉瑞制药有限公司,国药准字H20051408,口服,10 mg/d,1次/d)及适当锻炼运动等综合措施治疗。观察组在对照组基础上加用自拟益气养阴消癥通络方治疗,方剂配方主要成分为:黄芪25 g,生地 20 g,丹参 25 g,地龙 10 g,水蛭 10 g,鳖甲15 g,大黄 10 g,砂仁 7 g,1 剂 /d,水煎后分早晚2次服用。同时根据患者病情具体变化对上述中药成分予以加减,口渴临床症状明显的患者方剂中需加天花粉和葛根各20 g,燥热临床症状明显的患者方剂中需加龟板15 g和知母10 g,腰膝酸软临床症状明显的患者方剂中需加仙茅和淫羊藿各15 g。两组疗程均为3个月。
1.3 观察指标及评价标准
1.3.1 中医症状积分评估 采用相关标准对两组患者治疗前后腰膝酸软、懒言气短、疲倦乏力、面色晦黯、水肿、食少纳差、大便溏、夜尿频多、肢体麻痛等中医症状积分予以评估,0分(无明显症状表现)、2分(临床症状较轻,偶尔表现)、4分(临床症状较重,经常表现)、6分(临床症状严重,可持续表现)[5]。
1.3.2 肾功能指标检测 采用全自动生化分析仪检测两组患者治疗前后 24 h 尿蛋白定量(24 h UAE)、尿白蛋白排泄率(UAER)、血尿素氮(BUN)、血肌酐(Scr)等肾功能指标。
1.3.3 微炎症状态指标检测 采用酶联免疫吸附法检测两组患者治疗前后白介素(IL)-6、超敏C反应蛋白(hs-CRP)、肿瘤坏死因子-α(TNF-α)等炎症细胞因子指标。
1.3.4 氧化应激指标检测 采用比色法检测两组患者治疗前后超氧化物歧化酶(SOD)、谷胱甘肽过氧化物酶(GSH-Px)、丙二醛(MDA)等氧化应激指标。
1.3.5 不良反应 观察两组患者治疗期间不良反应发生情况。
1.4 统计学处理
2 结果
2.1 两组治疗前后中医症状积分变化比较
两组均未出现脱落病例,已采用ITT意向分析。两组治疗后中医症状积分均降低,差异有统计学意义(P<0.05),且观察组治疗后中医症状积分降低较对照组更明显,差异有统计学意义(P<0.05),见表 2。
表2 两组治疗前后中医症状积分比较[分,(±s)]
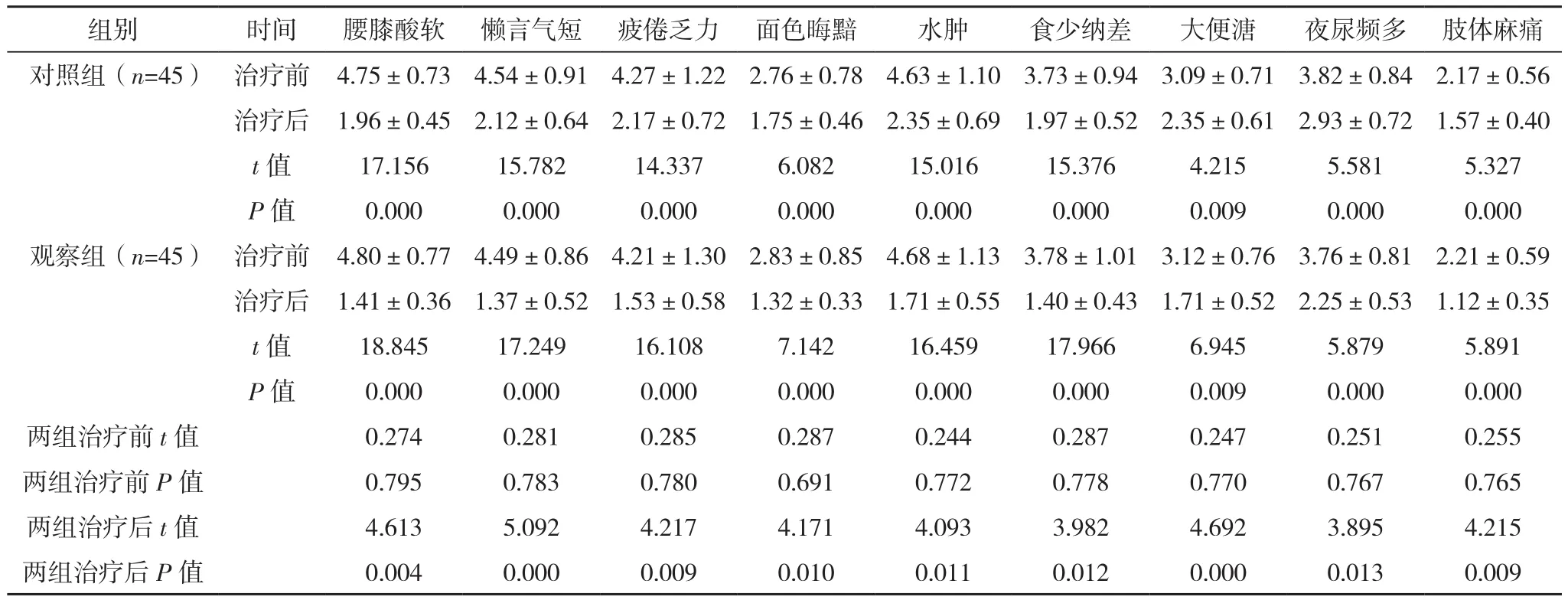
表2 两组治疗前后中医症状积分比较[分,(±s)]
组别 时间 腰膝酸软 懒言气短 疲倦乏力 面色晦黯 水肿 食少纳差 大便溏 夜尿频多 肢体麻痛对照组(n=45) 治疗前 4.75±0.73 4.54±0.91 4.27±1.22 2.76±0.78 4.63±1.10 3.73±0.94 3.09±0.71 3.82±0.84 2.17±0.56治疗后 1.96±0.45 2.12±0.64 2.17±0.72 1.75±0.46 2.35±0.69 1.97±0.52 2.35±0.61 2.93±0.72 1.57±0.40 t值 17.156 15.782 14.337 6.082 15.016 15.376 4.215 5.581 5.327 P值 0.000 0.000 0.000 0.000 0.000 0.000 0.009 0.000 0.000观察组(n=45) 治疗前 4.80±0.77 4.49±0.86 4.21±1.30 2.83±0.85 4.68±1.13 3.78±1.01 3.12±0.76 3.76±0.81 2.21±0.59治疗后 1.41±0.36 1.37±0.52 1.53±0.58 1.32±0.33 1.71±0.55 1.40±0.43 1.71±0.52 2.25±0.53 1.12±0.35 t值 18.845 17.249 16.108 7.142 16.459 17.966 6.945 5.879 5.891 P值 0.000 0.000 0.000 0.000 0.000 0.000 0.009 0.000 0.000两组治疗前t值 0.274 0.281 0.285 0.287 0.244 0.287 0.247 0.251 0.255两组治疗前P值 0.795 0.783 0.780 0.691 0.772 0.778 0.770 0.767 0.765两组治疗后t值 4.613 5.092 4.217 4.171 4.093 3.982 4.692 3.895 4.215两组治疗后P值 0.004 0.000 0.009 0.010 0.011 0.012 0.000 0.013 0.009
2.2 两组治疗前后肾功能指标变化比较
两组治疗后肾功能指标(24 h UAE、UAER、BUN、Scr)均降低,差异有统计学意义(P<0.05),且观察组治疗后各肾功能指标降低较对照组更明显,差异有统计学意义(P<0.05),见表3。
表3 两组治疗前后肾功能指标变化比较(±s)

表3 两组治疗前后肾功能指标变化比较(±s)
组别 时间 24 h UAE(mg) UAER(μg/min) BUN(mmol/L) Scr(μmol/L)对照组(n=45) 治疗前 156.56±15.78 75.45±13.22 14.51±3.43 114.17±20.32治疗后 94.33±9.54 26.63±3.31 9.73±1.52 95.32±14.65 t值 21.576 22.906 19.251 5.656 P值 0.000 0.000 0.000 0.000观察组(n=45) 治疗前 157.78±15.95 74.26±12.85 14.36±3.55 113.09±19.75治疗后 78.12±7.31 15.06±2.72 7.47±1.21 80.05±11.34 t值 22.157 29.752 21.340 6.377 P值 0.000 0.000 0.000 0.000两组治疗前t值 0.324 0.359 0.337 0.342两组治疗前P值 0.612 0.579 0.621 0.591两组治疗后t值 5.236 7.437 6.015 4.930两组治疗后P值 0.000 0.000 0.000 0.000
2.3 两组治疗前后微炎症状态指标变化比较
两组治疗后微炎症状态指标(IL-6、hs-CRP、TNF-α)均降低,差异有统计学意义(P<0.05),且观察组治疗后各微炎症状态指标降低较对照组更明显,差异有统计学意义(P<0.05),见表4。
表4 两组治疗前后微炎症状态指标变化比较(±s)

表4 两组治疗前后微炎症状态指标变化比较(±s)
组别 时间 IL-6(ng/L) hs-CRP(mg/L) TNF-α(ng/L)对照组(n=45) 治疗前 22.89±3.42 8.71±1.52 18.74±3.38治疗后 17.58±2.13 4.67±1.24 14.06±2.92 t值 17.213 18.070 14.137 P值 0.000 0.000 0.000观察组(n=45) 治疗前 23.02±3.29 8.80±1.61 18.63±3.29治疗后 13.37±1.75 2.85±0.93 10.53±2.44 t值 18.725 18.915 15.051 P值 0.000 0.000 0.000两组治疗前t值 0.351 0.361 0.367两组治疗前P值 0.581 0.569 0.566两组治疗后t值 5.417 5.612 5.710两组治疗后P值 0.000 0.000 0.000
2.4 两组治疗前后氧化应激指标变化比较
两组治疗后SOD、GSH-Px水平较治疗前升高,而MDA水平较治疗前降低,差异有统计学意义(P<0.05),且观察组治疗后SOD、GSH-Px水平升高和MDA水平降低较对照组更明显,差异有统计学意义(P<0.05),见表5。
表5 两组治疗前后氧化应激指标变化比较(±s)

表5 两组治疗前后氧化应激指标变化比较(±s)
组别 时间 SOD(U/ml) MDA(μmol/L) GSH-Px(U/ml)对照组(n=45) 治疗前 212.52±31.79 21.57±4.72 349.27±45.07治疗后 247.16±27.64 16.85±3.80 402.33±53.26 t值 4.782 6.428 5.521 P值 0.000 0.000 0.000观察组(n=45) 治疗前 213.47±32.05 21.73±4.62 354.39±47.72治疗后 278.95±29.33 12.01±3.39 466.12±57.17 t值 5.894 9.321 6.124 P值 0.000 0.000 0.000两组治疗前t值 0.377 0.381 0.412两组治疗前P值 0.553 0.547 0.508两组治疗后t值 4.897 7.116 5.671两组治疗后P值 0.000 0.000 0.000
2.5 两组不良反应发生情况比较
两组患者治疗期间均未出现严重不良反应,均完成疗程。
3 讨论
近些年较多研究认为,炎症细胞因子参与、糖脂生理代谢过程异常紊乱、氧化应激反应、肾脏血流动力学显著性改变及基因遗传等因素会导致DN的发生,其中氧化应激反应及微炎症状态在DN发生、发展中发挥着极为重要的作用,故有效减轻氧化应激反应及微炎症状态可明显延缓DN患者病情的发展速度[6-7]。中医理论认为DN疾病的发生与禀赋不足、肾气亏虚、饮食不节及情志失调等有着密切的联系[8]。此疾病的病理机制主要为肾气虚耗、血瘀阻滞,而瘀血、痰浊及水湿则为标实所在,故应以滋阴益气、散结活血为中医治疗原则[9]。本研究采用的方剂为自拟益气养阴消癥通络方,其中黄芪、生地等药物成分具有益气养阴及扶正固表的药物学功能作用,可显著增强细胞和体液免疫功能,有效控制血糖,明显增加肾脏组织的血液灌注总量,避免肾小球基底膜屏障系统功能受到严重损伤,减少尿蛋白的排泄量,同时还可降低肾脏组织MDA的表达水平,增强SOD的生物学活性功能,对减轻机体氧化应激反应及氧自由基损伤也有一定作用[10];方剂中的丹参、地龙、水蛭、鳖甲等药物成分具有活血通络、消癥化积等药物学功能作用,可明显增加肾脏组织的血液灌注总量,减少尿蛋白的排泄量,显著延缓肾脏病理改变的发展速度[11];大黄具有消癥瘕、破积聚等功效,可明显改善Scr、BUN等肾功能指标和肾性贫血相关临床症状,同时还可有效纠正蛋白质生理代谢过程异常紊乱状态,从而明显减轻肾脏组织的损伤严重程度,此药物与黄芪联合应用可起到协同的药理效用[12];砂仁则具有醒脾化湿的功效,有助于药力的发挥。同时在临床应用中尚需根据患者病情具体变化对上述中药成分予以加减。本研究显示,观察组治疗后的中医症状积分及肾功能指标较对照组明显更低(P<0.05),提示自拟益气养阴消癥通络方可明显改善DN患者的临床症状及肾功能。
较多研究认为机体内的微炎症状态在DN病情持续进展中发挥着关键性的作用,不但可诱发心血管系统及神经系统的病理改变,而且还明显损伤肾实质组织,对患者预后造成不利影响,而IL-6、hs-CRP、TNF-α等指标水平直接反映了DN患者的微炎症状态[13]。本研究显示,观察组患者治疗后IL-6、hs-CRP、TNF-α等微炎症状态指标较对照组更低(P<0.05),结果提示自拟益气养阴消癥通络方可明显减轻DN患者的微炎症状态。DN的发生发展过程与机体氧化应激反应之间也存在着密切的联系,长时间处于高血糖水平的异常状态下,机体出现氧化应激反应的风险性显著性升高,可导致重要脏器组织发生过氧化损伤[14]。相关研究发现,活性氧可对细胞内线粒体组织结构造成严重损伤,进而明显影响其生理功能,使得血清SOD、GSH-Px的表达水平明显下降,氧自由基的清除功能显著性减弱[15]。而MDA则是脂质过氧化反应过程中的终产物,其表达水平的高低可准确反应膜脂过氧化反应的程度[16]。本研究发现,观察组患者治疗后SOD、GSH-Px水平较对照组更高,而MDA较对照组更低(P<0.05),结果提示自拟益气养阴消癥通络方可明显减轻DN患者的氧化应激反应。
综上所述,自拟益气养阴消癥通络方不但可改善DN患者临床症状和肾功能,而且还可明显减轻微炎症状态和氧化应激反应,且具有较高的安全性。但本研究的观察样本例数相对较少,随访时间相对较短,且为单中心研究,对不同证型的RNS患者预后情况也未做长期随访观察,故还需以后扩大样本量予以论证。
