Ⅰ~Ⅲ期左右半结肠癌错配修复蛋白缺失表达差异和临床病理特征的相关性
2022-09-10何杨王俊峰谢发琴徐萍张帆朱益平
何杨,王俊峰,谢发琴,徐萍,张帆,朱益平
(1. 皖南医学院第一附属医院肿瘤内科,安徽 芜湖 241001;2. 皖南医学院第一附属医院胃肠外科,安徽 芜湖 241001;3. 皖南医学院第一附属医院病理科,安徽 芜湖 241001)
结直肠癌(colorectal cancer,CRC)是一种多基因遗传特征性的异质性疾病,一般以结肠脾曲为界分为左(包括直肠)、右半结肠。2017年NCCN等指南指出[1]:因左、右半结肠癌的胚胎起源不同,两者的流行病学、表观遗传性、疗效和预后各不相同。结直肠癌 (CRC) 的发展是一个复杂的多步骤过程,涉及多种癌基因和抑制基因突变的作用。左右半结直肠癌发病的主要分子生物学通路存在明显差异,根据识别其分子遗传特征有助于更好地帮助我们筛查、诊断、归类和治疗[2]。错配修复(deficient mismatch,MMR)系统包括MLH1、MSH2、MSH6和PMS2等蛋白,具有维持DNA复制的基因组稳定性和降低自发突变的功能。DNA在复制过程中偶尔出现的错配,可以被以上修复蛋白识别剪切后重新修复正常。以上4种修复蛋白表达如果出现任一缺失即会引起 MMR 缺陷(dMMR),无法发现和修复DNA的复制错误,也称之为高度微卫星不稳定(microsatellite instability-High,MSI-H)状态[3]。近年来,研究发现MSI的表达状态和CRC表观特征、诊疗指导密切相关[4],对林奇综合征的筛查、Ⅱ期CRC辅助治疗方案的选择及预后、晚期CRC的免疫治疗都具有确切的指导意义[5],国内外各大指南已推荐MMR作为大肠癌常规检测项目。本研究回顾性归纳了2018年3月—2020年12月在本院经免疫组化检测错配修复蛋白(MLH1、MSH2、MSH6、PMS2)判定为dMMR的结直肠癌根治术标本82例,总结和分析左右半结直肠癌错配修复蛋白缺失表达状态差异及临床病理特征之间的关系。
1 材料与方法
1.1 研究对象 收集2018年3月—2020年12月在本院结直肠癌根治手术标本并经免疫组化方法检测错配修复蛋白确定为MMR缺陷(deficient mismatch repair,dMMR)82例,其中右半结肠癌54例,左半结肠癌28例。
1.2 检测方法 标本经10%中性福尔马林固定8~24 h,常规脱水,石蜡包埋切片、染色、封片。免疫组织化学采用EnVision两步法,所用一抗MLH1、MSH2、MSH6、PMS2购自福州迈新生物技术开发公司。
1.3 结果判定 检测结果由病理医师三审读片判定:肿瘤细胞核见棕黄色或黄色着色,无背景着色,定为阳性;肿瘤细胞核无棕黄色或黄色着色,定为阴性。每次试验均设有阳性和阴性对照。4种蛋白均有表达可判为错配修复正常(proficient mismatch repair,pMMR),规同为低度不稳定(MSI-L)或微卫星稳定(MSS);有1种或以上蛋白表达阴性判为错配修复缺陷(dMMR),视为微卫星高度不稳定(MSI-H)[3]。
1.4 统计学方法 采用SPSS 16.0统计软件检验,计数资料用χ2检验及Fisher精确概率法;计量资料用t检验;相关性分析采用列联系数检验;P<0.05表示差异有统计学意义。
2 结果
2.1 dMMR左、右半结直肠癌的临床病理特征对比 右半结肠癌中>60岁的人数、隆起型具有肿瘤家族史和伴有第二原发肿瘤的人数均高于左半结肠癌组(P<0.05);右半结肠癌组的中性粒细胞/淋巴细胞比值(NLR)高于左半结直肠癌组(P<0.001)。其他临床病理特无明显差异,见表1。
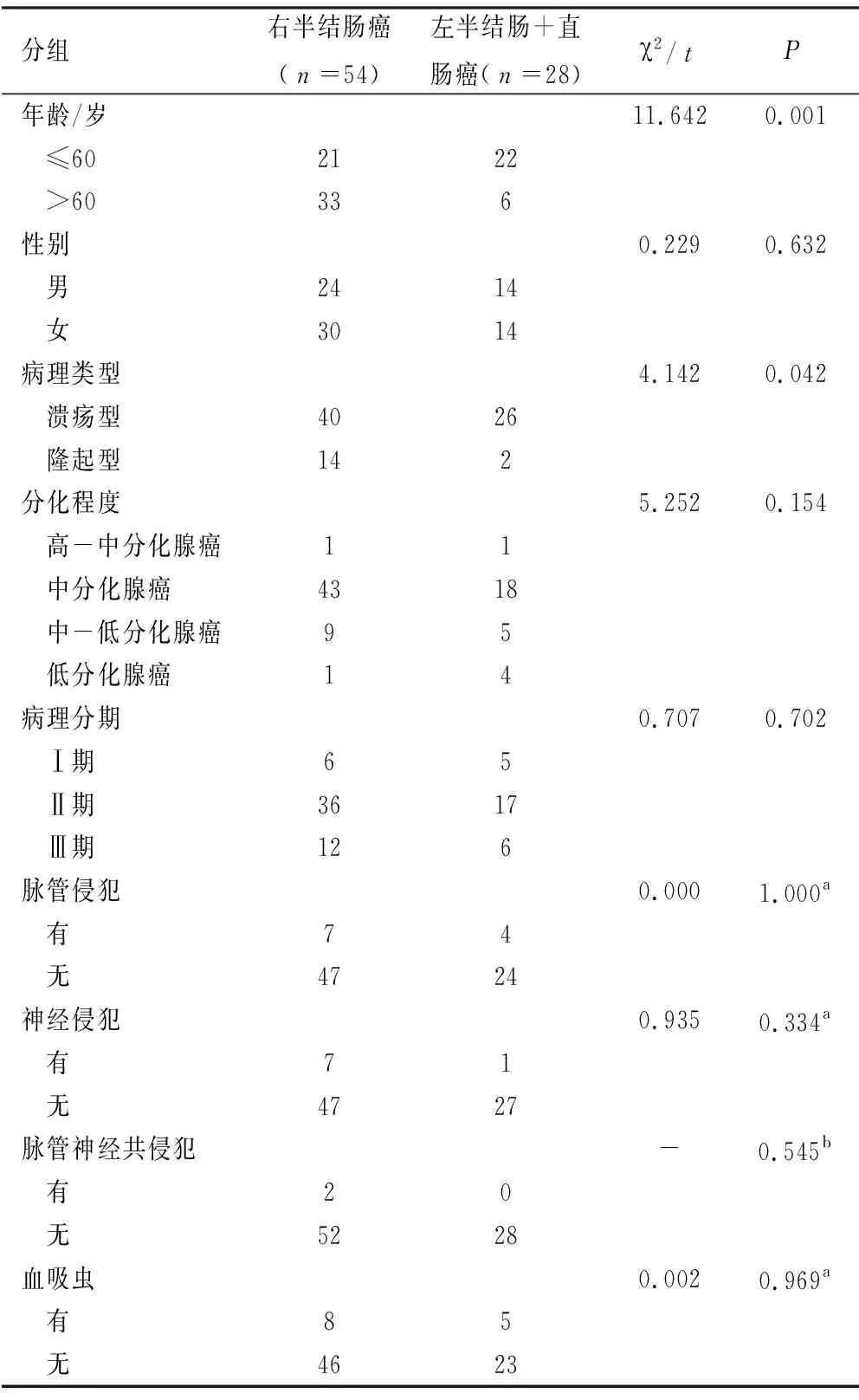
表1 dMMR左、右半结直肠癌临床病理特征对比

表1(续) dMMR左、右半结直肠癌临床病理特征对比
2.2 MLH1、MSH2、MSH6和PMS2在dMMR左、右半结直肠癌中的表达缺失情况 82例中有38例MLH1缺失表达(右半27例、左半11例),15例MSH2缺失表达(右半9例、左半6例),18例MSH6缺失表达(右半10例、左半8例),60例PMS2缺失表达(右半41例、左半19例);其中MLH1+PMS2联合缺失表达有35例(右半26例、左半9例),MSH2+MSH6联合缺失表达有8例(右半5例、左半3例),MLH1+MSH2+PMS2联合缺失表达有2例(右半1例、左半1例),MLH1+MSH6+PMS2联合缺失表达有1例(右半0例、左半1例)。以上缺失表达在左右半结直肠癌中差异均无统计学意义(P>0.05),见图1、表2。
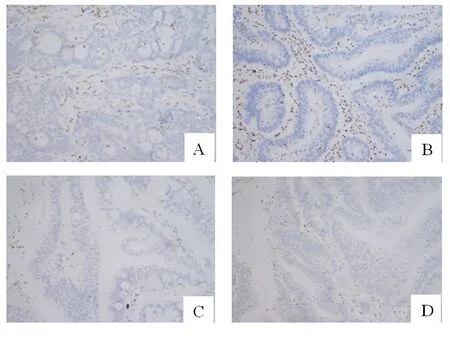
A.MLH1;B.MSH2;C.MSH6;D.PMS2,200倍,EnVision法。
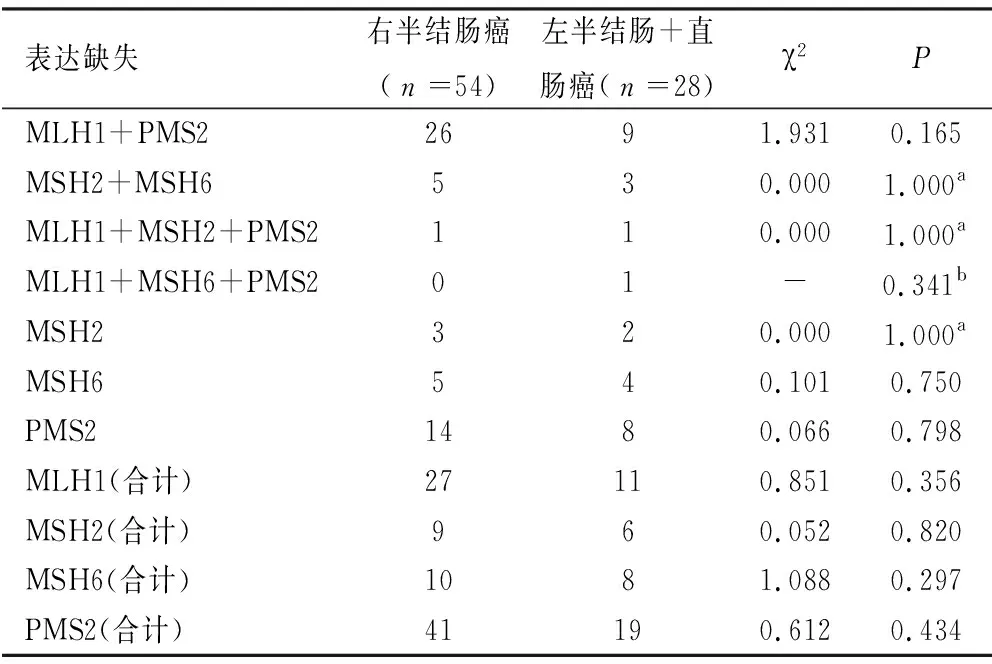
表2 MLH1、MSH2、MSH6和PMS2在左、右半结直肠癌中的缺失表达对比
2.3 左、右半结肠癌中MLH1、MSH2、MSH6和PMS2表达缺失的亚组分析 MLH1缺失在右半结肠癌中女性患者更为多见(P<0.05)。MSH6缺失表达在左、右半结肠癌细胞分化程度上有所差异(P<0.05),经过组间对比分析发现两组中分化组和低分化组差异存在统计学意义(P=0.044);MSH6缺失表达在左、右半结肠癌pTNM分期也上有所差异(P=0.025),进一步组间对比分析发现差别存在于Ⅰ期和Ⅱ期间(P=0.044),PMS2在>60岁右半结肠癌中表达缺失多于左半结肠癌(P<0.001),见表3。
2.5 MLH1、MSH2和MSH6、PMS2在dMMR结直肠癌中表达的相关性 82例dMMR结直肠癌中MLH1和PMS2的表达具有正相关性,在左、右半结直肠癌中的表达也分别具有相关性。dMMR结直肠癌中MSH2和MSH6的表达呈正相关,在右半结肠癌中表达也呈正相关,见表4~表9。

表3 左、右半结肠癌中MLH1、MSH2、MSH6和PMS2表达缺失的亚组分析

表4 MLH1和PMS2在82例dMMR结直肠癌中表达的相关性
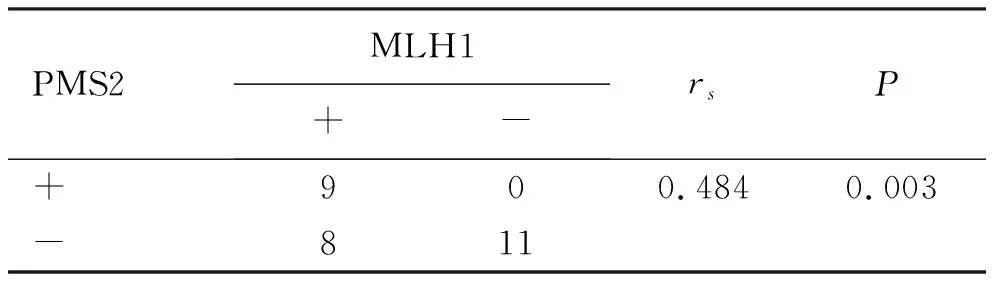
表5 MLH1和PMS2在dMMR左半结肠癌中表达的相关性
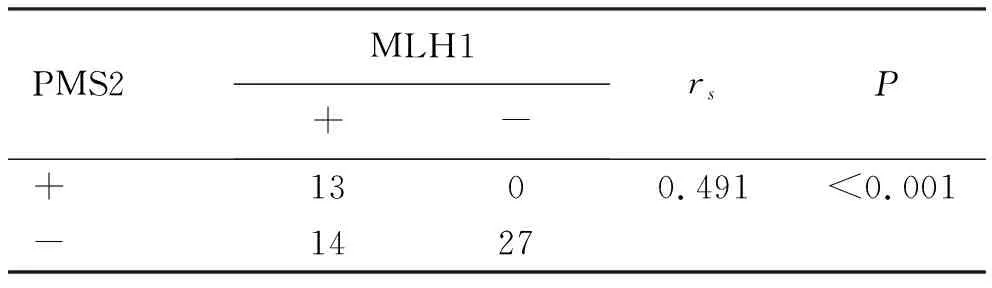
表6 MLH1和PMS2在dMMR右半结肠癌中表达的相关性
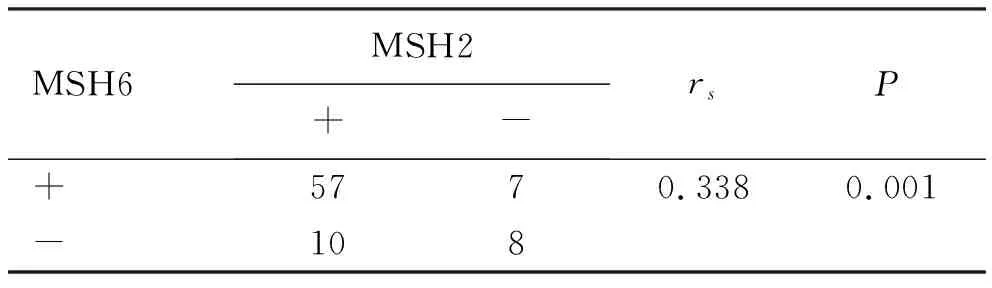
表7 MSH2和MSH6在82例dMMR结直肠癌中表达的相关性
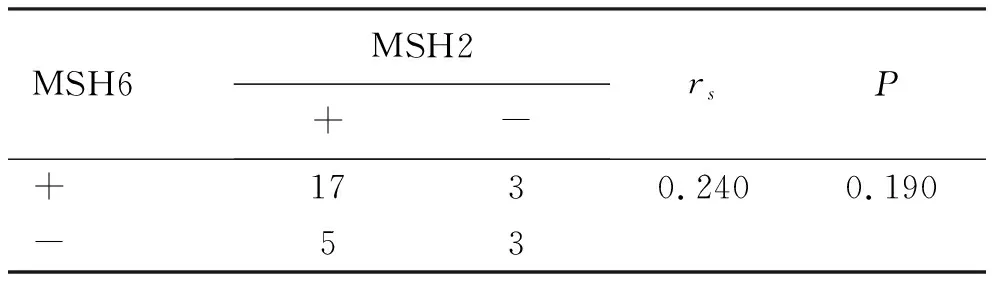
表8 MSH2和MSH6在dMMR左半结肠癌中表达的相关性
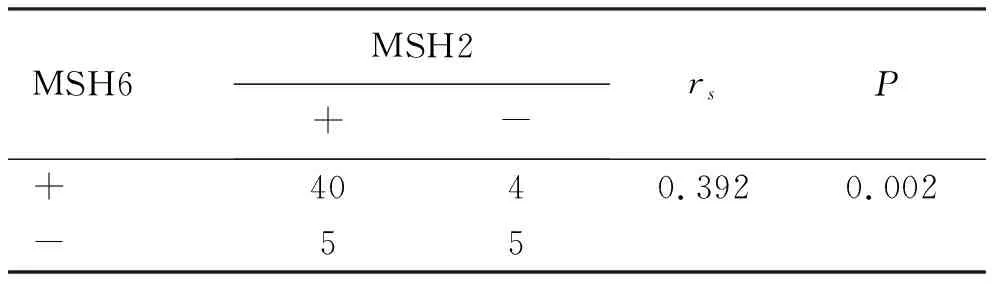
表9 MSH2和MSH6在dMMR右半结肠癌中表达的相关性
3 讨论
本研究通过总结皖南医学院第一附属医院自经免疫组化方法检测判为dMMR的82例Ⅰ~Ⅲ期结直肠癌根治标本, 发现dMMR左半结肠癌中>60岁的人数明显少于右半结肠癌,中国结直肠癌数据分析显示[6]:左半结肠及直肠癌发病率以年轻人居多,>60岁的老年患者本身基数较低,故发生dMMR的几率也相对较低。右半结肠癌的病理类型中隆起型多于左半结肠,而右半结肠癌与MUYTH-相关性息肉病关系密切,该疾病常表现为多发息肉,故隆起型较多可能与此相关。右半结肠癌中具有肿瘤家族史和伴有第二原发肿瘤的人数均高于左半结肠癌组,具有以上特征可能是由于CRC是林奇综合征(lynch syndrome,LS)的最常见肿瘤之一,MLH1和 MSH2的胚系突变占LS的60%~80%[7],LS好发于右半结肠,并具有家族遗传,同时易发生多原发肿瘤,54%~61%的患者会发生胃癌、子宫内膜癌等第二种原发肿瘤[8],故右半结肠癌组具有肿瘤家族史和伴有第二原发肿瘤的患者较多。中性粒细胞可以通过分泌炎症介质来促进肿瘤细胞的增殖及侵袭转移,而淋巴细胞减少常伴有白细胞和血小板增多,从而有助于肿瘤细胞发生免疫逃逸,因此NLR升高预示着预后相对较差[9]。ASHIZAWA N等[10]研究也发现:结直肠癌中术前高NLR组的DFS和OS均短于低NLR组,卢文超等[11]也发现胃癌患者化疗前高NLR组的预后较差,经过多变量分析,NLR也是独立的预后因素。本研究中dMMR右半结肠癌组的中性粒细胞/淋巴细胞比值(NLR)高于左半结肠癌组,也佐证了右半结肠癌预后较差。
全部病例中有38例(46.34%)MLH1缺失表达,15例(18.20%)MSH2缺失表达(18.3%),18例(21.95%)MSH6缺失表达,60例(73.17%)PMS2缺失表达;MLH1+PMS2联合缺失表达有35例(42.68%),MSH2+MSH6联合缺失表达有8例(9.76%),MLH1+MSH2+PMS2联合缺失表达有2例(2.44%),MLH1+MSH6+PMS2联合缺失表达有1例(1.22%)。本研究统计结果略低于CHEN L等[12]的研究结果,这可能也是其研究多纳入了一部分Ⅳ期CRC患者[13]。既往有报道PMS2表达缺失多见于右半结肠癌[14],本研究中以上4种蛋白缺失表达在左右半结直肠癌中无明显差异,PMS2在右半结肠癌中的缺失表达率虽然高于左半结肠癌,但并无统计学差异,可能还是与标本量不足有关。
LEE CT等[15]检测了116例dMMR CRC中的4种常见dMMR IHC模式,发现dMMR1型 (MLH1-/PMS2-) CRC 最为常见,BRAF V600E突变几乎只在dMMR 1型和dMMR 2型(仅 PMS)CRC 中观察到。而散发性结直肠癌(sporadic colorectal cancer,CRCs)常由MLH1启动子发生体细胞甲基化后表观遗传失活引起,并和BRAF V600E突变有关[16]。具有MLH1 启动子甲基化的散发性 MSI-H 结直肠癌(称MM)的临床病理特征与具有种系突变(Lynch综合征/LS相关)或错配修复中的体细胞、Lynch样突变的结直肠癌患者的临床病理特征差异较大[17]。本研究数据显示右半结肠癌中>60岁的病例中PMS2多于左半结肠癌,右半结肠癌中女性MLH1高于左半结直肠癌,既往研究均表明LS相关dMMR型CRC的发病年龄较早,在结直肠癌的平均发病年龄为45岁[18],而MSI型CRCs好发于右半结肠,多见于年纪较大和女性患者,故提示本研究中纳入的右半结肠癌中CRCs型比例可能较左半结直肠癌更高,必要时可行BRAF V600E及甲基化检测来进一步甄别。也可能与LS的特殊表型相关,此表型PMS2缺失表达患者的发病年龄较大[19]。
本研究中MSH6缺失表达在82例dMMR结直肠癌中占22.0%,SALEM M E等[20]检测了1 057 例MSI-H实体瘤,MSH6缺失占25.7%,与本研究数据近似。MSH6缺失表达在左、右半结肠癌细胞分化程度上有所差异,经过组间对比分析发现两组中分化组和低分化组存在统计学差别;MSH6缺失表达在左、右半结肠癌pTNM分期也上有所差异,进一步组间对比分析发现差别存在于Ⅰ期和Ⅱ期间。目前国内外研究结果不一,MSH6缺失表达在左、右半结肠癌TNM分期中有无差异并无定论[21-22]。本研究受样本数量的局限性,有关具体结论尚待扩大病例数分析。
MMR中MLH1与MSH2是主导蛋白,常分别与PMS2和MSH6配对形成二聚体产生作用。故MLH启动子发生胚系突变或体细胞甲基化时,常出现MLH1和PMS2表达缺失;MSH2发生胚系突变时,会出现MSH2和MSH6缺失[23]。本研究中82例dMMR结直肠癌中MLH1和PMS2的表达具有正相关性,MSH2和MSH6的表达也呈正相关,符合上述4种蛋白MLH1与PMS2、MSH2与MSH6同源性理论。分层分析发现MSH2和MSH6在左半结肠癌中表达无相关,CHEN W等[24]检测了829例CRC中有80例显示dMMR,其中4例显示所有4种错配修复蛋白表达均缺失,这些病例显示与BRAF突变和MLH1启动子甲基化相关的弥漫性MLH1缺失与散发性dMMR一致,推测MSH2和MSH6表达不一致时存在额外的双突变 。研究认为[25]:MLH1和MSH2表达缺失相互排斥,只能有一种蛋白表达缺失。但本研究中左、右半结肠各有1例出现MLH1、MSH2和PMS2共同表达缺失,除了检测结果出现假阴性的可能,提示是否存在MLH1和MSH2表达共缺失的MMR罕见亚型。而本研究中左、右半结肠癌中MSH2、MSH6、PMS2都有单独表达缺失病例,提示除了常规主导蛋白和配对蛋白结合会导致两种蛋白协同缺失,还可能出现自身罕见胚系突变导致单独表达缺失[26-28]。
左右半结直肠癌从疾病的发展和治疗效果差异较大,根本原因之一在于分子分型的区别:右半结肠癌主要存在MSI、甲基化(CIMP)、BRAF突变等;左半结直肠癌多存在染色体不稳定(CIN)、EGF、Wnt信号传导异常、HER1和HER2扩增等。本研究通过对比Ⅰ~Ⅲ期左右半结肠癌错配修复蛋白缺失表达状态和临床病理特征的相关性分析,旨在探索出以分子标志物为导向精准治疗手段的理论基础。
