白藜芦醇通过SIRT1/STAT3通路改善血管性痴呆大鼠学习记忆能力的机制研究
2022-09-10罗潇潇方雷赵健龚鑫王林郑兰荣丁见
罗潇潇,方雷,赵健,龚鑫,王林,郑兰荣,丁见
(1. 皖南医学院研究生学院,安徽 芜湖 241002;2. 皖南医学院基础医学院,安徽 芜湖 241002)
血管性痴呆(vascular dementia,VD)作为一种常见的痴呆类型,具有较高的发病率和死亡率[1]。VD的主要临床特点与其他痴呆相似,表现为进行性认知功能障碍、记忆丧失等[2]。有研究表明,双侧颈总动脉永久结扎术(bilateral common carotid artery occlusion,BCCAO)可导致慢性脑灌注不足,而VD 的发生发展与其有密切关系[3]。神经影像学和病理学结果已证实,因血管阻塞或者病变引起脑血供减少时,会引起大脑缺血缺氧后神经细胞活化增多,促使炎症因子及氧自由基大量释放损伤神经元,而长期慢性缺血会导致海马、皮质损伤伴随认知功能障碍[4-5]。随着我国老龄化的加剧以及心血管疾病发病率的增加,受到血管性痴呆困扰的人群越来越多,VD已成为亟待解决的重大医疗卫生问题,但迄今为止仍然缺乏有效治疗手段,迫切需要寻找防治VD的有效靶点。
多项研究表明,炎症机制参与了VD 后的神经病理损伤,而抑制炎症可以减缓VD引起的一系列慢性脑缺血神经损伤[6]。白藜芦醇(3,4′,5-trihydroxystilbene, Rsv)是一种多酚化合物,具有广泛的生物学效应,如抗炎、抗氧化等,其对于认知功能障碍同样具有有效的改善作用[7-8]。据报道,沉默信息调节因子1(silent information regulat-or of transcription 1,SIRT1)是近年来发现的依赖烟酰胺腺嘌呤二核苷酸的第Ⅲ类组蛋白去乙酰化酶类(histone deacetylases,HDACs),可以调节多种组织和细胞的炎症反应[9]。白藜芦醇作为SIRT1的有效化学激动剂,可以通过介导SIRT1转录,从而抑制或逆转神经损伤起到神经保护作用[10]。
信号传导及转录激活因子3(signal transducer and activator of transcription 3,STAT3)是调节细胞因子诱导的促炎和抗炎反应的重要转录因子之一,可促进与炎症相关的基因表达[11]。此外,有研究表明,抑制SIRT1的表达可以在表观遗传学上促进STAT3的表达[12]。通过抑制STAT3来改善炎症反应在一定程度上依赖于SIRT1的表达,但目前未见有关白藜芦醇对VD大鼠的治疗作用与SIRT1/STAT3通路有关的报道[13]。本研究采用BCCAO复制VD大鼠模型,旨在探讨白藜芦醇对VD大鼠学习记忆能力的影响及其通过SIRT1/STAT3信号通路改善炎症反应的可能机制。
1 材料与方法
1.1 材料
1.1.1 实验动物 SPF级健康雄性SD大鼠30只,8~10周龄,体重190~220 g,购于济南朋悦实验动物繁育有限公司,由山东省实验动物中心进行质量检测,实验单位使用许可证编号为SYXK(皖)2018-004,动物许可证号为SCXK(鲁)20190003。所有动物均分笼饲养于皖南医学院实验室动物房,大鼠能够自由地获取食物和饮水,保持12 h的明暗循环,温度适宜。本实验的所有流程均按照中华人民共和国科学技术部制定的《实验动物护理和使用指导意见》指导进行。
1.1.2 主要试剂与仪器 白藜芦醇(宝鸡市方晟生物开发有限公司,纯度:98%);SIRT1一抗(mAb #8469,美国Cell Signaling Technology);STAT3一抗(mAb #30835,美国Cell Signaling Technology);IL-17一抗(bs-1183R,北京博奥森生物技术有限公司);β-actin(AA128)、辣根过氧化物酶标记的山羊抗兔IgG、辣根过氧化物酶标记的山羊抗小鼠IgG、特超敏ECL化学发光试剂盒、增强型BCA蛋白浓度测定试剂盒、PVDF膜(0.45 μm)、彩色预染蛋白质分子量标准(10-180kD)(上海碧云天生物技术有限公司);免疫组织化学染色试剂盒、多聚赖氨酸 (武汉博士德生物工程有限公司); ELISA试剂盒(EIA-3479,上海艾莱萨生物科技有限公司);增强型HRP-DAB底物显色试剂盒(北京天根生化科技有限公司);病理级显微镜载玻片(江苏世泰实验器械有限公司);Morris水迷宫视频分析系统(北京众实迪创科技发展有限责任公司);石蜡组织切片机( RM2145型,德国Lica);立式超低温保存箱(青岛海尔特种电器有限公司);实验室超纯水制造系统(安徽久智电子科技有限公司);BX51正置显微镜 (日本OLYMPUS);化学发光成像系统(美国Amersham);Western blot仪器(美国Bio-Rad);高通量组织研磨仪(中国上海净信实业发展有限公司);酶标仪(美国Bio Tek Instruments)。
1.2 方法
1.2.1 实验分组、造模及给药 将30只SPF级健康雄性SD大鼠中22只进行BCCAO建立VD模型。术前保持空腹8 h,腹腔注射10%水合氯醛(0.35 mL/100 g)麻醉。将大鼠仰卧位固定于手术台上,常规手术区域消毒,备皮。颈部作正中切口,暴露出双侧的颈总动脉后,小心地将其与周围组织进行钝性分离,并用无菌丝线在距离颈外动脉起点约1 cm处进行结扎,切口常规缝合。假手术组大鼠作正中切口暴露出双侧颈总动脉不结扎,其他处理同模型组。随机选取其中造模成功的大鼠16只,随机分为VD模型组、VD治疗组,另设置假手术组作为对照,每组8只。治疗组大鼠每天给予白藜芦醇(20 mg/kg)灌胃治疗,持续30 d;假手术组和模型组每天给予同等体积的生理盐水灌胃,持续30 d。
1.2.2 Morris水迷宫 Morris水迷宫设备由一个直径150 cm、高50 cm的圆形水池和自动录像及视频分析系统组成,实时记录每只大鼠的游泳路径,可以用来检测各组大鼠的学习和记忆能力。白藜芦醇灌胃治疗30 d结束后,前6 d进行定位航行实验,将各组大鼠分别放在4个象限内寻找平台,记录逃避潜伏期。平台直径约10 cm,将其置于第4象限的中央位置,低于水面2 cm。若大鼠90 s内未找到平台,则由实验者引导其至平台上并停留15 s,并将其逃避潜伏期记为90 s。休息1 d后,进行空间探索实验。去除平台,让各组大鼠从原来平台附近两个象限之一进入水迷宫,不设限地进行90 s的游泳,记录各组大鼠穿过原平台的次数以及在各个象限停留的时间。
1.2.3 标本收集 行为学实验后,用10%水合氯醛将各组大鼠深度麻醉,取各组大鼠眼眶血,4 ℃过夜后于2 000 r/min离心20 min后取上清液用于ELISA实验。确定大鼠剑突位置,沿剑突横剪开胸腹腔,看见心脏后,一手持针头,对比穿刺距离,从左心室穿至主动脉弓,固定好针头后迅速剪开右心耳,快速注入100 mL预冷的生理盐水冲洗。断头取脑后一侧脑用4%多聚甲醛充分浸泡固定后用于免疫组织化学染色实验;另一侧快速分离额叶皮层组织置于-80 ℃冻存,用于Western blot实验。
1.2.4 免疫组织化学染色检测SIRT1、STAT3及IL-17阳性神经元的表达 将放入4%多聚甲醛中固定的一侧脑参照《大鼠脑立体定位图谱》进行分段,保留含有额叶皮质的部分,依次进行脱水、浸蜡、石蜡包埋、切片、贴片(切片厚度为5 μm)。将切片放入二甲苯中脱蜡至梯度酒精脱水后放入蒸馏水中。随后将切片移入枸橼酸盐缓冲液(pH6.0)中进行热修复抗原(高火3 min、低火15 min)。加热结束后取出,待枸橼酸盐缓冲液自然冷却后,用蒸馏水洗3次,无时间要求。将3%过氧化氢溶液(现配现用)滴于已热修复并完成的切片,室温下避光孵育10 min。蒸馏水洗3次,每次5 min,擦干后滴加破膜剂孵育30 min。PBS缓冲液洗3次,每次5 min,擦干后滴加5%BSA置于37 ℃温箱中封闭2 h。取出后甩干封闭液,滴加SIRT1、STAT3或IL-17一抗(1∶150)4 ℃孵育16~24 h。将切片移入37 ℃温箱中复温30 min,取出用PBS洗3次,每次5 min。擦干后滴加二抗山羊抗兔IgG或山羊抗小鼠IgG(1∶100),移入37 ℃温箱中孵育2 h。取出后,PBS洗3次,每次5 min,擦干后滴加三抗(SABC),37 ℃温箱中孵育1 h。洗涤干净擦干后滴加DAB显色剂(HRP∶A液∶B液=1000∶50∶50)。双蒸水冲洗切片终止反应,梯度酒精脱水后用中性树胶封片。采用Image J 软件统计400倍光学显微镜视野下额叶皮质内SIRT1、STAT3与IL-17平均免疫阳性细胞数和平均细胞灰度值,灰度值越小蛋白表达越强,灰度值越大则蛋白表达越弱。
1.2.5 Western blot法检测SIRT1、STAT3及IL-17的表达 取出-80 ℃冰箱冻存的各组大鼠额叶皮质组织样本约30 mg,加入RIPA裂解液和PMSF进行组织裂解(RIPA∶PMSF=99∶1),组织研磨仪充分研磨组织后放入4 ℃冰箱静置1.5~2 h,使其充分裂解。离心机预冷至4 ℃,12 000 r/min,离心30 min,取上清液,BCA法测定蛋白含量。将蛋白上样缓冲液溶解,按照样品:5×蛋白上样缓冲液=4∶1,计算出蛋白上样缓冲液体积,充分混匀。根据各目标蛋白的分子量大小配置SDS-PAGE凝胶,上样后先选择80 V恒压电泳,30 min后再调至110 V,继续电泳约60 min。根据蛋白Marker指示,待溴酚蓝到达胶底部时停止电泳。将分离的蛋白转移至PVDF膜上,用5%脱脂奶粉室温封闭2 h。TBST洗3次,每次10 min,孵育SIRT1、STAT3、 IL-17或β-actin一抗(1∶1000),4 ℃冰箱过夜。第2天取出后,TBST洗3次,每次10 min,孵育辣根过氧化物酶标记的山羊抗兔或山羊抗小鼠IgG(1∶1000)1 h。TBST洗3次,ECL化学曝光显影。采用Image J分析条带灰度值。
1.2.6 ELISA法测定下游炎症因子IL-17表达 将所有试剂及样本平衡至室温;设置标准品孔、样品孔(至少3个),标准品孔各加入不同浓度的标准品50 μL;3个样品孔中加入样本50 μL(空白孔不加);除空白孔外,其他各孔加入辣根过氧化物酶(HRP)标记的IL-17抗体100 μL,用封板膜封住反应孔后,37 ℃温箱孵育1 h;弃去各孔液体,在吸水纸上拍干后加满350 μL洗涤液洗涤,静置1 min后甩干液体,如此重复5次;每孔加入底物A、B各50 μL,放入37 ℃温箱中避光孵育15 min;每孔加入50 μL终止液终止反应;15 min内通过酶标仪在450 nm波长处测定各孔的OD值。将样品的OD值分别带入所求得的直线回归方程中,分别计算出各组样品浓度。
2 结果
2.1 白藜芦醇对血管性痴呆大鼠学习记忆能力的影响 采用Morris水迷宫实验以确定白藜芦醇灌胃治疗后是否能改善血管性痴呆大鼠的学习与记忆能力。结果显示,与假手术组相比,VD模型组于第4天开始逃避潜伏期明显增加(P<0.01)。然而,白藜芦醇灌胃给药治疗30 d后,逃避潜伏期显著降低(P<0.05)。另外,除去平台后,与VD模型组相比,白藜芦醇治疗组通过原平台所在区域的次数和停留在目标象限的时间比例显著增加(P<0.05)。见图1。
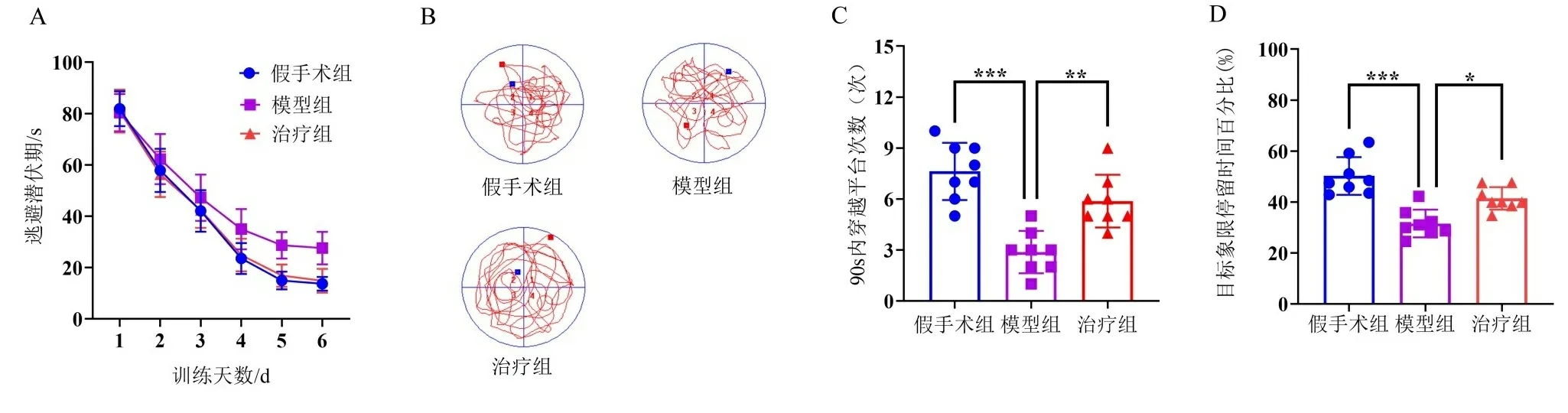
注:A.定位航行实验中各组大鼠找到平台时间(逃避潜伏期)比较;B.空间探索实验中各组大鼠的游泳轨迹示例图;C.空间探索实验中各组大鼠在90 s内穿越原平台次数比较;D.空间探索实验中各组大鼠在原平台所在象限停留时间百分比比较。*P<0.05,** P<0.01,***P<0.001。图1 Morris水迷宫实验检测各组大鼠的空间学习记忆能力
2.2 各组大鼠额叶皮质内SIRT1、STAT3、IL-17的免疫阳性神经元表达情况比较 结果表明,假手术组大鼠额叶皮质内可见SIRT1阳性神经元呈棕黄色深染,细胞散在分布,细胞轮廓呈小圆形或者椭圆形。VD模型组大鼠额叶皮质内SIRT1阳性细胞数较假手术组减少(P<0.001),胞质染色变淡,细胞平均灰度值升高(P<0.01);与VD模型组相比,VD治疗组大鼠额叶皮质内SIRT1阳性神经元深染,阳性神经元数量显著增多(P<0.01),平均灰度值明显降低(P<0.01)。此外,各组大鼠额叶皮质内均有STAT3、IL-17的表达,二者阳性神经元均呈棕黄色淡染;与假手术组比较,VD模型组STAT3和IL-17阳性神经元数量明显增多,平均灰度值均降低(P<0.01);与VD模型组比较,VD治疗组STAT3和IL-17阳性神经元数量显著增多,平均灰度值显著降低(P<0.05)。见图2。
2.3 各组大鼠额叶皮质中SIRT1、STAT3、IL-17的蛋白量表达变化 各组大鼠额叶皮质SIRT1、STAT3、IL-17蛋白表达与免疫组化染色结果趋势一致。与假手术组比较,VD模型组大鼠额叶皮质内SIRT1蛋白表达显著降低,而STAT3与IL-17蛋白表达显著升高(P<0.01);与VD模型组相比,白藜芦醇治疗组大鼠额叶皮质内SIRT1蛋白表达显著升高,而STAT3与IL-17蛋白表达则明显降低(P<0.05)。见图3。
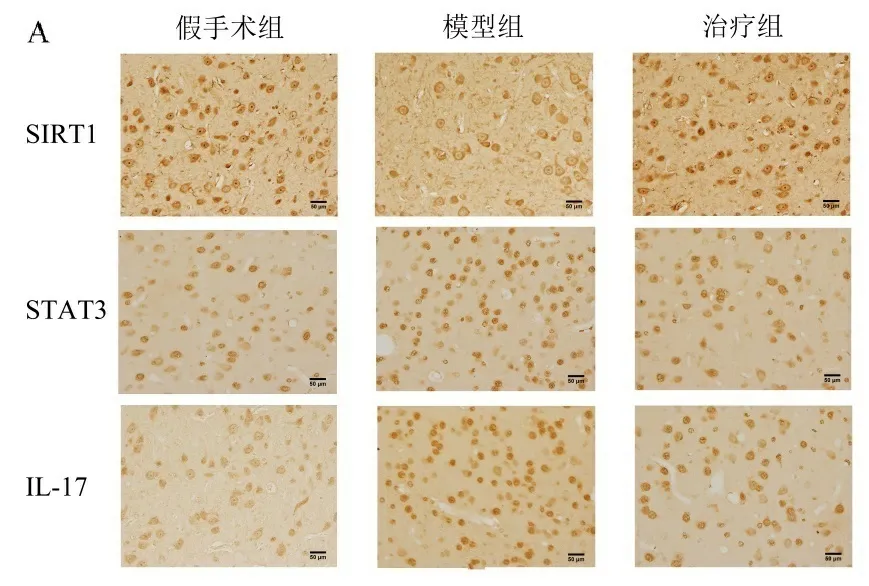

注:A.各组大鼠额叶皮质中SIRT1、STAT3、IL-17阳性神经元的染色示例图;B.各组大鼠额叶皮质中SIRT1、STAT3、IL-17平均阳性细胞数量比较;C.各组大鼠额叶皮质中SIRT1、STAT3、IL-17平均灰度值比较。放大倍数×400;标尺长度50 μm。*P<0.05,** P<0.01,***P<0.001。图2 免疫组织化学方法检测各组大鼠额叶皮质中SIRT1、STAT3及IL-17免疫阳性神经元表达情况


注:A.各组蛋白印迹示例图;B.各组大鼠额叶皮质中SIRT1蛋白相对表达量比较;
2.4 ELISA法检测各组大鼠中炎症因子IL-17的分泌情况 结果如图4所示,与假手术组比较,VD模型组炎症因子IL-17分泌显著增加(P<0.001);与VD模型组相比,白藜芦醇治疗组IL-17分泌显著降低(P<0.05)。
3 讨论
VD是仅次于阿尔茨海默症(alzheimer disease,AD)的第二大常见的痴呆类型,约占所有痴呆症患者的20%,预计到2050年,这一数字将增加两倍[3]。VD作为迄今为止唯一可防治的痴呆类型,若尽早干预治疗可有效延缓疾病进展,因此,寻找新的治疗策略至关重要。大鼠BCCAO可导致慢性脑灌注不足,本研究利用BCCAO法复制VD大鼠模型,是研究VD相关机制较为理想的动物模型。白藜芦醇具有多重有益的生物学效应,对各种神经退行性疾病起到神经保护作用,已被用作很多动物模型中治疗认知功能缺陷的药物。尽管许多研究报道了白藜芦醇与认知功能之间的密切联系,但其潜在机制仍不清楚。本课题组研究了白藜芦醇对VD大鼠空间学习记忆能力的影响。在Morris水迷宫实验中,与假手术组相比,模型组在空间探索实验中逃避潜伏期与穿越原平台次数均显著减少。而白藜芦醇灌胃治疗30 d后,可以逆转这一改变。这不仅证明了白藜芦醇治疗可以有效治疗VD大鼠的认知功能障碍,改善了VD大鼠的学习与记忆能力,同时也从侧面验证了造模成功。
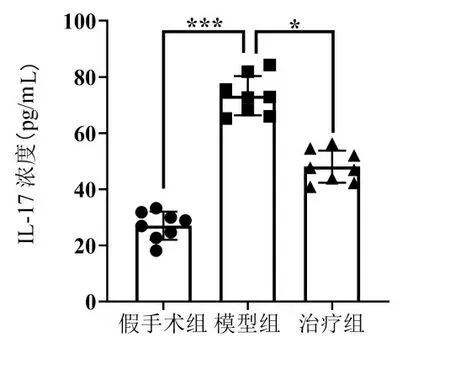
注:*P<0.05,***P<0.001。图4 各组大鼠血清炎症因子IL-17分泌情况比较(ELISA法)
炎症反应是脑缺血后引起脑细胞继发性损伤的重要因素,临床及基础实验研究均表明,炎症反应参与了神经系统疾病的发生发展过程,为VD的重要发病机制之一。据文献报道,对VD小鼠通过PNA5治疗后发现血清内TNF和IL-7含量降低,同时增加抗炎细胞因子IL- 10的表达水平;NF-κB(与炎症反应的放大和持续相关)参与脑缺血后的炎症反应;在 VD 动物模型中,CB2R 选择性激动剂能够减少大鼠脑灌注不足和VD时的记忆障碍和梗塞面积[14-16]。已有研究证明,VD早期即可产生炎症反应,患者的基因谱中与炎症相关的标志物含量增加,脑组织中广泛的炎症反应影响神经元的增殖、迁移、分化和存活,从而诱导了一系列行为和认知变化[17]。因此,以炎症为靶标进行VD医学干预,具有重要的医学科学意义。目前有关该病症的发病机制和治疗的研究中,大多数都集中在海马损伤上,对额叶皮质研究关注较少。额叶皮质作为大脑新皮质中的重要联络脑区,也参与了高级认知过程,在学习记忆等过程中发挥着重要作用[18]。同时,炎症反应不仅是VD重要的发生发展因素,还会影响额叶皮质功能,导致出现神经功能障碍[19]。作为SIRT1的有效激动剂,有证据表明白藜芦醇可能通过激活SIRT1信号通路从而逆转VD造成的神经损伤[20]。SIRT1通常被认为是炎症过程中的重要调节因子。例如,白藜芦醇可通过激活SIRT1有效改善锰诱导的氧化应激和神经炎症并通过去乙酰化修饰RelA/P65的Lys310残基,抑制 NF-κB的转录活性,进而抑制炎性基因表达,减少神经元损伤[21-22]。STAT3作为调节细胞因子诱导的促炎和抗炎反应的重要转录因子之一,可促进与炎症相关的基因表达,其激活可增加神经炎症相关的细胞因子分泌。在细胞核中 STAT3 含量增加,为调控大量炎性基因的表达发挥重要功能,促炎因子 IFN-γ可通过 JAK2/STAT3 促进 LPS、TNF-α、IL-1等引起的炎症反应,而抗炎因子 IL-10、IL-4 也可通过该通路抑制炎症反应的发展[23]。研究表明,SIRT1可激活诱导STAT3去乙酰化,从而降低其易位到细胞核与Rorc启动子结合的趋势并诱导其转录的能力同时降低小鼠和人类Th17细胞的分化从而下调IL-17A,其在炎症的发生发展中具有一定作用[24]。基于上述发现,假设白藜芦醇可能通过调节SIRT1/STAT3信号通路调节参与VD引起的炎症反应。本实验采用免疫组织化学染色及Western blot法探究SIRT1/STAT3在VD大鼠模型中表达情况。实验结果一致表明,SIRT1被白藜芦醇激活后可在一定程度下调STAT3及其下游炎症因子IL-17的表达。为了进一步探讨激活SIRT1/STAT3信号通路后下游炎症因子变化情况,本研究通过ELISA法检测各组IL-17的表达情况。结果证实,激活SIRT1/STAT3信号通路可以有效改善VD引起的炎症反应。
综上,目前的研究表明,白藜芦醇可能具有治疗VD大鼠认知功能损伤的潜力,其通过激活SIRT1/STAT3信号通路下调下游炎症相关因子释放,抑制 VD 引起的炎症性损伤,进而改善 VD 大鼠的学习、记忆障碍。然而,由于VD引起炎症性损伤机制复杂,本研究的发现可能为VD提供了有益的治疗干预靶点,但其确切机制仍有待于未来实验的进一步探索。
