LRG1、TLR4在脓毒症患者血清中表达水平及临床意义
2022-09-10冉悦廖品琥
冉悦,廖品琥
(广西医科大学第一附属医院急诊科,广西 南宁 530000)
脓毒症(sepsis)是一种全身炎症反应综合征(systemic inflammatory response syndrome,SIRS),发病机制复杂,免疫炎症级联放大反应是其机制之一[1-2]。尽管关于脓毒症的研究已经进行了30多年,关于脓毒症生理病理的研究不断加深,脓毒症患者死亡率居高不下。尽管现代医学诊断技术、抗生素的使用、连续肾脏替代疗法、机械通气等医疗手段不断进步,脓毒症依旧是全世界范围内ICU患者死亡的主要原因。因此脓毒症的早期识别和精准治疗意义重大。
富亮氨酸-α-2糖蛋白1(leucine-rich-alpha-2-glycoprotein-1,LRG1)是一种重要的促炎细胞因子,近年来越来越多的研究发现LRG1在多种免疫炎症性疾病的发生发展中起重要的作用[3-4]。Toll样受体4(toll-like receptor 4,TLR4)属于Ⅰ型跨膜蛋白,可被多种病原体相关分子模式识别,其信号转导通路在启动先天性免疫应答中起重要作用,通过促进炎症细胞和趋化因子的释放,从而引发脓毒症的炎症免疫反应[5]。本研究观察脓毒症患者血清中LRG1、TLR4表达情况并分析其临床意义。
1 对象与方法
1.1 研究对象 选取2019年9月—2021年12月来源于广西医科大学第一附属医院脓毒症患者34例为脓毒症组,男23例,女11例,年龄37~87岁,平均年龄(59.79±11.39)岁。根据病情严重程度分为休克组(n=21)和非休克组(n=13),根据入院28 d预后情况分为存活组(n=28)和死亡组(n=6)。随机选取同时期同医院进行健康体检人员19例为对照组,男13例,女6例,年龄41~79岁,平均年龄(56.95±9.74)岁。两组性别、年龄差异无统计学意义。本研究经广西医科大学第一附属医院医学伦理会同意,患者均知情同意。诊断标准:符合脓毒症诊断标准[6]和脓毒症休克诊断标准[7]、有明显的感染灶。排除对象:孕产妇、哺乳期妇女;恶性肿瘤、自身免疫性疾病、精神病病史、血液系统疾病患者;不配合治疗、资料收集不齐全患者;年龄<18岁患者。
1.2 血清LRG1及TLR4水平检测方法 采集所有患者入院后静脉血样本(体检健康者于体检当日)后,4 ℃、3 000 r/min离心10 min,收集上清存放于-80 ℃超低温冰箱,采用酶联免疫吸附法检测血清LRG1、TLR4含量。检测试剂盒购于上海酶联生物科技公司,操作步骤严格按照试剂盒说明书进行。使用多功能酶标仪在450 nm波长下依次测定每孔OD值,应用SPSS 20.0软件绘制标准曲线并计算出对应样本浓度。

2 结果
2.1 LRG1与TLR4在脓毒症组和对照组血清表达水平 脓毒症组患者血清LRG1、TLR4表达水平明显高于对照组,差异具有统计学意义(P<0.05),见表1。
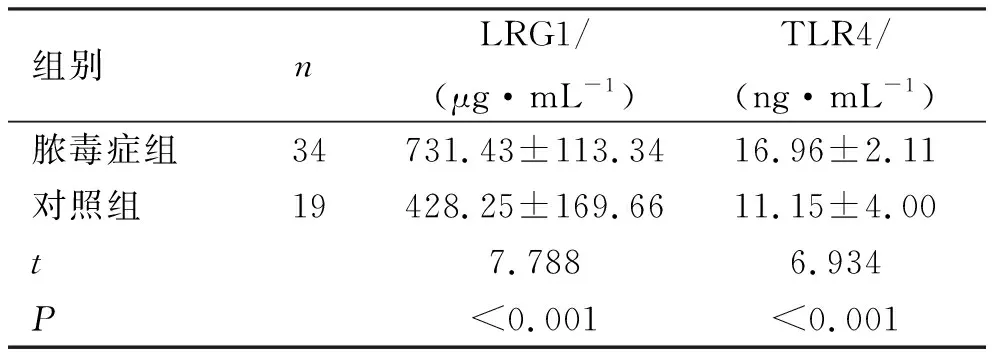
表1 LRG1与TLR4在脓毒症组和对照组血清表达水平
2.2 LRG1与TLR4在不同严重程度患者血清表达水平 脓毒症患者血清LRG1、TLR4表达水平休克组明显高于非休克组,差异具有统计学意义(P<0.05),见表2。
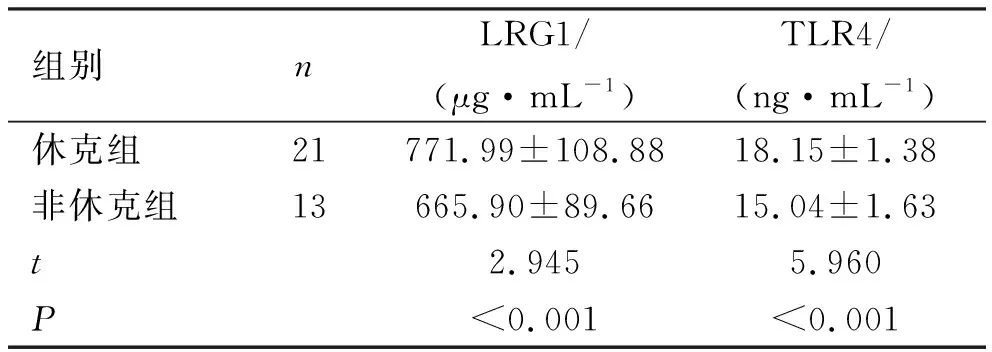
表2 LRG1与TLR4在不同严重程度患者血清表达水平
2.3 脓毒症患者死亡组和存活组患者血清LRG1、TLR4水平比较 脓毒症患者经治疗后死亡6例,存活28例,死亡率为17.65% ;死亡组患者血清LRG1、TLR4相对表达量显著高于存活组,差异具有统计学意义(P<0.05),见表3。
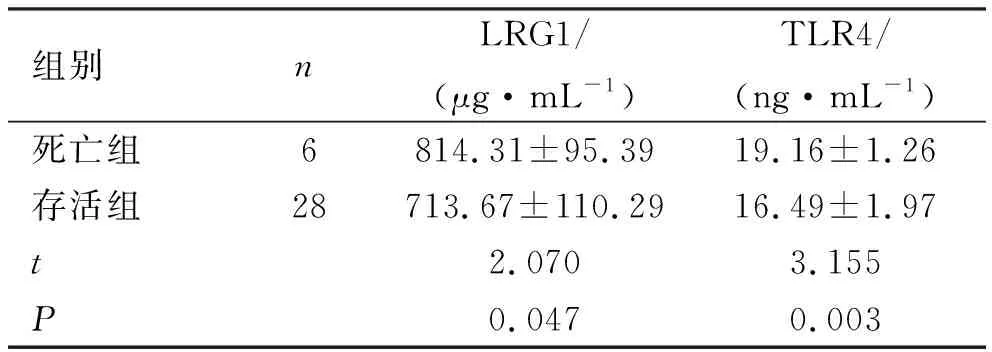
表3 脓毒症患者死亡组和存活组血清LRG1、TLR4水平比较
2.4 LRG1、TLR4与病情严重程度和预后的相关性分析 经Spearman相关性分析,脓毒症患者LRG1、TLR4表达水平均与脓毒症疾病严重程度呈显著正相关,与预后情况呈显著负相关,见表4。
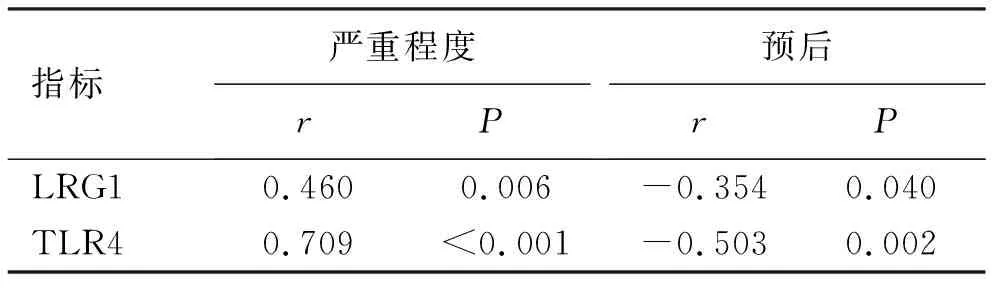
表4 脓毒症患者血清LRG1、TLR4与病情严重程度和预后的相关性分析
3 讨论
脓毒症是机体对感染反应失调导致的危及生命的多器官功能障碍,给患者的健康带来严重的威胁[6]。脓毒症早期临床表现主要是凝血系统功能障碍,随着病情的恶化,导致脓毒症休克的发生,难以纠正的休克状态和多器官灌注不足使脓毒症患者很容易发生多器官功能损害和死亡,增加了脓毒症患者发病率和死亡率[8]。有研究表明[9],脓毒症发病率和死亡率在不同收入国家有着明显的差距,全球死亡病例约20%与脓毒症有关。我国流行病学调查显示[10],脓毒症影响了中国大陆1/5的ICU患者,其90 d病死率为35.5%。脓毒症发生的病理生理原因复杂,严重炎症反应失衡是其发生的原因之一[1],临床上尚没有脓毒症特效治疗方法,因此快速评估病情、积极对症治疗对降低脓毒症患者死亡率具有重要意义。
LRG1是一种分泌型糖蛋白,主要由肝细胞和中性粒细胞合成表达[11],在参与神经系统突触的形成、神经过程的发育、神经递质传递释放等正常生理活动中起重要作用[12]。LRG1的异常表达多见于炎症免疫性疾病和恶性肿瘤性疾病,在哮喘[13]、急性阑尾炎[14]、狼疮性肾炎[15]、细菌性脑膜炎[16]、炎症性肠病[17-18]、类风湿关节炎[19]等疾病中表达显著升高,参与多种炎症疾病的发生发展。有研究表示,LRG1作为炎症性疾病的生物学标记,主要通过促进TGF-β信号通路依赖Smads和非依赖Smads途径导致炎性介质的释放来参与免疫炎症性疾病[20-21];LRG1可以在中心粒细胞早期被分化,通过激活中心粒细胞导致机体发生炎性反应[22];在炎性条件下,促炎细胞因子IL-6、TNF-α、IL-1β可以促进单核细胞和中性粒细胞中LGR1的产生,直接参与炎症性疾病的发病机制[23]。生物信息学研究分析发现[24],LRG1在脓毒症患者体内高表达,提示LRG1是脓毒症潜在新生标志物和治疗靶点,LRG1及其相关信号通路的研究,可以为脓毒症的治疗提供新的思路。有研究[25]通过LPS诱导建立脓毒症脑损伤小鼠模型发现,LRG1在模型组小鼠脑组织中表达明显升高,LRG1基因的沉默可以逆转LPS诱导小鼠神经元细胞产生的炎症反应和细胞凋亡,进一步的机制研究发现,沉默LRG1可通过抑制TGF-β1/Smad信号通路减轻脓毒症脑损伤,体内体外研究均表明LRG1可能是治疗脓毒症脑损伤的潜在靶点。目前LRG1关于脓毒症疾病的临床研究匮乏。本研究结果发现,脓毒症组血清LRG1表达水平较对照组显著升高,且随着脓毒症病情的加重,LRG1的表达呈上升趋势,同时死亡组患者LRG1表达水平显著高于存活组,Pearson相关性分析发现,LRG1表达水平与脓毒症严重程度呈正相关,与预后情况呈负相关,说明LRG1是评估脓毒症疾病严重程度和预后情况的炎性指标,可作为脓毒症诊断和治疗的潜在靶点。
TLR家族有13个成员,其中TLR4的研究最为广泛。TLR4参与识别细菌多糖介导的炎症反应信号转导,革兰阴性杆菌释放的脂多糖或应激产生内源性配体能与TLR4结合,启动细胞内炎症信号转导通路激活下游靶基因,促进释放细胞炎性介质和相关细胞因子[26],诱导中性粒细胞在肺组织的聚集[27],引发瀑链式炎症反应,可导致机体稳态失衡以及多器官功能衰竭[28]。在宿主防御非感染性损伤中,TLR4可以被可溶性透明质酸、饱和脂肪酸、纤维连接蛋白和高迁移率族蛋白1等内源性基质激活以促进组织修复[29-30]。TLR4是先天免疫反应中的主要细胞因子,作为宿主抵御感染的第一道防线,在脓毒症发展进程中起着关键作用[5]。TLR4及其相关信号通路的研究有助于了解脓毒症发病机制,为脓毒症治疗提供新的策略。有研究通过建立脓毒症急性肾损伤(AKI)小鼠模型发现,TLR4信号通路在LPS刺激下被激活,导致严重的AKI,敲除TLR4基因的小鼠肾脏功能较模型组得到很大改善,说明TLR4基因的敲除对肾小管和肾小球的功能起保护作用[31]。有临床研究报道,脓毒症患者血清TLR4表达水平较正常人显著升高,且随着脓毒症病情加重,TLR4的表达水平也随之升高,进一步通过Spearman相关性分析发现,血清TLR4表达水平与脓毒症病情严重程度呈正相关[32]。本研究结果与之相似,说明TLR4在脓毒症患者血清中表达升高是一种普遍现象。本研究还发现,死亡组TLR4表达水平明显高于存活组,休克组显著高于非休克组,说明TLR4与脓毒症患者预后情况和严重程度有关,与江磊[33]的研究结果相似。本研究证实了TLR4在脓毒症疾病中的诊断和预后价值。
综上所述,本研究结果表明脓毒症患者血清LRG1、TLR4表达显著升高,且休克组显著高于非休克组,死亡组显著高于存活组。Spearman相关性研究进一步表明,LRG1、TLR4的表达与脓毒症严重程度呈正相关性,与预后情况呈显著负相关。本研究说明临床上检测患者血清LRG1、TLR4表达水平可用于评估脓毒症病情严重程度和预后情况,为临床上脓毒症的诊断和治疗提供新的方向和理论依据。
