碳青霉烯类耐药肠杆菌目细菌对头孢他啶/阿维巴坦的耐药率及耐药机制研究
2022-09-09张琦刘亚婕闫文娟荆楠袁有华王山梅李轶
张琦,刘亚婕,闫文娟,荆楠,袁有华,王山梅,李轶*
1 河南省人民医院检验科, 郑州大学人民医院检验科,河南大学人民医院检验科,郑州 450003;2平顶山市妇幼保健院检验科,平顶山 467000
近年来,随着碳青霉烯类抗菌药物的临床应用范围和使用量的不断增加,碳青霉烯类耐药肠杆菌目细菌(carbapenem~resistantEnterobacterales,CRE)已成为影响全球公共健康的重大问题。美国疾病控制与预防中心将CRE定义为满足以下任意1个条件的肠杆菌目细菌:①对亚胺培南、美罗培南、厄他培南或多利培南等任何一种碳青霉烯类抗菌药物耐药者;天然对亚胺培南敏感性低的细菌(如摩根菌属、变形杆菌属和普罗威登斯菌属等),需参考除亚胺培南外其他碳青霉烯类抗菌药物的药敏结果。②产生碳青霉烯酶者[1]。据全国细菌耐药监测网(China Antimicrobial Resistance Surveillance System,CARSS)数据显示,全国1371所医院临床分离的肺炎克雷伯菌对碳青霉烯类抗菌药物的平均耐药率从2013年的4.9%上升至2020年的10.9%[2]。其中,河南省的碳青霉烯类耐药肺炎克雷伯菌(carbapenem~resistantKlebsiella pneumoniae,CR~KP)检出率从2014年的9.4%迅速升至2020年的30.2%[2],且连续多年位居榜首。由于CRE菌株通常合并多种耐药机制,仅对多黏菌素、替加环素等极少数药物敏感,且临床上治疗药物有限,导致CRE感染病死率高、患者经济负担大。2019年,新型β~内酰胺类抗菌药物/β~内酰胺酶抑制剂复合物——头孢他啶/阿维巴坦(ceftazidime/avibactam,CAZ/AVI)在我国上市,用于治疗复杂性腹腔感染、医院获得性肺炎(包括呼吸机相关肺炎)和CAZ/AVI敏感、治疗方案有限的多重耐药革兰阴性菌(包括CRE)引起的感染。本研究通过检测本院临床分离的CRE菌株对CAZ/AVI的药敏情况,分析相关耐药表型和基因型,初步探讨CRE菌株对CAZ/AVI的耐药机制,以期为临床精准、合理用药和耐药细菌监测提供参考依据。
1 材料和方法
1.1 菌株来源
收集2020年1月~2021年6月本院临床分离的CRE菌株[亚胺培南和/或美罗培南耐药,最低抑菌浓度(minimum inhibitory concentration,MIC)≥4μg/ml]为研究对象,并剔除同一患者相同部位分离的重复菌株,最终纳入1692株。
1.2 质控菌株
质控菌株为大肠埃希菌ATCC25922,购于国家卫生健康委临床检验中心。
1.3 试剂
哥伦比亚血平板(安图生物科技有限公司,批号:20210525B);MH琼脂平板(安图生物科技有限公司,批号:20210414B);CZA/AVI药敏纸片(英国Mast公司,批号:472416);2×Taq PCR Master Mix(上海莱枫生物科技有限公司,批号PT102~02);PCR引物[生工生物工程(上海)股份有限公司,批号:260098225];GoldView核酸染色剂(大连美仑生物技术有限公司,批号:Mar~29D);D2000 DNA Marker(大连美仑生物技术有限公司,批号:MA0179); 缓冲液(碳青霉烯酶)[珠海迪尔生物工程股份有限公司,批号:20200527,包括3~氨基苯硼酸(phenylboronic acid,PBA)溶液和乙二胺四乙酸(ethylenediamine tetraacetic acid,EDTA)溶液];NG TestCARBA 5检测试剂盒(法国NG Biotech公司,批号:W2012021)。
1.4 仪器
Phoenix~100 全自动细菌鉴定药敏系统(美国BD公司);IVD MALDI Biotyper基质辅助激光解吸电离飞行时间质谱 (MALDI~TOF MS)质谱仪(德国布鲁克公司);T100型PCR仪(美国Bio~Rad 公司) 。
1.5 菌株鉴定
采用 MALDI~TOF MS 和 Phoenix~100 全自动细菌鉴定药敏系统对菌株进行菌种鉴定。
1.6 药物敏感性试验
采用Phoenix~100全自动细菌鉴定药敏系统检测22种抗菌药物(氨苄西林、氨苄西林/舒巴坦、阿莫西林/克拉维酸、哌拉西林、哌拉西林/他唑巴坦、头孢唑林、头孢呋辛、头孢他啶、头孢噻肟、头孢吡肟、氨曲南、亚胺培南、美罗培南、庆大霉素、阿米卡星、复方磺胺甲唑、环丙沙星、左氧氟沙星、四环素、氯霉素、多黏菌素B、替加环素)的MIC;采用微量肉汤稀释法进行CAZ/AVI的药敏试验。按照美国临床实验室标准化协会(Clinical and Laboratory Standards Institute,CLSI)的M100文件[3]标准对药敏折点进行判断, 其 中 CAZ/AVI的 MIC≤8μg/ml为 敏 感,MIC≥16μg/ml为耐药。
1.7 耐药表型检测
采用碳青霉烯酶抑制剂增强试验测定CRE菌株的耐药表型。将0.5MCF的CRE菌悬液均匀涂布于MH 琼脂平板上,每个平板上贴4张亚胺培南纸片,其中1张纸片不滴加任何液体,1张纸片滴加10μl PBA溶液,1张纸片滴加10μl0.1mol/L的EDTA溶液,1张纸片同时滴加PBA和EDTA溶液各10μl。将MH 琼脂平板置于35℃条件下孵育16~18h,并测定抑菌圈直径。结果判读标准:若滴加PBA溶液使抑菌圈直径扩大5mm以上,判断为产A类碳青霉烯酶;若滴加EDTA溶液使抑菌圈直径扩大5mm以上,判断为产B类碳青霉烯酶;若同时滴加PBA和EDTA溶液使抑菌圈直径扩大5mm以上,则判断为同时产A类和B类碳青霉烯酶[1]。
1.8 碳青霉烯酶耐药基因检测
采用酶免疫层析技术快速检测肺炎克雷伯菌碳青霉烯酶(Klebsiellapneumoniaecarbapenemase,KPC)、新德里金属β~内酰胺酶(New Delhi metallo~β~lactamse,NDM)、 维 罗 纳 整 合子编码的金属β内酰胺酶(Verona integron~encoded metallo~β~lactamase,VIM)、 亚 胺 培南酶型金属β~内酰胺酶(imipenemase~type metallo~β~lactamase,IMP)和苯唑西林酶 ~48(oxacillinases~48,OXA~48)5种碳青霉烯酶,按照NG TestCARBA 5检测试剂盒产品说明书操作。采 用 PCR 方 法 检 测blaKPC,blaNDM,blaIMP,blaVIM,blaOXA~48~like5种最常见的碳青霉烯酶耐药基因,引物设计参考文献方法[4],并由生工生物工程(上海)有限公司合成。PCR 反应体系为20μl,包括2×Taq PCR Master Mix 10μl,上游引物及下游引物各 1μl,DNA 模板 2μl,ddH2O6μl。PCR 反应条件:94℃预变性3min;94℃变性30s,60℃退火45s,72℃延伸45s,共30个循环;72℃延伸4min。PCR扩增产物送至生工生物工程(上海)有限公司测序,序列经BLAST数据库(https://blast.ncbi.nlm.nih.gov/Blast.cgi)进行比对分析。
1.9 blaKPC-2基因表达水平检测
以5株CAZ/AVI耐药、仅携带blaKPC~2基因的CR~KP菌株为实验组(MIC≥16mg/L)。采用随机数字表法,随机选取6株CAZ/AVI敏感、仅携带blaKPC~2基因的CR~KP菌株为对照组(MIC≤0.5mg/L),采用实时荧光定量PCR(real~time quantitative PCR,RT~qPCR)检测两组blaKPC~2基因表达水平。荧光反应体系:cDNA 1μl,Primer F 0.5μl,Primer R 0.5μl,SYBR Green Master 12.5μl,RNase~free water 10.5μl。PCR反应条件:95℃预变性10min;95℃变性10s,60℃退火 40s,共 40个循环;95℃ 15s;60℃ 1min;95℃ 30s;60℃ 15s。管家基因pgi作为内部参照基因,采用Δ ΔCT相对定量模型,每个细菌的RNA均提取3次,cDNA检测时重复3孔。
1.10 统计学方法
基因的相对表达量采用双尾成组t检验,并进行Welch校正。P<0.05为具有统计学差异。采用GraphPad Prism V 9.3.1对数据进行统计分析及制图。
2 结果
2.1 CRE菌株对CAZ/AVI的耐药性
2020年1月~2021年6月期间本院共收集1692株CRE菌株,CAZ/AVI耐药菌株共101株,总体耐药率为6.0%。其中,CR~KP的耐药率仅为2.9%;大肠埃希菌的耐药率为30.1%;雷氏普罗威登斯菌和弗劳地枸橼酸杆菌的耐药率均高于40%。在CAZ/AVI耐药的CRE菌株中,CR~KP(29株,28.7%)居首位,大肠埃希菌(25株,24.8%)、阴沟肠杆菌(19株,18.8%)次之。见表1。
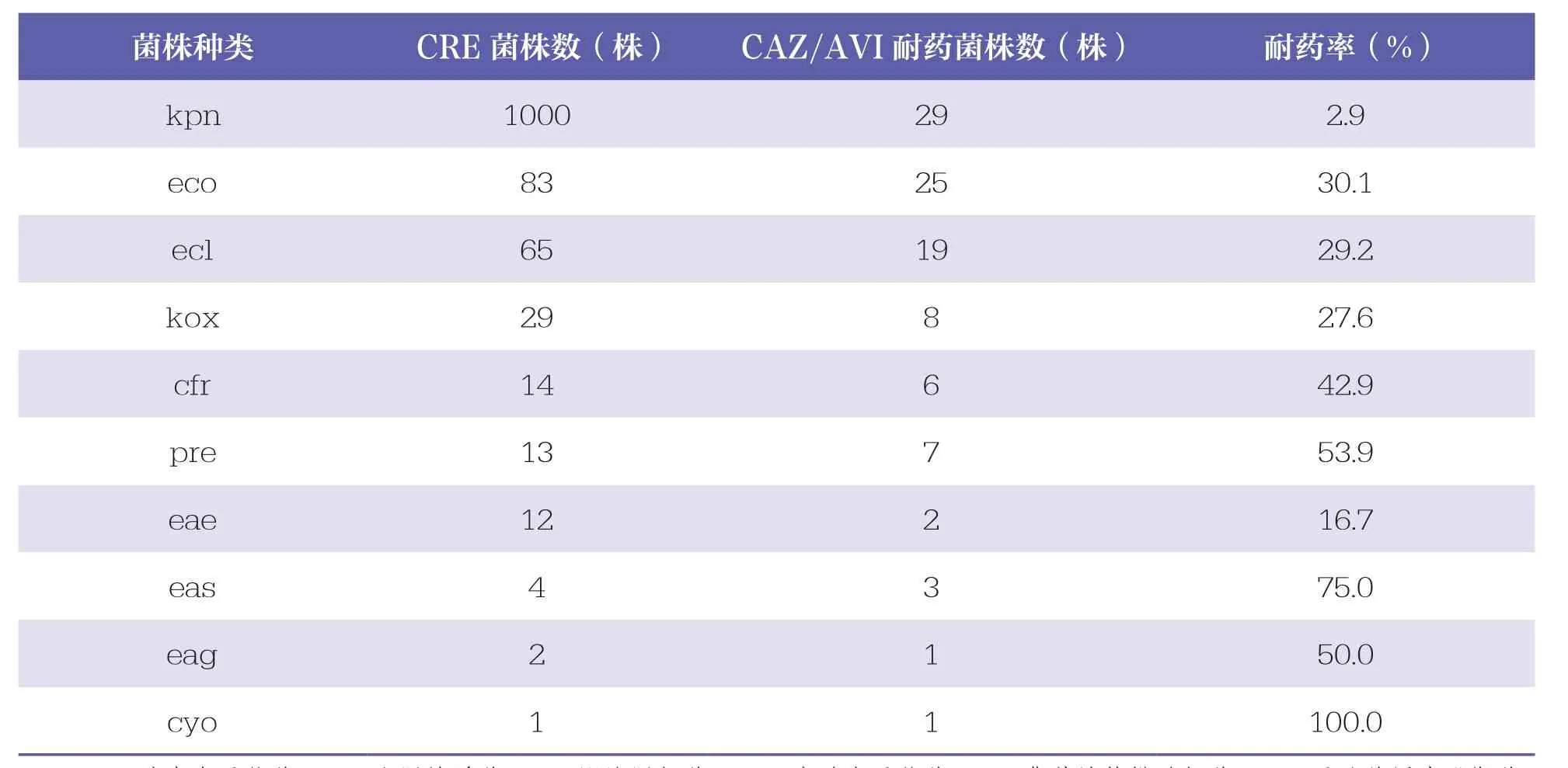
表1 CAZ/AVI耐药的CRE菌株种类分布和数量
2.2 CAZ/AVI耐药的CRE菌株药敏情况
101株CAZ/AVI耐药的CRE菌株对青霉素类、头孢类抗菌药物全部耐药;对氨曲南、亚胺培南、美罗培南和多黏菌素的耐药率分别为73.3%、99.0%、100%和3.2%;对替加环素全部敏感。详见表2。

表2 101株CAZ/AVI耐药的CRE菌株的药敏试验结果
对保留的32株CAZ/AVI耐药的CRE菌株进行测定,其CAZ/AVI的MIC分布范围是16~128μg/ml,MIC50为>128μg/ml,MIC90为 >128μg/ml。见表3。
2.3 CAZ/AVI耐药的CRE菌株耐药表型和基因型
对32株CAZ/AVI耐药的CRE菌株进行碳青霉烯酶抑制剂增强试验,结果提示单产金属酶19株(59.4%),丝氨酸酶联合金属酶7株(21.9%),单产丝氨酸酶5株(15.6%),酶型阴性1株(3.1%)。进一步通过酶免疫层析法、PCR及测序发现,32株CRE菌株携带的碳青霉烯酶基因分别为:blaNDM~1(12 株,37.5 %)、blaNDM~5(7 株,21.9%)、blaKPC~2联合blaNDM~1(5 株,15.6%)、blaKPC~2联合blaNDM~5(2 株,6.3%)、blaKPC~2(5 株,15.6%)以及blaKPC~33(1株,3.1%)。单产金属酶的CRE菌株中,12株携带blaNDM~1基因,以CR~KP和阴沟肠杆菌为主;7株携带blaNDM~5基因,以大肠埃希菌为主。同时产丝氨酸酶和金属酶的CRE菌株均为CR~KP,以携带blaKPC~2、blaNDM~1基因为主。单产丝氨酸酶的CRE菌株均为携带野生型blaKPC~2基因的CR~KP;酶型阴性的1株为CR~KP,同时酶
免疫层析法检测也为阴性,经PCR和测序证实为携带blaKPC~33基因。提高AVI浓度至 8μg/ml后,6株单产KPC酶的CR~KP对CAZ/AVI的MIC均下降至敏感水平,其中携带blaKPC~2基因的CR~KP菌株 MIC 下降至 0.25~1μg/ml,携带blaKPC~33基因的CR~KP菌株MIC下降至8μg/ml;单产金属酶以及产金属酶联合丝氨酸酶的CRE菌株中,仅有4株菌株的MIC有所下降,但仍表现为耐药。见表3。

表3 32株CAZ/AVI耐药的CRE菌株对CAZ/AVI的药敏试验结果及耐药表型和基因型特征

续表
2.4 CAZ/AVI耐药、单产KPC-2酶的CR-KP菌株blaKPC-2基因表达情况
以5株CAZ/AVI耐药(MIC≥16μg/ml)且单产野生型KPC~2酶的CR~KP菌株作为实验组,随机选取6株CAZ/AVI敏感(MIC≤0.5μg/ml)且单产野生型KPC~2酶的CR~KP菌株作为对照组,采用RT~qPCR方法检测两组blaKPC~2基因的表达水平。结果表明实验组blaKPC~2基因相对表达量(17.48±9.94)高于对照组(4.12±3.44,P=0.0368)。见图1。

图1 CAZ/AVI实验组和对照组blaKPC-2基因表达水平比较
3 讨论
3.1 CRE菌株对CAZ/AVI的耐药性分析
CAZ/AVI是第三代头孢菌素和新型非β~内酰胺酶类的β~内酰胺酶抑制剂相结合的复合物,2015年由美国食品药品监督管理局(FDA)批准上市,2019年5月由我国国家药品监督管理局批准上市。AVI与经典β~内酰胺酶抑制剂(克拉维酸、舒巴坦、他唑巴坦)不同,其结构不含β~内酰胺环,酰化反应可逆,可开环后再环合,进而显著增强头孢他啶的抗菌活性,对产A类酶(KPC等)、C类酶(AmpC)和部分D类酶(OXA~48)等丝氨酸酶的菌株具有高度抗菌活性,但对产B类酶(金属酶)的菌株无抗菌活性[1]。
CAZ/AVI对肠杆菌目细菌等革兰阴性杆菌显示出较好的抗菌活性。国外多项研究报道表明肠杆菌目细菌对CAZ/AVI的耐药率为0%~1.8%[5]。来自美国、欧洲和拉丁美洲的研究数据表明产超广谱β~内酰胺酶(extended spectrum~β~lactamases,ESBLs)的肠杆菌目细菌耐药率为0%~0.1%,CHINET CRE细菌耐药率为 0%~18%[6~9]。我国 2017 年 CHINET 中国细菌耐药监测网数据显示,1774株肠杆菌目细菌对CAZ/AVI的耐药率为5.4%,372株CRE菌株的耐药率为24.7%[10]。本研究中,1672株CRE菌株对CAZ/AVI的整体耐药率为6.0%,低于CHINET数据(24.7%),与美国和意大利的研究结果相近,均低于 10.0%[11~12]。CRE 菌株中,CR~KP 占比最高(1000株,59.1%),对CAZ/AVI的耐药率为2.9%,与 Zhang 等[13]和 Galani等[14]的研究结果类似,低于CHINET数据(15%)[10]。CRE菌株中的大肠埃希菌、阴沟肠杆菌和产酸克雷伯菌对CAZ/AVI的耐药率相当(P>0.05),与Zhou等[15]报道的南京市CRE菌株对CAZ/AVI的耐药率(21.6%)较为接近。
3.2 CRE菌株对CAZ/AVI的耐药机制
3.2.1 产金属酶
AVI是一种基于二氮杂二环辛烷(diazabicyclooctane,DBO)的丝氨酸酶抑制剂,可抑制A类酶、C类酶和部分D类酶等丝氨酸酶的表达,但是对金属酶无抑制作用或仅表现为微弱的结合作用[16~17]。锌离子依赖的金属酶与丝氨酸酶结构不同,不具有亲核丝氨酸残基[18]。B1亚类(NDM~1,SPM~1,BcII,VIM~1,VIM~2 和VIM~4等)、B2亚类(CphA等)和B3亚类(L1,FEZ~1等)的金属酶都可以催化AVI发生水解,从而表现为对 CAZ/AVI耐药[17,19]。
本研究中CRE菌株对CAZ/AVI产生耐药性的最主要原因是产金属酶(26株,81.3%),包括单产金属酶菌株(19株,59.4%)和产金属酶联合丝氨酸酶菌株(7株,21.9%)。26株产金属酶的CRE菌株均为NDM型,且以NDM~1(17株,65.4%)为主,NDM~5(9株,34.6 %)次之。大肠埃希菌以单产NDM~5酶为主,阴沟肠杆菌以单产NDM~1酶为主,肺炎克雷伯菌以产KPC~2酶联合NDM~1酶为主,耐药基因在不同细菌种类的分布与CHINET数据一致[10]。产NDM~1酶和NDM~5酶的CRE菌株对CAZ/AVI的MIC均表现为高水平耐药,即使将AVI浓度提高到8μg/ml,仍不能有效降低MIC,提示NDM~1酶和NDM~5酶对AVI都具有高度水解作用。
3.2.2 blaKPC-2基因高表达
尽管CAZ/AVI对KPC酶有强抑制作用,但有研究发现某些CR~KP菌株中blaKPC基因的高表达也会导致菌株对 CAZ/AVI耐药[13,20]。Zhang 等[13]研究发现,32株CAZ/AVI耐药的CR~KP菌株中,有12株(37.5%)仅携带blaKPC~2基因、不产金属酶,与CAZ/AVI敏感的CR~KP菌株相比,blaKPC~2基因的相对拷贝数和相对表达量分别升高2.5倍和2.7倍。Humphries等[20]报道了1例未使用CAZ/AVI治疗的患者,其血液中分离出携带blaKPC~3基因的CR~KP菌株,且对CAZ/AVI呈现低水平耐药(MIC为32μg/ml),与自身分离的CAZ/AVI敏感CR~KP菌株相比,blaKPC~3基因的相对表达量升高(3.8±0.2)倍。Shen等[21]研究发现,在24株CR~KP菌株中,与2个对照组(MIC为1~2μg/ml 和 MIC≤0.5μg/ml)相比,CAZ/AVI的 MIC 升高组(4~8μg/ml)的blaKPC~2基因相对表达水平分别升高4.2倍和4.8倍(P<0.05)。本研究的18株CAZ/AVI耐药CR~KP菌株中,66.7%的菌株单产金属酶或产金属酶联合丝氨酸酶,表现为对CAZ/AVI的高水平耐药(MIC≥64μg/ml);33.3%的CR~KP菌株单产野生型KPC~2酶,表现为对CAZ/AVI的低水平耐药(MIC为16μg/ml),其blaKPC~2基因表达水平比CAZ/AVI敏感株升高4.24倍;提高AVI浓度(8μg/ml)后,可降低CAZ/AVI对菌株的MIC,使其恢复到敏感水平。该结果提示,本研究所分离的CR~KP菌株中,单产或合并产金属酶可能是其对CAZ/AVI耐药的主要原因,此外部分CR~KP菌株由于blaKPC~2基因高表达导致低水平耐药,与国内外研究较一致[13,20]。
3.2.3 blaKPC基因突变形成不同亚型
自CAZ/AVI上市以来,国内外已有研究发现少数患者应用治疗一段时间后,体内CR~KP菌株的KPC酶Ω环发生氨基酸的替换等变化,对CAZ的水解能力显著增强,且不被AVI抑制,从而由CAZ/AVI敏感的野生型KPC酶,变为CAZ/AVI耐药的KPC亚型[5,22]。其中,最常见的是Ω环上179位点出现酪氨酸对天冬氨酸的替换(D179Y),形成新的KPC酶亚型,即KPC~33。 Gaibani等[23]报道了1例意大利患者使用CAZ/AVI治疗17天后,携带blaKPC~3基因的CR~KP菌株发生了D179Y突变,对CAZ/AVI从敏感变为耐药。Giddins等[24]报道了1例美国患者接受CAZ/AVI治疗12天后,携带blaKPC~2基因的 ST307型 CR~KP 菌株发生D179Y和532G→T突变,CAZ/AVI的MIC由3μg/ml升高为256μg/ml。我国上海、河南和北京也先后报道了肺炎克雷伯菌经过CAZ/AVI暴露后,blaKPC~2基因发生D179Y突变,野生型KPC~2酶变成KPC~33亚型,表现为对CAZ/AVI耐药,但是对碳青霉烯类抗菌药物敏感[25~27]。本研究中,有1株CR~KP菌株携带blaKPC~33基因,对CAZ/AVI高水平耐药(MIC为64μg/ml),对亚胺培南敏感(MIC为1μg/ml),该菌株的基因型和药敏特征与国内外研究相符[23~27]。同时,携带blaKPC~33基因的CR~KP菌株在碳青霉烯酶抑制剂增强试验和酶免疫层析法检测中都表现为阴性,仅可通过PCR和测序的方法得以鉴别。该结果提示在临床工作中,如果遇到表型试验和药敏结果不相符的情况,需进一步通过PCR或测序等方法确证。
除D179Y突变外,目前已有报道表明多种不同blaKPC基因突变导致的KPC酶亚型出现,例如KPC~3发生A172T突变成为KPC~39[28];KPC~3的276和277位之间插入3个氨基酸谷氨酸~丙氨酸 ~ 缬氨酸(Glu~Ala~Val)变为 KPC~50[29];KPC~2发生D179N、Y241H、H274N突变成为KPC~51;KPC~2发生 D179Y突变和262位插入缬氨酸变为 KPC~52[30];KPC~2的 267和 268位之间插入脯氨酸~天冬酰胺~天冬酰胺~精氨酸~丙氨酸(Pro~Asn~Asn~Arg~Ala)5个氨基酸变为KPC~93[31]等。这些新的KPC亚型通常在患者使用CAZ/AVI治疗后出现,极少数在未接受CAZ/AVI治疗的患者中出现。但KPC发生天然突变的概率较低,且目前关于KPC亚型的研究多为个例报道,尚有待进一步观察。
4 小结
本研究尚具有一定局限性。首先,本研究为单中心研究,且样本数量较少,不能代表河南省的整体情况;其次,本研究检测了CRE菌株的常见碳青霉烯酶基因,但是对ESBLs、膜孔蛋白和外排泵的情况未做进一步检测,不能全面阐释耐药机制;最后,对耐药菌株的分型和质粒特征未进行检测,不能分析其流行和传播情况。
综上所述,本研究通过检测本院CRE菌株对CAZ/AVI的药物敏感性,表明CRE菌株对CAZ/AVI的整体耐药率较低,且低于我国平均水平。进一步的表型试验及耐药基因检测结果提示,CRE菌株对CAZ/AVI耐药的最主要原因是产生NDM型金属酶,部分CR~KP菌株可能由于blaKPC~2基因高表达或者KPC酶Ω环发生突变成为KPC~33等不同亚型而对CAZ/AVI耐药。
