苯唑西林敏感耐甲氧西林金黄色葡萄球菌临床株耐药性及生物膜活性分析
2022-09-09温娟刘柔杉张建王俊瑞
温娟,刘柔杉,张建,王俊瑞
1 内蒙古医科大学第一临床医学院,呼和浩特 010050;2 巴彦淖尔市医院检验科,巴彦淖尔015002;3 内蒙古医科大学附属医院检验科,呼和浩特 010050;4 内蒙古自治区临床病原微生物重点实验室,呼和浩特 010050
金黄色葡萄球菌是一种革兰阳性球菌,可通过释放多种毒素引起人和动物的多种感染性疾病,并可形成生物膜导致慢性感染。临床感染性标本分离的革兰阳性球菌中,金黄色葡萄球菌始终居于首位[1]。按照其对β~内酰胺类抗菌药物的耐药性,金黄色葡萄球菌可分为甲氧西林敏感金黄色葡萄球菌(methicillin susceptibleStaphylococcus aureus,MSSA) 和耐甲氧西林金黄色葡萄球菌(methicillin resistantStaphylococcus aureus,MRSA)两大类,其中MRSA是引起社区及医院患者感染的一类重要多重耐药菌,且已被证实可增加住院患者病死率[2]。近年来,有研究报道了一种具有特殊耐药表型的MRSA亚群,即苯唑西林敏感耐甲氧西林金黄色葡 萄 球 菌(oxacillin~susceptible methicillin~resistantStaphylococcus aureus,OS~MRSA),其在不同国家和地区的检出率在1.9%~21.4%范围内,有较大的差异[3~5]。由于常规实验室检测方法在筛检OS~MRSA菌株过程中尚存在一定的技术缺陷,OS~MRSA菌株有可能被错误鉴定为MSSA菌株,该结果可使临床错误应用β~内酰胺类抗菌药物进行治疗,延误抗感染治疗时机,甚至导致患者死亡[6]。另有研究表明,与MSSA菌株和MRSA菌株相比,OS~MRSA菌株具有更强的生物膜形成能力[7],且易受抗菌药物压力等因素调控,造成慢性感染[8]。目前我国鲜有人源OS~MRSA菌株的生物膜活性及调控机制的报道。基于此,本研究对本实验室2011~2020年期间分离的OS~MRSA菌株的耐药性、分子分型特征及生物膜活性进行探究,为进一步提高实验室检测OS~MRSA菌株的能力、揭示OS~MRSA菌株生物膜形成的分子调控机制、指导临床合理应用抗菌药物提供依据。
1 材料和方法
1.1 菌株来源
收集2011年1月~2020年12月期间本院临床常规送检样本中分离出的1500株金黄色葡萄球菌菌株,并经微量肉汤稀释法检测苯唑西林最低抑菌浓度(minimum inhibitory concentration,MIC),筛选得到MSSA菌株,~80℃保存备用。
1.2 质控菌株
标准菌株金黄色葡萄球菌ATCC29213和金黄色葡萄球菌ATCC43300由本实验室保存;沙门菌H9812及SCCmec分型所需标准菌株(标准菌株 为 SCCmec I型 NCTC10042、SCCmec II型N315、SCCmec III型 85/2080、SCCmec IV 型JCSC4744、SCCmec V型HS663)分别由中国疾病预防控制中心传染病预防控制所杜小莉老师和上海市肺科医院余方友教授馈赠。
1.3 试剂
胰蛋白胨大豆肉汤(tryptic soy broth,TSB,广东环凯微生物科技有限公司,批号:1096341);结晶紫染液(珠海贝索生物技术有限公司,批号:419031);冰乙酸溶液(国药集团化学试剂有限公司,批号:20201106);甲醇(国药集团化学试剂有限公司,批号:20201113);5×Tris硼酸缓冲液(Tris~Borate~EDTA, TBE,北京索莱宝科技有限公司,批号:20210105);磷酸盐缓冲液(phosphate buffered saline,PBS,北京索莱宝科技有限公司,批号:20210922);琼脂糖(美国Thermo Fisher Scientific公司,批号:0000938580);水解酪蛋白肉汤(mueller~hinton broth,MHB,广东环凯微生物科技有限公司);水解酪蛋白琼脂(mueller~hinton agar,MHA,广东环凯微生物科技有限公司,批号:2846108);苯唑西林(大连美仑生物技术有限公司,批号:S0501A);头孢西丁纸片(英国Oxoid公司,批号:2866348);细菌基因组DNA提取试剂盒[天根生化科技(北京)有限公司,批号:W0130];2×Taq PCR Mastermix(KT201)[天根生化科技(北京)有限公司,批号:W9608];溶菌酶(50mg/ml)[天根生化科技(北京)有限公司,批号:X0526];溶葡萄球菌素(1mg/ml,美国Sigma公司,批号:SLBZ0309);SeaKem 金琼脂糖粉(SeaKem gold agarose,SKG,龙沙生物技术有限公司,批号:0000635793);XbaI内切酶[纽英伦生物技术(北京)有限公司, 批号:10026213];SmaI限制性内切酶[纽英伦生物技术(北京)有限公司, 批号:0841711];细胞裂解液(上海碧云天生物技术有限公司,批号:042021211126);PCR引物[中美泰和生物技术(北京)有限公司]。
1.4 仪器
ZWY~200D型恒温培养震荡摇床(上海智城分析仪器制造有限公司);Effiency 96型PCR扩增仪(北京领宇科技有限公司);WD~9413B型凝胶成像分析仪(北京六一生物科技有限公司);BD~phoenixTM~100system全自动微生物鉴定及药敏分析系统(美国BD公司);microTyper MALDI~TOF质谱仪(江苏天瑞仪器股份有限公司厦门分公司);ABI 3730XL 型DNA分析仪(美国应用生物系统公司);IMH750~S型普通培养箱(美国Thermo Fisher Scientific公司);XZ21K~7型高速冷冻离心机(长沙湘智离心机仪器有限公司);SUNRISE酶标仪[帝肯(上海)实验器材有限公司];CHEF MAPPERTM脉冲场凝胶电泳仪(美国Bio~Rad公司)。
1.5 菌株复核
将~80℃冻存的1500株菌株在血琼脂平板上传代复苏,并在35℃下培养16~18h。采用MALDI~TOF质谱仪和16S rRNA测序技术对菌株进行复核。
1.6 耐药性检测
采用微量肉汤稀释法检测菌株对苯唑西林的耐药性。取适量苯唑西林进行倍比稀释,并转移至96孔板中备用;将待测菌株培养物配制成0.5MCF的菌悬液,取100μl加入MH肉汤并混匀。吸取定量菌悬液置于含不同浓度苯唑西林的微孔中,使苯唑西林浓度分别为 128、64、32、16、8、4、2、1、0.5、0.25、0.125、0.06、0.03μg/ml。将 96孔板置于35℃培养箱中培养24h,观察结果并记录MIC。
采用纸片扩散法检测菌株对头孢西丁的耐药性。取适量0.5MCF菌悬液均匀涂布在MH平板,将头孢西丁纸片(30μg)贴附于表面,并置于35℃孵箱中培养24h,观察结果并记录抑菌圈直径。
采用BD~phoenixTM全自动微生物鉴定及药敏分析系统检测菌株对其他抗菌药物的敏感性。测试抗菌药物包括青霉素、红霉素、四环素、克林霉素、庆大霉素、左氧氟沙星、复方磺胺甲唑、万古霉素、利奈唑胺和利福平。药敏试验结果依据美国临床实验室标准化协会(Clinical and Laboratory Standards Institute,CLSI)的 M100 文件进行判读[9]。
1.7 mecA基因和mecC基因检测
对苯唑西林敏感、头孢西丁耐药或苯唑西林、头孢西丁均敏感的菌株进行mecA和mecC基因扩增。基因检测过程如下:于35℃下培养24h的血琼脂培养基上,挑取5~10个单菌落溶解于1ml无菌水中,12 000r/min离心2min,弃去上清液,向菌体沉淀中加入溶菌酶(50mg/ml)充分混匀,置于35℃中水浴30min。按照细菌基因组DNA提取盒说明书提取细菌总DNA。PCR反应条件[10~11]为:94℃预变性 4min;94℃变性 30s,50~60℃退火30s,72℃延伸1min,30个循环;72℃延伸4min。引物序列如表1所示。PCR产物进行常规琼脂糖电泳、成像分析。

表1 mecA、mecC基因的引物序列和片段大小
1.8 分子分型
多位点序列分型(multilocus sequence typing, MLST)基本实验流程如下。首先依据细菌基因组DNA提取盒说明书提取细菌总DNA。用50μl反应体系进行PCR,包含2μl细菌染色体 DNA、上游引物 2μl、下游引物 2μl、2×Taq PCR Mastermix 25μl以及 ddH2O 19μl。PCR 反应条件[12]为:95℃预变性 5min;95℃变性1min,55℃退火1min,72℃延伸1min,30个循环;72℃延伸5min。对7个持家基因(arcC、aroE、glpF、gmk、pta、tpi、yqiL)进行扩增,引物序列如表2所示。PCR产物送中美泰和生物技术(北京)有限公司进行测序,测序反应所用引物与PCR扩增所用引物相同。将测序反应获得的基因序列与MLST数据库(http://saureus.mlst.net)进行对比。
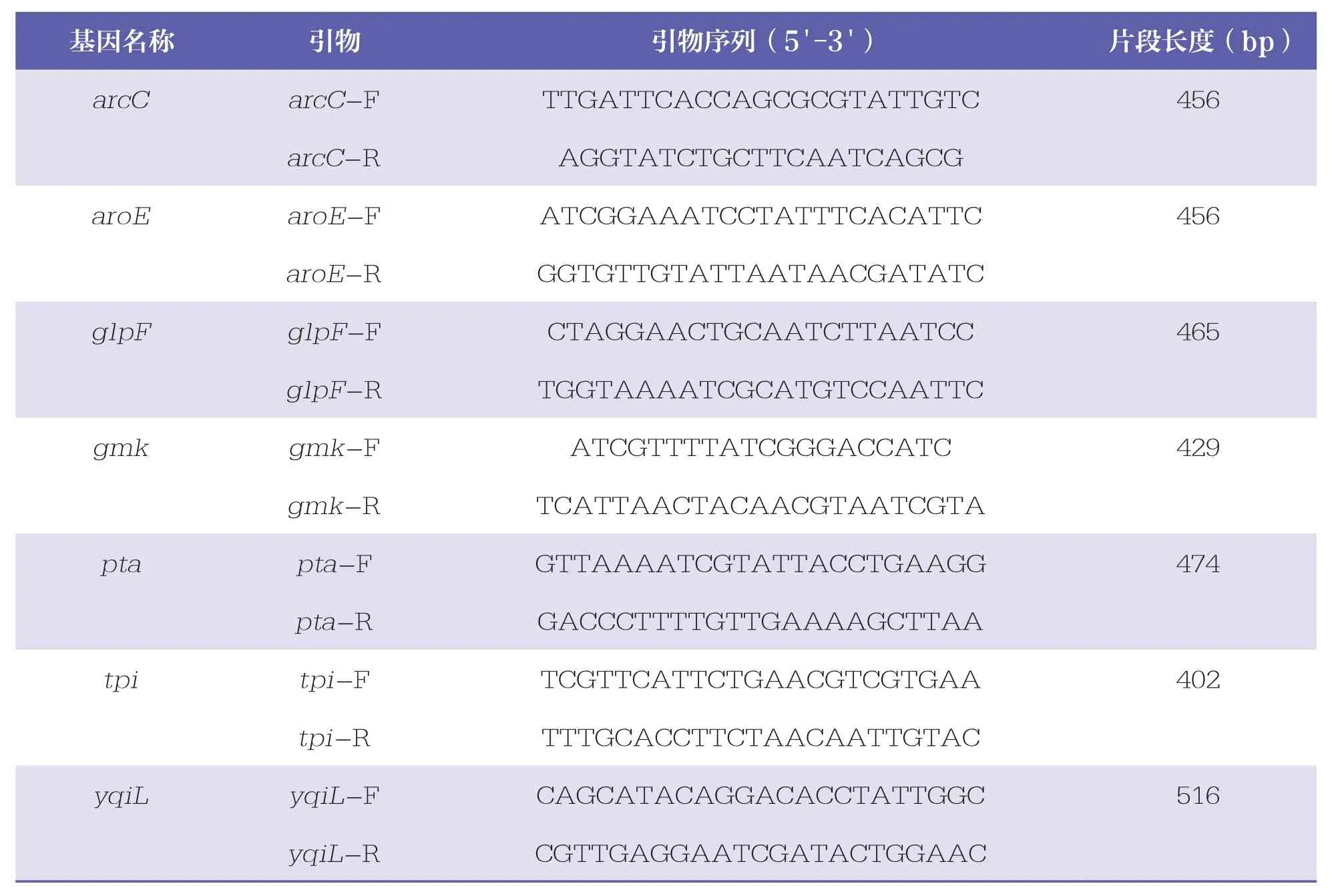
表2 MLST分型引物序列和片段大小[12]
葡萄球菌蛋白A分型(staphylococcal protein A typing,Spa typing)。SPA(staphylococcal protein A)是金葡菌细胞壁分离的蛋白,编码基因包括X域、Fc结合区和C末端3个区域。X基因区呈多态性,含有24bp可变的重复序列,重复序列两端是相对较保守的区域[13],自起始序列后的第1个碱基为起始碱基,终止序列前的1个碱基作为终止碱基,以24bp为循环,划分为2~15个多态性重复序列。Spa采用引物spa~F(5’~TAAAGACGATCCTTCGGTGAGC~3’)和spa~R(5’~CAGCAGTAGTGCCGTTTGCT~3’)[14]扩增spa基因的可变重复区,PCR产物送中美泰和生物技术(北京)有限公司进行测序,使用Spa分型数据库(http://spaserver.ridom.de)分析序列。
葡萄球菌染色体盒mec分型(staphylococcal cassette chromosome mec typing,SCCmec typing)。采用多重PCR检测的方法,设置PCR反应条件[15]为:94℃预变性5min;94℃变性45s,65℃退火45s,72℃延伸1.5min,10个循环;94℃变性45s,55℃退火45s,72℃延伸1.5min,25个循环;72℃延伸10min。
脉冲场凝胶电泳(pulsed field gel electrophoresis,PFGE)分型。将细菌配制成浓度为3.5~4.0MCF的菌悬液,在37℃下用1mg/ml溶葡萄球菌素消化30min。将预热的SKG与菌悬液等体积混合并立即注入模具,室温下静置直至凝固为胶块,加入细胞裂解液混合液进行裂解。标准菌株胶块及实验菌株胶块分别置于含XbaI内切酶、SmaI限制性内切酶的缓冲液中孵育。采用脉冲场凝胶电泳仪进行电泳,条带比对以沙门菌H9812进行标准化。采用BioNumerics V5.1软件进行胶块间图像比较。
1.9 生物膜形成能力测定
将待测菌株经血琼脂平板传代培养16~18h后,配制成0.5MCF的菌悬液。用TSB稀释100倍,移取适量稀释后溶液置于96孔板中,35℃培养箱孵育24h。将孔中菌液全部吸出、弃去,每孔加入200μl PBS溶液冲洗3次,放置10~20min晾干;每孔加入200μl甲醇,放置20min后吸出、弃去,室温放置晾干;每孔加入200μl结晶紫溶液,放置5~10min后吸出、弃去;每孔加入200μl PBS溶液冲洗3次,室温放置直至完全晾干;每孔加入160μl冰乙酸,放置10min,用酶标仪测定620nm处的光密度(optical density,OD)值,平行测定3次。结果判断标准参照文献[16]:OD≤临界 OD 值(cut~off of OD,ODc),表示无生物膜形成;ODc<OD≤2ODc,表示有弱生物膜形成;2ODc<OD≤4ODc,表示有中度生物膜形成;OD>4ODc,表示有强生物膜形成。
1.10 生物膜形成相关基因表达水平检测
以“1.7”项下所得菌株DNA为模板进行目标基因扩增,检测基因包括fnbpA、fnbpB、icaA、icaB、icaC、icaD、Bap、clfA和clfB基因,PCR扩增条件[17]为: 94℃预变性5min,94℃变性30s,55℃退火30s,72℃延伸1min,35个循环;72℃延伸10min。引物信息及靶基因扩增片段见表3。
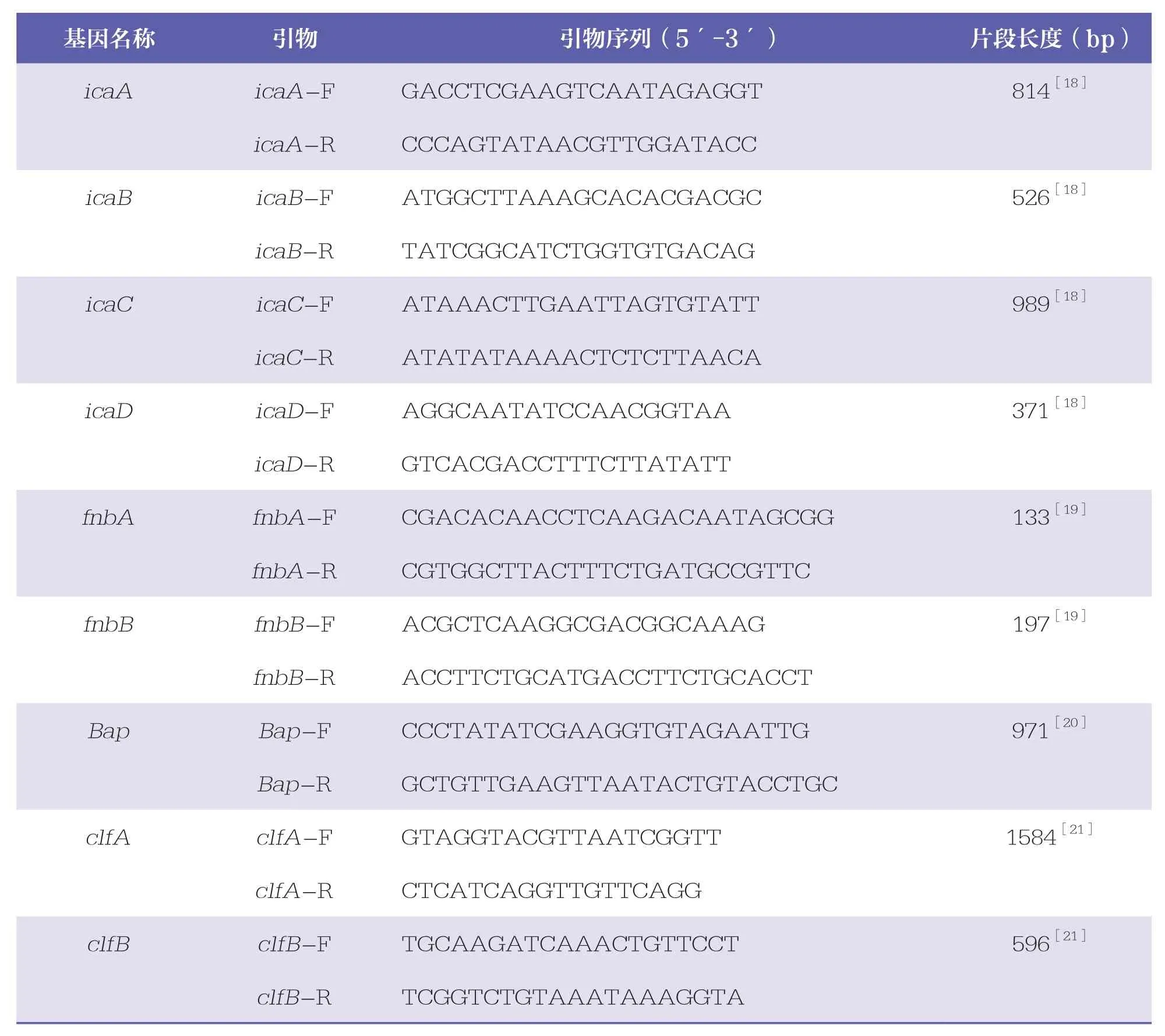
表3 常见PCR目标基因的引物序列和片段大小
2 结果
2.1 菌株耐药表型及耐药基因检测结果
经mecA和mecC基因检测确认,共筛选出21株OS~MRSA菌株(1.40%),且均为mecA基因检测阳性、mecC基因检测阴性。耐药性检测结果表明,21株OS~MRSA菌株均对万古霉素、利奈唑胺敏感,均对青霉素耐药;对红霉素、四环素、克林霉素、庆大霉素、左氧氟沙星、复方磺胺甲唑和利福平的耐药率分别为76.19%、52.38%、47.62%、23.81%、14.29%、9.51% 和 4.76%。 采用纸片扩散法共筛选出3株头孢西丁耐药菌株,分别为 OS~200、OS~1502和 OS~1068,其对应的苯唑西林 MIC值分别为 1、0.5、1μg/ml。21株OS~MRSA株的苯唑西林MIC值及头孢西丁抑菌圈直径之间未观察到明显相关性。详见表4。

表4 21株OS-MRSA 菌株的体外药敏试验和耐药性检测结果
2.2 菌株流行病学特征及分子分型结果
21株OS~MRSA菌株分别分离自创面分泌物(11株,52.38%)、脓液(3株,14.29%)、痰液(3株,14.29%)、血液(2株,9.52%)、支气管肺泡灌洗液(1株,4.76%)、穿刺液(1株,4.76%);女性菌株分离率(11株,52.38%)高于男性(10株,47.62%);儿童菌株分离率(4株,19.05%)低于成人(17株,80.95%)。
21株OS~MRSA菌株的MLST分型、Spa分型结果呈现多样化特征,见图1。其中,MLST分型优势型为ST398型(4株,19.05%)、ST7型(3株,14.29%);Spa分型优势型为t571型、t309型和t091型,各优势型均为2株(9.52%);SCCmec分型优势型为SCCmec IV型(11株,52.38%),9株未分型。

图1 21株OS-MRSA菌株的分子分型结果
2.3 生物膜形成能力
21株OS~MRSA菌株生物膜形成能力如图2所示。所有菌株均具有生物膜形成能力,其中3株为强产膜株(14.29%),13株为中产膜株(61.90%),5株为弱产膜株(23.81%)。不同菌株产膜能力差异较大,分离自创面分泌物标本的OS~1060、OS~1502菌株产膜能力最强,MLST分型均为ST59型,SCCmec分型均属IV型,而Spa分型均不同;分离自脓液标本的OS~230菌株产膜能力最弱,MLST分型为ST25型,而SCCmec及Spa方法均未能分型。强产膜株中,2株分离自伤口分泌物标本,1株分离自穿刺液标本;其中2株MLST分型为ST59型,3株Spa分型均不同。中产膜株中,8株分离自伤口分泌物标本,2株分离自血液标本,2株分离自脓液标本,1株分离自痰液标本;3株MLST分型为ST398型,2株Spa分型为t571型。

图2 21株OS-MRSA菌株生物膜的光密度
2.4 生物膜形成相关基因携带情况
PCR结果如表5显示,不同OS~MRSA菌株生物膜形成相关基因携带率差异显著。21株OS~MRSA菌株(100.00%)均携带icaA和icaD基因;16株(76.19%)携带fnbpA基因;5株(23.81%)携带fnbpB基因;只有1株弱产膜株(OS~228)携带Bap基因,且该菌株同时携带fnbpA、fnbpB、clfA、clfB、icaA、icaB、icaC和icaD基因;产膜能力最强的3株OS~MRSA菌株(OS~637、OS~1060和 OS~1502株 ) 均 携 带clfB、icaA、icaC和icaD基因;产膜能力最强的OS~1502株和产膜能力最弱的OS~230株均携带fnbpA、clfA、clfB、icaA、icaB和icaD基因。菌株携带上述生物膜相关基因多少与菌株产膜能力强弱之间未显示出明显相关性。

表5 21株OS-MRSA菌株生物膜形成相关基因的携带情况
3 讨论
近年来,OS~MRSA菌株受到了越来越多的关注,包括人源菌株[22~23]及各种动物源菌株[24~26]。国内人源菌株分离率各不相同[4,27],本研究发现OS~MRSA菌株分离率为1.40%。而MLST分型和Spa分型结果与国内相关文献不同[28~29],其中ST398型占比最高(4株,19.04%);Spa分型结果较为分散,包括t091型(2株,9.52%)、t309型(2株,9.52%)和t571型(2株,9.52%),而t437型只检出1株(4.76%)。与贺文强等[3]、Liu等[30]的报道结果相一致,本研究分离OS~MRSA菌株的SCCmec分型主要以IV型为主;结合流行病学数据,提示OS~MRSA菌株主要分离自社区的获得性感染患者。不同报道中[4,31]OS~MRSA 菌株分子分型的多样性特征表明OS~MRSA的分布可能更为广泛且具有地域特征。由于目前报道菌株数量的限制,其实际分布及流行特征尚需进一步探究。Saeed等[32]的研究显示,在英国7家医院中,OS~MRSA菌株主要分离自皮肤、软组织及脓液中,其次是分离自血液,其他类型标本分离率较低。本研究发现21株OS~MRSA菌株主要分离自创面分泌物,少数分离自脓液及痰液,仅2株分离自血液。这表明OS~MRSA更易引起皮肤、软组织等部位感染,血流感染少见。此外,本研究中4株OS~MRSA菌株分离自1~8岁患儿,分离部位为创面分泌物、脓液、血液及支气管肺泡灌洗液。由于儿科患者的特殊性,在临床样本中出现金黄色葡萄球菌时,应更多关注其耐药性及抗菌药物合理使用,避免严重感染及并发症的出现。
目前实验室检测MRSA的方法主要为耐药表型检测技术,包括苯唑西林稀释法、头孢西丁稀释法或纸片扩散法。研究发现MRSA耐药机制主要是由于mecA或mecC基因表达青霉素结合蛋白2a(penicillin~binding protein 2a,PBP2a),导致其对几乎所有β~内酰胺类抗菌药物产生耐药性[30]。mecA或mecC基因被认为是确认MRSA的“金标准”[33],常通过PCR方法进行检测,但因检测费用高等因素限制了其在临床实验室的广泛应用。Liu等[30]指出,相较于VITEK~2 AST卡,头孢西丁纸片扩散法更能准确地识别OS~MRSA,因此被认为是一种可靠且节约成本的鉴别OS~MRSA的方法。同时,17株OS~MRSA的PBP2a乳胶凝集试验均呈阳性。Becker等[34]发现9株苯唑西林敏感、不产生PBP2a、但mecA基因阳性的临床分离株。因此,如只使用耐药表型或只使用基因检测技术,很可能会造成OS~MRSA的漏诊或误诊。为了更准确地识别OS~MRSA,并更好地治疗其感染,Liu[30]等指出,对于金黄色葡萄球菌,当苯唑西林MIC在1~2μg/ml时,建议补充头孢西丁纸片扩散试验或检测mecA/PBP2a。对于严重金黄色葡萄球菌感染的患者,药敏试验检测为MSSA、使用β~内酰胺类抗菌药物的疗效不理想甚至病情恶化时,应考虑进行mecA基因检测,特别是对于苯唑西林MIC≥0.5μg/ml的病例。刘柔杉等[35]前期研究发现,OS~MRSA株PBP2a蛋白阳性率仅为42.86%。该结果提示耐药表型与基因检测方法联合应用能最大程度降低OS~MRSA株的漏诊率。
细菌生物膜是指细菌在生长过程中附着于非生物或生物表面、由自身产生的胞外聚合物(主要为胞外多糖, 蛋白和胞外DNA) 及其基质网包裹的呈三维结构的菌细胞群体[36]。细菌形成生物膜后其耐药性增加,而MRSA形成生物膜后会呈现高度耐药性,并能逃避宿主免疫系统的攻击,引起严重的反复、慢性感染。金黄色葡萄球菌生物膜形成主要为群体感应(quorum sensing,QS)系统的调控,主要包括agr系统及sar系统[36]。sarA基因可影响细胞间多糖黏附素(polysaccharide intercellular adhesion,PIA)的产生。PIA主要由ica基因编码产物形成,在生物膜形成过程中具有重要作用[37]。胡晓丰等[36]提出icaADBC基因簇的表达可促进PIA的合成。在本研究中,21株OS~MRSA均携带icaA和icaD基因,可能在OS~MRSA菌株生物膜形成中发挥主要作用。部分菌株(如OS~230和OS~1068株)仅携带icaA、icaB、icaD基因,而不携带icaC基因。但某些ica突变的菌株也可形成生物膜[38],因此 Archer等[39]指出,除PIA依赖的生物膜形成机制之外,还存在非PIA依赖的生物膜形成机制,主要通过细胞外基质蛋白(如SPA、Bap等)发挥作用。本研究中,OS~228株是唯一一株携带Bap基因的菌株,同时携带fnbpA、fnbpB、clfA、clfB、icaA、icaB、icaC和icaD基因,但呈现弱产膜能力。因此,生物膜形成能力的调控机制仍有待进一步探究。MRSA生物膜形成主要通过fnbB基因介导, 而sarA调控子可能通过调节fnbB基因的表达促进MRSA生物膜的形成[36,40]。Brahma 等[41]也发现,在其研究的所有OS~MRSA分离株中,fnbA和fnbB基因表达水平呈上调趋势。但在本研究中,fnbB基因阳性率仅为23.81%,fnbB基因在本研究收集OS~MRSA菌株生物膜形成能力中的作用可能是有限的。目前关于clfA和clfB基因是否参与OS~MRSA生物膜的形成还没有相关报道,本研究中clfA、clfB基因的阳性率分别为90.48%和95.24%,clfA、clfB基因在本组菌株中广泛存在,其是否为调控生物膜形成能力的重要因素还需要进一步研究。综上所述,不同OS~MRSA菌株间生物膜形成能力差异显著,调控机制可能存在菌株异质性特点,对于高产膜菌株及其生物膜形成机制应该进一步探究。
另外,金黄色葡萄球菌生物膜形成能力受多种因素影响,特别是抗菌药物的抑菌作用。朱科等[42]研究发现,亚抑菌浓度头孢洛林对MRSA菌株的生物膜形成具有显著诱导作用,提示亚抑菌浓度头孢洛林可能引起MRSA菌株胞外多糖的产生和上调icaA基因的表达,从而导致细菌生物膜形成能力增强。He等[7]使用头孢他啶诱导OS~MRSA形成生物膜,证明β~内酰胺类抗菌药物可诱导OS~MRSA形成生物膜。在头孢他啶作用下,膜囊泡(membrane vesicles,MVs) 是 OS~MRSA形成生物膜的重要结构成份,而对照组OS~MRSA生物膜中MVs含量很少。此外,在头孢他啶作用下,OS~MRSA菌株的clfA、clfB表达量显著下降,提示PIA在头孢他啶调控OS~MRSA的生物膜形成过程中可能不起关键作用,也表明亚抑菌浓度β~内酰胺类抗菌药物对OS~MRSA生物膜形成调控机制的普遍性和多样性。鉴于本研究大部分OS~MRSA菌株为中或强产膜菌株,亚抑菌浓度β~内酰胺类抗菌药物对OS~MRSA生物膜形成能力的影响、机制及菌株间的异质性值得进一步研究。
综上所述,人源OS~MRSA株整体分离率较低,但实验室常用耐药表型方法容易导致苯唑西林MIC较低的OS~MRSA株的漏检,进而导致严重后果。耐药表型方法及基因检测技术联合应用能最大程度提高OS~MRSA株的检出率。本研究分离的21株OS~MRSA均具有产膜能力,且不同菌株间产膜能力及生物膜形成相关基因表达差异显著。OS~MRSA高产生物膜能力及生物膜形成能力的异质性及机制仍需进一步探究。
