国产两性霉素B脂质体对侵袭性真菌病病原菌体外抗菌活性的研究
2022-09-09康巍张戈张京家段思蒙王瞳李进皇甫芷如徐英春张丽
康巍,张戈,张京家,段思蒙,王瞳,李进,皇甫芷如,徐英春,张丽
中国医学科学院北京协和医院检验科,侵袭性真菌病机制研究与精准诊断北京市重点实验室,北京 100730
两性霉素 Ba(amphotericin B ,AmB)是一种大环多烯类抗菌药物,因其能特异地与真菌细胞膜上麦角固醇结合而用于抗真菌治疗[1]。AmB对大多数侵袭性真菌,包括酵母菌和丝状真菌均具有良好的体外活性。AmB自 1959 年上市以来,在侵袭性真菌感染临床治疗中发挥着重要作用[2]。
AmB普通制剂,即AmB脱氧胆酸盐(amphotericin B deoxycholate,AmBD),因其具有治疗剂量依赖性、肾毒性和输注相关的不良反应,大大地限制了其临床应用。基于AmB所研制的商业配方AmB的脂质体制剂,已被证明可以降低AmB的不良反应,同时保持药物的活性[3]。目前,市面上广泛应用的AmB脂质体制剂有以AmBisome为代表的AmB脂质体(liposomal amphotericin B,L~AmB)、以Abelcet为代表的AmB脂质复合物(amphotericin B lipid complex,ABLC)和以Amphocil/Amphotec为代表的AmB胶体分散体(amphotericin B colloidal dispersion,ABCD)3种剂型。3种AmB脂质体制剂均含有AmB,但在脂质组成、形状、大小、稳定性、药动学和毒性方面存在差异,这些差异可能会影响各种制剂的治疗用途[4]。
本研究所用注射用AmB脂质体均为L~AmB剂型。通过对比分析国产、进口注射用L~AmB制剂、注射用AmBD制剂与AmB标准品对常见念珠菌以及丝状真菌的体外药物敏感性;评估4种AmB制剂体外抗真菌活性的差异;观察4种AmB制剂对侵袭性真菌的体外药物敏感性,为临床抗真菌治疗提供参考依据。
1 材料与方法
1.1 菌株来源
本研究选取中国医院侵袭性真菌病监测网(CHIF~NET)2018年收集的菌株,均分离自患者血液、组织、引流液、导管等无菌部位。纳入15种酵母菌(317株),其中白念珠菌 44 株、热带念珠菌 43 株、光滑念珠菌 43 株、近平滑念珠菌43 株、克柔念珠菌 29 株、隐球菌37株、希木龙念珠菌9株、葡萄牙念珠菌19株,及其他临床少见酵母菌50株。此外,纳入6 种丝状真菌(76 株),其中烟曲霉 20 株、黄曲霉 12 株、土曲霉 12 株、黑曲霉 10 株、镰刀菌12 株、构巢曲霉 10 株。质量控制菌株为近平滑念珠菌 ATCC22019,克柔念珠菌 ATCC6258[5]。
1.2 药品与试剂
国产注射用L~AmB制剂(注射用两性霉素B脂质体,石药集团中诺药业,批号830190703);进口注射用L~AmB制剂(注射用两性霉素B脂质体,Ambisome,Gilead Science, Inc.,批号 15750);注射用AmBD制剂(注射用两性霉素B,商品名:欧泊,华北制药股份有限公司,国药准字H13020285,批号FFLD190701);AmB 标准品(欧洲药品质量管理局,批号Y0000005)。
二甲基亚砜(dimethyl sulfoxide,DMSO,Sigma公司);聚山梨酯 20(Solarbio公司);0.9%氯化钠溶液(华润双鹤药业股份有限公司);科马嘉显色培养基(法国科马嘉公司);沙保弱培养基(英国 Oxoid 公司);RPMI1640 培养基(德国Sigma~Aldrich 公司),含谷氨酰胺不含碳酸氢盐并以酚红为指示剂,使用 0.165 mol/L MOPS 缓冲液(MOPS Buffer)调 pH( 7.0±0.1)。
1.3 仪器
无菌U型96孔板(江苏省海门盛泰实验器材厂); Sentititre AIM全自动加样仪(赛默飞世尔科技公司);VITEK MS基质辅助激光解析电离飞行时间质谱(MALDI~TOF~MS,法国生物梅里埃公司);恒温培养箱(赛默飞世尔科技公司);比浊仪(法国生物梅里埃公司)。
1.4 实验方法
1.4.1 微量肉汤稀释法药敏试验
按照美国临床实验室标准化协会(Clinical and Laboratory Standards Institute,CLSI)M27~ED4 与 M38~ED3 文件严格操作[6~7]。测试药物包括 AmB 标准品(0.03~16μg/ml)、进口注射用 L~AmB 制剂(0.03~16μg/ml)、国产注射用L~AmB制剂(0.03~16μg/ml)、注射用AmBD制剂(0.03~16μg/ml)。按照溶解性分别采用DMSO或纯化水溶解抗真菌药物,获得相应浓度的储存液。使用RPMI1640培养基将储存液依次对比稀释至相应浓度并加入96孔板中,每孔100μl。
多数丝状真菌在沙堡弱培养基中于 35℃条件下孵育48h,直至形成良好的孢子;镰刀菌属在 35℃条件下孵育48~72h后,在 25℃条件下孵育至第7天;所有的酵母菌均在沙堡弱培养基中传代2次,均在35℃条件下孵育48h以确保菌株纯度和存活率。入组菌株均使用MALDI~TOF~MS进行细菌鉴定。
酵母菌用无菌0.9%氯化钠溶液洗脱,使用比浊仪调制成0.5麦氏浊度,加入 RPMI 1640 培养基继续稀释 1000倍,使接种终浓度达到 0.5×103~ 2.5×103菌落形成单位(CFU)/ml。使用含 0.1%聚山梨酯20的0.9%氯化钠溶液将丝状真菌调制成较浓的悬浊液,待菌丝静置沉降后,吸取上清液调制成 0.5 麦氏浊度,加入 RPMI 1640培养基进一步稀释 50 倍,使接种终浓度达到 0.4×104~5×104CFU/ml。
按照浓度由高到低将上述真菌的 RPMI1640 培养基依次加入药敏板(96孔板)中,置于35℃条件下培养。待念珠菌孵育24h,毛孢子菌与丝状真菌孵育48h,隐球菌孵育72h后,读取药敏试验结果。与生长对照孔相比,各AmB制剂及标准品读取100%抑制的最低抑菌浓度(minimum inhibitory concentration,MIC)值。
每批测试中,均使用质量控制菌株近平滑念珠菌 ATCC22019,克柔念珠菌 ATCC6258监控实验质量,保证测试MIC的准确性。
1.4.2 数据分析方法
采用WHONET 5.6软件进行数据分析。根据MIC 值统计MIC范围、MIC50、MIC90和几何平均数(geometric mean,GM),比较4种AmB制剂体外药敏差异。计算国产与进口L~AmB制剂之间的基本一致性(essential agreement, EA)。EA指被待测药物检测 MIC 值与参考药物相差不超过 1 个稀释倍数。
2 结果
每批测试中,质量控制菌株的MIC值均在质控范围内。
表1总结了不同AmB制剂及标准品对 317 株酵母菌的MIC范围、MIC50、MIC90、GM以及脂质体制剂间的EA。结果提示,4种AmB制剂对多数临床常见念珠菌和隐球菌的MIC50和MIC90值均≤2μg/ml;2种注射用L~AmB 制剂对希木龙念珠菌的MIC50和MIC90值分别为8μg/ml和16μg/ml;AmB标准品和进口注射用L~AmB制剂对部分临床少见念珠菌的MIC50和MIC90值为4μg/ml;商品制剂(注射用AmBD制剂以及2种注射用L~AmB制剂)对所测试的多数念珠菌活性均比AmB标准品的MIC低;但4种AmB制剂对隐球菌以及部分临床少见念珠菌的MIC分布相近。
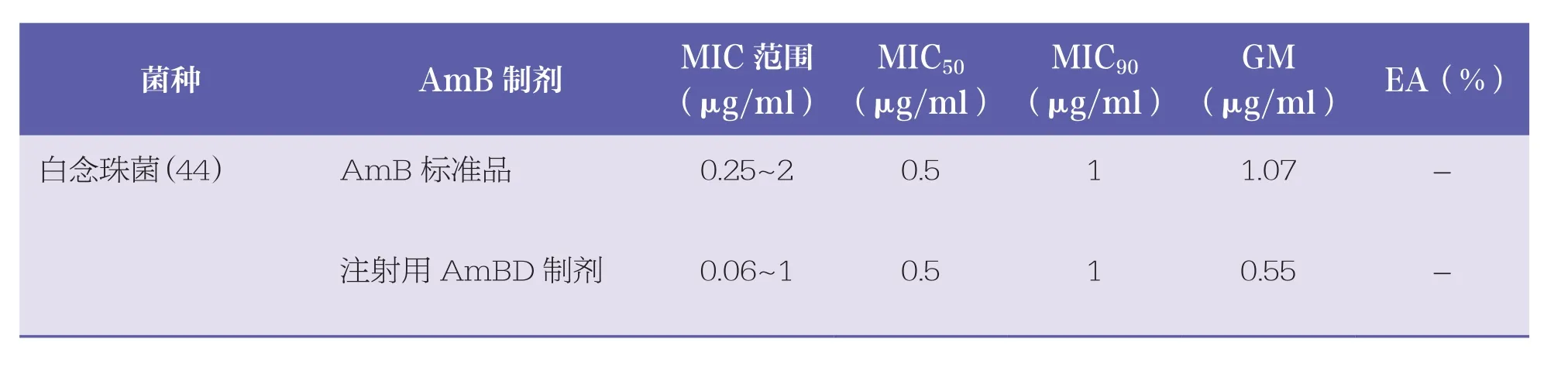
表1 4种AmB制剂对酵母菌的体外敏感性差异 n=317
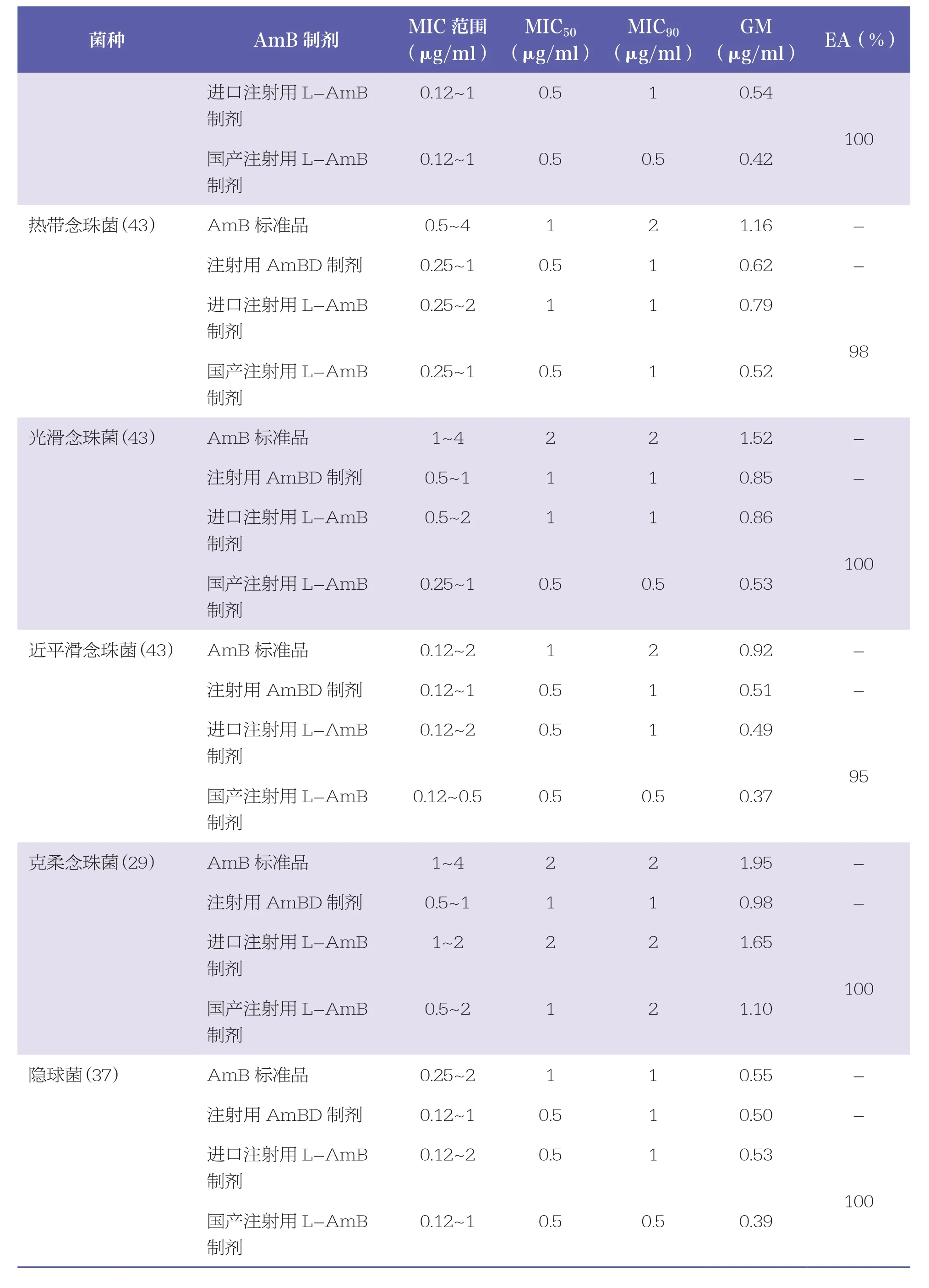
续表
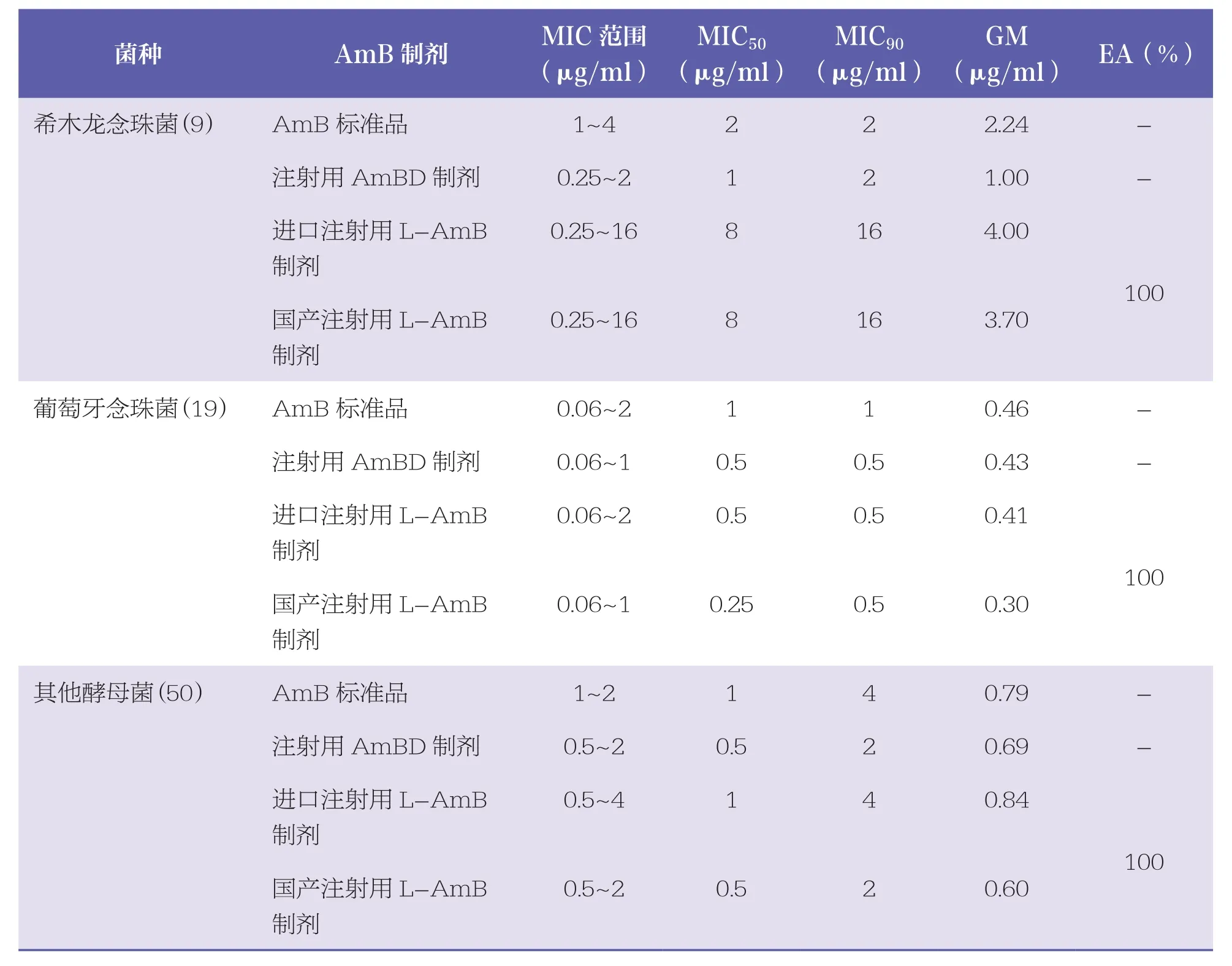
续表
表2总结了不同AmB制剂及标准品对76株丝状真菌的MIC 范围、MIC50、MIC90、GM以及L~AmB制剂之间的EA。结果提示,4种AmB制剂对烟曲霉、黄曲霉和黑曲霉的MIC50和MIC90值均≤1μg/ml。与酵母菌相似的是,商品制剂(注射用AmBD制剂以及2种注射用L~AmB制剂)对所测试的多数菌种活性均比AmB标准品MIC低。但在部分土曲霉、镰刀菌和构巢曲霉中,L~AmB制剂的活性比标准品及AmBD制剂高出3~4个稀释倍数。2种L~AmB制剂对土曲霉、镰刀菌和构巢曲霉的MIC90值均为16μg/ml。
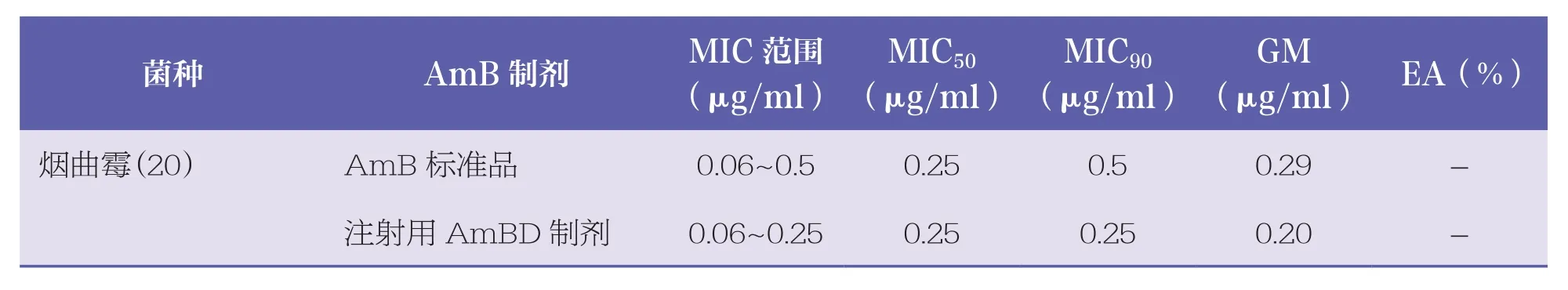
表2 4种AmB制剂对丝状真菌的体外药物敏感性差异 n=76

续表
在测试的4种AmB制剂中,多数情况下国产注射用L~AmB制剂MIC较低,而AmB标准品MIC偏高。2种非脂质体制剂MIC分布相近,2种L~AmB制剂对于大多数菌种的EA均为100%,仅有 1 株热带念珠菌与 2 株近平滑念珠菌的国产L~AmB制剂比进口L~AmB制剂MIC 值低 2 个稀释倍数,2种L~AmB制剂对于热带念珠菌和近平滑念珠菌的EA分别为98%和95%。
3 讨论
AmB自上市以来,一直以良好的抗真菌活性应用于临床的抗真菌治疗中。一项体外药物敏感性研究发现[8],AmB对该研究纳入的毛霉、根霉等26株毛霉菌目真菌的MIC值均<2μg/ml,伏立康唑的MIC值均>4μg/ml,提示目前AmB仍具有良好的抗真菌活性。但AmB的肾毒性和输注相关反应同样限制了其在临床治疗中的应用,而AmB脂质体相较于普通AmB注射制剂,可大大降低肾毒性等不良反应。多项临床研究表明[9~11],应用AmB脂质体对患者进行抗真菌治疗,其肾毒性和输注相关反应等的不良事件发生率低于普通注射剂型,可使真菌感染患者获得更好的临床治疗效果。自20世纪90年代AmB脂质体制剂被研制出并成功上市,AmBisome等脂质体制剂在临床实践中广泛应用,但其治疗费用较高。目前,国产AmB脂质体的陆续上市将给患者带来更多临床获益。
本研究中AmB标准品在多数菌种中抗菌活性较3种商品试剂MIC偏高,其原因可能为AmB容易受到光照、温度等环境因素影响。通过添加脱氧胆酸钠(增溶剂)或抗氧化剂以及使用脂质体包裹等方式,使商品制剂中的AmB较标准品在相同的环境下可以更好地保持药物稳定性以及抗菌活性[12]。
在既往研究中[13~16],使用不同的AmB脂质体制剂进行体外抗真菌活性研究,发现部分菌株中其体外药物活性弱于非脂质体制剂,其可能与受到体外环境下脂质体制剂释放AmB限制有关。既往研究表明ABLC制剂释放活性AmB受到所接触细胞释放的磷脂酶的影响[14]。Swenson 等[14]研究证实了某些酵母菌可产生足够的磷脂酶可帮助ABLC制剂释放AmB,以达到杀菌目的。由于部分真菌自身分泌不足,导致其体外药物敏感性较低。在培养基中添加磷脂酶可以恢复ABLC制剂的抗真菌活性。研究还指出,某些在体外对 ABLC制剂耐药而对AmB敏感的曲霉属分离株在小鼠体内模型中仍表现敏感[14]。
ABLC与L~AmB同为两性霉素B的脂质体制剂,其中ABLC为由二聚糖基磷脂酰胆碱和二聚糖基磷脂酰甘油混合物构成的带状结构,其粒径在1600~11 000nm之间。而 L~AmB由氢化大豆磷脂酰胆碱、胆固醇、二硬脂酰基~磷脂酰甘油和AmB组成的球形单层脂质体,其平均直径<100nm。二者虽然在脂质组成、形状、大小等方面有所不同,但抗真菌活性成份AmB均被脂质体完全包裹,以此减少其在人体内的不良反应[17]。因此,提示将AmB完全包裹的方式可能导致体外AmB释放速率不足,进而导致体外抗真菌活性减弱。目前,尚未见明确L~AmB制剂是否与ABLC制剂同样依赖于磷脂酶释放的报道,未来仍有待进一步研究。
综上所述,本研究中国产注射用L~AmB制剂与进口注射用L~AmB制剂的体外活性较为一致。此外,国产注射用L~AmB制剂体外药物敏感性较好,具有良好的抗真菌活性。但由于体外未知因素可能会影响其内部AmB药物的释放,导致体外实验不能准确地反映其对不同真菌菌种的药物活性情况,未来还需开展动物实验及临床对照试验等研究,以进一步评估国产注射用L~AmB制剂的临床治疗价值。
