茶多酚-介孔纳米氧化锌控释抗氧抗菌配合体的制备与表征*
2022-09-08弓雪峰丘晓琳
弓雪峰,丘晓琳,赵 烨,王 杰
(1. 江南大学 机械工程学院,江苏 无锡 214122;2. 江苏省食品先进制造装备技术重点实验室,江苏 无锡 214122)
0 引 言
防止氧化酸败和病原微生物感染造成食品品质下降一直是食品工业界和学界关注的热点话题。为了降低被氧化和微生物感染风险,同时不危害人体健康,人们致力于从各类天然产物中寻找安全有效的抗氧抗菌物质用于对食品的保护。茶多酚是茶叶的天然提取物,由30多种含酚基化合物组成,表没食子儿茶素没食子酸酯(EGCG)是其中含量最多的单体物质和最主要的抗菌活性成分[1]。茶多酚不仅具有多种不同的抗菌机理[2-3],同时其分子结构中的大量酚羟基和独特的邻苯二酚、连苯三酚结构也赋予其优异的抗氧化能力[4],被大量用于油脂、肉类等的保鲜[5-7]。通过一定手段对茶多酚进行包覆或固定,可以起到控释作用,从而控制茶多酚的释放速度或实现特定条件释放,延长茶多酚的作用时间,避免不良外部条件对其结构的破坏。研究者们已通过不同手段制备了各种茶多酚的控释体系。如Chen等[8]制备了一种聚丙烯/聚乙烯醇/聚丙烯(PP/PVA/PP)活性控释膜,中间PVA层含4%茶多酚,而内PP层则具有大量微孔以作为控释层,通过调整孔隙大小,可调节茶多酚的释放速率。Liu等[9]用壳聚糖纳米粒子对茶多酚进行包封,并载入明胶中制备控释膜,发现茶多酚在50%乙醇中扩散系数比在95%乙醇(脂肪食品模拟物)中高2个数量级,且释放速率与包封率成反比。Sanna等[10]采用聚己内酯(PCL)-海藻酸盐纳米粒子(NPs)对茶多酚进行纳米包埋,在保持其抗氧化活性的同时,降低了在酸性胃液模拟环境中的释放率。Hu等[11]通过自组装两种多糖索拉胶和N,N,N-三甲基壳聚糖(TMC)开发了一种聚电解质复合物(PEC)水凝胶,并将茶多酚封装其中,结果证明在模拟肠液(pH=6.8)中茶多酚的释放量显著高于模拟胃液(pH=1.2),实现向肠道靶向输送茶多酚。
纳米氧化锌具有良好的生物安全性和广谱抗菌性,已经在诸多领域作为抗菌活性成分被广泛研究和应用[12]。同时纳米氧化锌还可对pH、微波、超声波等多种外源刺激做出响应[13],因而可被用于智能型药物控释载体。不少研究者根据其对pH值的响应特性,制备高比表面积的纳米氧化锌载体,实现对不同药物的靶向递送[14-17],但用于抗氧抗菌剂茶多酚的搭载研究仍比较少。
本研究以聚氧乙烯聚氧丙烯醚嵌段共聚物(Poloxamer 188)和蔗糖为模板剂,采用水热法制备介孔纳米氧化锌载体,搭载天然抗氧抗菌剂茶多酚,制成抗氧抗菌活性纳米配合体,克服茶多酚释放不受控的问题,并对配合体进行表征,为其应用于活性抗氧抗菌包装提供理论依据。
1 实 验
1.1 原 料
六水合硝酸锌(Zn(NO3)2·6H2O,分析纯)、乙酸锌二水合物((CH2COO)2Zn·2H2O,分析纯)、尿素(CO(NH2)2,分析纯)、冰乙酸(CH2COOH,分析纯)、蔗糖(分析纯),无水乙醇(分析纯)均购自国药集团化学试剂有限公司;聚氧乙烯聚氧丙烯醚嵌段共聚物(Poloxamer 188,分析纯),南京威尔药业集团;茶多酚(TP,tea polyphenol,99%),上海麦克林生化科技有限公司; 2,2-联苯基-1-苦基肼基(DPPH,99%),罗恩试剂;PBS缓冲液(0.01mol/L)、氯化三苯基四氮唑(TTC),飞净(Phygene)生物科技有限公司;LB肉汤培养基,上海博微生物科技有限公司;MH肉汤培养基,杭州微生物试剂有限公司;大肠埃希氏菌(ATCC25922)及金黄色葡萄球菌(CMCC(B)26003),来自于上海保藏生物技术中心;超纯水,实验室自制。
1.2 制 备
1.2.1 介孔纳米氧化锌载体的制备
(1)第一步,前躯体的制备:参考熊光伟等[18]的方法并做改进:将1.10 g Zn(NO3)2·6H2O与6.01 g CO(NH2)2溶于100 mL超纯水中,搅拌下加入0.36 g Poloxamer 188模板剂和0.36 g蔗糖模板剂溶解,10 min后缓慢滴加CH2COOH直至溶液pH=4~5,继续搅拌2 h后将溶液转移到水热反应釜中封闭并于90 ℃恒温24 h。反应完成后自然冷却至室温,取出混合液,离心得到白色沉淀,使用50%乙醇水溶液洗涤沉淀4次,60 ℃烘干24 h,随后使用索氏提取器,以无水乙醇为提取剂,浸提12 h洗去残余模板剂,80 ℃干燥12 h得到前驱体碱式碳酸锌Zn2(OH)2CO3,记为Pre-N。第二步,纳米介孔氧化锌的转化:参照时文中等[19],将前驱体放入坩埚,在马弗炉中以270 ℃焙烧90 min,得到的介孔纳米氧化锌,产物记为N-ZnO。
(2)仅改变锌源物质,在(1)的步骤中将Zn(NO3)2·6H2O替换(CH2COO)2Zn·2H2O,其余条件和步骤均不变,得到的前驱体记为Pre-C,介孔纳米氧化锌产物记为C-ZnO。
(3)不使用模板剂,其余步骤与(1)中N-ZnO制备过程一致,得到的产物记为ZnO。
1.2.2 茶多酚-介孔纳米氧化锌控释抗氧抗菌配合体的制备
选择N-ZnO作为载体进行搭载,将6 g茶多酚(TP)溶于60 mL超纯水中得到TP溶液,同时将1 g N-ZnO投入40 mL超纯水中超声分散1 min得到N-ZnO分散液,在搅拌下将TP溶液匀速倒入N-ZnO分散液中,随后将混合液抽真空搅拌30 min,离心分离沉淀和上清液,使用超纯水洗涤沉淀5次,分别收集沉淀及洗脱液,将固体沉淀在40 ℃下真空干燥24 h得到配合体T-ZnO;抽真空反应及干燥全程均处于黑暗无氧环境下,避免茶多酚及配合体被氧化损失;将完全收集的离心上清液和洗脱液混匀为混合洗脱液,密封遮光保存待用。
1.3 结构表征
1.3.1 TEM测试
使用透射电子显微镜(赛默飞世尔科技,FEI Talos F200s)观测,能谱型号:FEI Super-X EDS Detector,获取所制备介孔纳米载体微观结构,直观获得孔道、孔形信息,样品以乙醇分散,超声分散3 min;
1.3.2 SEM测试
使用扫描电子显微镜(日本日立公司,S4800)观测,获取前驱体、介孔纳米载体和配合体的表面特征,样品在检测前进行喷金处理。
1.3.3 XRD测试
使用X射线衍射仪(德国布鲁克科技有限公司,Bruker D8 Advance)扫描确认前驱体与介孔纳米载体的晶型结构及转化情况。角度范围为5°<2θ<90°,扫描速率5°/min,铜靶,波长0.15406 nm,电压40 kV,电流40 mA;
1.3.4 比表面积和孔径测试
使用全自动比表面及孔隙度分析仪(美国康塔仪器公司,AUTOSORB-IQ2)测量分析介孔纳米载体孔结构数据,包括比表面积、孔径分布、孔容。分析前,样品在200 ℃下真空脱气20 h;样品比表面积由Brunauer-Emmett-Teller(BET)模型计算获得;孔径分布由Barrett-Joyner-Halenda(BJH)模型计算获得;孔容由t-plot方法计算获得。
1.3.5 TGA测试
使用同步热分析仪(德国耐驰仪器制造有限公司,STA 449C)测定获得前驱体、纳米介孔载体和配合体的热重曲线,分析热性能。测试范围为35~800 ℃,升温速率为10 ℃/min。
1.3.6 红外光谱测试
使用傅立叶变换红外光谱仪(德国布鲁克科技有限公司,Alpha-T)扫描分析茶多酚及介孔纳米氧化锌载体配合前后的化学结构变化。
1.4 性能测试
1.4.1 配合体中茶多酚的搭载量测定
搭载量的测定使用两种方法。
(1)洗脱液吸光度法:精密称取TP标准对照品100 mg,加超纯水定容至1000 mL制备成标准贮备液。使用贮备液和超纯水稀释制成系列浓度梯度的对照品溶液,浓度梯度取TP浓度为0.00,5.00,10.00,20.00,40.00,60.00,80.00,100.00 mg/L,在274 nm处,以超纯水为空白对照,使用紫外可见分光光度计(日本岛津株式会社,UV-1800)测定各浓度溶液的吸光度(A)。以A对茶多酚对照品溶液的质量浓度(X)进行线性回归,得线性标准曲线方程。将1.2.2中的混合洗脱液适当稀释,并在274 nm处测定稀释后洗脱液的吸光度,并根据线性标准曲线方程,计算洗脱液中茶多酚含量,并计算得到配合体中TP的搭载量,计算公式如式(1):
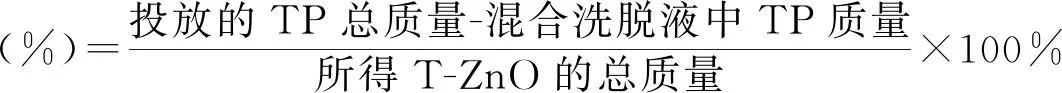
(1)
(2)配合体ICP-OES测试法:使用电感耦合等离子体发射光谱仪ICP-OES (安捷伦科技有限公司,Agilent 720ES)对干燥的配合体进行Zn元素含量测定,并根据分子量推算出配合体中TP的搭载量。计算公式如式(2):

(2)
1.4.2 配合体中茶多酚的释放测试
预先测定并绘制计算TP在PBS缓冲液(pH值为4.0,5.5,7.4)中的吸光度线性标准曲线和方程,称取3份20 mg的T-ZnO,分别使用3 mL PBS缓冲液(pH值为4.0,5.5,7.4)充分分散,移入20 kDa的透析膜中,夹紧封口,置入装有200 mL对应PBS缓冲液(pH值为4.0,5.5,7.4)的带盖棕瓶中,160 r/min避光悬浮旋转透析100 h,按照一定时间间隔定期吸取1 mL透析液,并补充1 mL对应pH值的PBS缓冲液,使用紫外可见分光光度计在274 nm处测定样液吸光度,并计算的茶多酚含量,绘制释放曲线。重复试验3次取平均值。
1.4.3 配合体DPPH自由基清除抗氧化性能
参考都津铭的方法并做改动[20],称取39.432 mg DPPH,使用95%的乙醇定容至1000 mL,配置成0.1 mmol/L的溶液。分别称取2,4,6,8和10 mg的TP和T-ZnO,置入盛有10 mL,0.1 mmg/mL的DPPH 95%乙醇溶液的棕色瓶中密封,充分震荡混合为悬浊液,放入震荡培养箱23 ℃,150 r/min条件下避光震荡反应,0.5和24 h后分别取出对应样品,滤除沉淀物,使用紫外可见分光光度计测定反应后的各样品滤液在517 nm处吸光度Ai;取相同量的TP或T-ZnO,放入10mL95%乙醇,相同条件震荡0.5和24 h后,测定517 nm处各样品背景吸光度Aj;取10 mL DPPH 95%乙醇溶液,相同条件下震荡0.5和24 h后,测定517 nm处吸光度值A0,重复试验3次取平均值,DPPH自由基的清除率由式(3)计算:
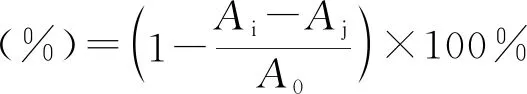
(3)
1.4.4 配合体的抗菌性能测试
(1)采用改进的牛津杯双层平板法[21]定性测试配合体的抑菌性能:首先分别称取40 mg的TP、N-ZnO、T-ZnO加入1 mL灭菌超纯水中,超声分散15 min制备为抑菌溶/悬液备用。取少量新鲜的三代大肠埃希氏菌菌种,接种至LB液体培养基中,37 ℃,150 r/min震荡培养8h进行细菌增殖。采用麦氏比浊法,将菌液浓度调整至约108CFU/mL。按照1/100比例将调整好的菌液注入已冷却至45 ℃的MH固体培养基(琼脂含量1%)中,使培养基内菌体浓度约106CFU/mL,混匀备用。使用冷却至45 ℃的纯净MH固体培养基(琼脂含量2%)倾注平板,每板5mL,水平静置凝固作为第一层。将牛津杯放置第一层培养基中央,随后向平板内倾注含有菌体的MH培养基(琼脂含量1%)约20 mL,水平静置凝固,拔除牛津杯留下直径8 mm孔,作为第二层。吸取200 μL已配置好的溶/悬液注入孔内,4 ℃下预扩散2 h,随后放入培养箱中,37 ℃培养16 h,测定各样品抑菌圈直径,每个试样测量3次,取平均值。以相同方法测定各样品对金黄色葡萄球菌的抑菌圈。
(2)采用微量二倍稀释法测定配合体的最小抑菌浓度(MIC):参考刘子训[22]的方法并做修改,首先分别称取2 048 mg的TP、N-ZnO、T-ZnO加入100 mL无菌超纯水中,超声分散15 min制备为抑菌溶/悬液备用,在无菌96孔板每孔内先加入灭菌的2倍MH肉汤培养基100 μL,随后在每排第一孔加入100 μL抑菌溶/悬液。随后进行二倍稀释,即第一孔中加入溶/悬液后用移液枪吹打数次使之与肉汤充分混匀,然后吸取100 μL加入第二孔再充分吹打混匀,重复操作至最后一孔,混匀后吸出100 μL弃去。再向每孔中加入预先稀释好的菌液100 μL,使孔内菌体浓度约106cfu/mL。最终每排溶/悬液浓度依次为5 120,2 560,1 280,640,320,160,80,40,20,10,5,2.5 μg/mL。每块板上倒数第二排作为阴性对照(仅加肉汤培养基不加菌液),倒数第一排为阳性对照(加菌液不加溶/悬液)。96孔板放入震荡培养箱,37 ℃,150 r/min培养16 h后取出,向每孔内加入10 μL 灭菌的5%氯化三苯基四氮唑(TTC)水溶液,再放入培养箱中培养1 h,随后观察孔内颜色变化,从右至左第一个没有变红的孔所对应的浓度即为该样品的MIC值。
2 结果与讨论
2.1 介孔纳米氧化锌载体微观结构分析
2.1.1 前驱体及介孔纳米氧化锌载体晶型分析
图1(a)为前驱体Pre-N和Pre-C的XRD图谱。前驱体Pre-N与标准卡片JCPDS 00-19-1458主要峰值吻合,其主要成分为单斜晶系Zn5(CO3)2(OH)6,其余杂峰可能为反应过程中残留的模板剂与Zn2+离子生产的不溶性有机锌盐。前驱体Pre-C与之类似,但主要峰值强度与JCPDS 00-19-1458有一定差异,说明以硝酸锌为碳源制备的前驱体Pre-N纯净度和晶型完整度要优于以醋酸锌为碳源制备的前驱体Pre-C。
图1(b)为经热转化后的介孔纳米氧化锌N-ZnO和C-ZnO的XRD图谱。N-ZnO曲线上在36.62°、34.34°、36.48°、47.38°、56.56°、62.84°、66.30°、67.84°、69.02°、72.42°、76.95°、81.44°、89.58°观察到(100)、(002)、(101)、(102)、(110)、(103)、(200)、(112)、(201)、(204)、(202)、(104)、(203)晶体面,无多余杂峰,曲线与JCPDS 00-36-1451 ZnO一致,说明N-ZnO具有六方晶系纤锌矿结构,且基本无杂质。C-ZnO具有相同晶面特征峰,说明C-ZnO主要成分也是六方晶系纤锌矿,但仍保留少量杂峰,说明产物N-ZnO纯净度更高。
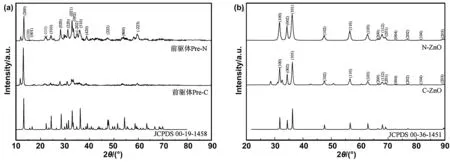
图1 前驱体(a)及介孔纳米氧化锌载体(b)的XRD衍射图
2.1.2 介孔纳米氧化锌载体形貌及结构分析
图2为制备的介孔纳米氧化锌载体N-ZnO及C-ZnO的TEM图,二者具有相似特征,整体均呈现带孔厚片状,且观察到大量介孔结构。图2(a)和(b)显示介孔多数为类圆形,且孔径较为近似,图2(c)和(d)孔型及孔径较不规则,部分呈狭型孔,N-ZnO孔道规则度优于C-ZnO。

图2 介孔纳米氧化锌载体N-ZnO(a)、(b)及C-ZnO(c)、(d)的TEM图
图3(a)为N-ZnO、C-ZnO及ZnO的氮气吸附/脱附曲线。根据国际纯粹与应用化学联合会(IUPAC)的分类,N-ZnO具有Langmuir Ⅳ型曲线特点,并存在H3型回滞环,表明N-ZnO具有介孔结构,且有较大孔容积[23-24]。0
图3(b)为N-ZnO、C-ZnO及ZnO的孔径分布曲线。可以看出,使用模板剂后产物N-ZnO得到的介孔孔径分布区间较为集中,C-ZnO孔径分布集中程度略低于N-ZnO,但具有更大的平均孔径。而未使用模板剂的产物ZnO,孔径分布较分散,孔容和比表面积也相对较小。分别使用BET模型、BJH模型和t-plot方法计算,得到N-ZnO的比表面积80.614 m2/g,平均孔径为7.426 nm,孔容为0.424 cm3/g,C-ZnO的比表面积为68.854 m2/g,平均孔径为8.155 nm,孔容为0.416 cm3/g,不使用模板剂的ZnO比表面积为49.056 m2/g,平均孔径为13.151 nm,孔容为0.255 cm3/g,较大的比表面积与孔容,可以提供更多的表面结合位点,有利于提高后续活性成分的搭载量。
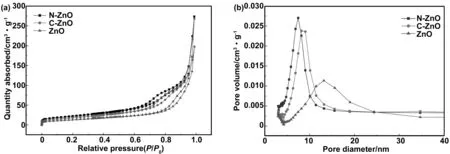
图3 N-ZnO、C-ZnO及ZnO的氮气吸附/脱附曲线(a)及孔径分布曲线(b)
2.2 配合体的结构及基本性能分析
2.2.1 形貌及结构分析
选择比表面积较高的介孔纳米氧化锌载体N-ZnO进行搭载实验,图4为前驱体Pre-N、介孔纳米氧化锌载体N-ZnO及茶多酚-介孔纳米氧化锌配合体T-ZnO的SEM图。由图4(a)看出,前驱体Pre-N由大量二维厚片状分散体堆叠形成三维花瓣状几何体。图4(b)为经热处理后的产物N-ZnO,前驱体原先的花瓣状集合状态被破坏,但基本保留了二维厚片形状,且经由烧蚀后可观察到明显的介孔结构。图4(c)和(d)为茶多酚-介孔纳米氧化锌配合体T-ZnO,经过负载茶多酚后,单片的二维介孔载体被茶多酚完全包裹,形成较为规整的球体形状。使用ImageJ软件对图4(d)视野内可见的球体进行粒径测量统计。最大粒径为0.59 μm,最小粒径为0.19 μm,平均粒径为0.42 μm。

图4 前驱体Pre-N (a)、介孔纳米氧化锌载体N-ZnO (b)及茶多酚-介孔纳米氧化锌配合体T-ZnO (c)、(d) 的SEM图
2.2.2 介孔纳米氧化锌载体及配合体的红外光谱分析
图5为N-ZnO、TP和T-ZnO傅立叶红外光谱图。N-ZnO曲线中3 422 cm-1处为表面羟基伸缩峰,1 619 cm-1峰可能是结合水中的H—O—H的弯曲振动,415 cm-1之后出现一个较大峰,是Zn—O键伸缩振动峰,证明产物N-ZnO是纤锌矿氧化锌[26]。
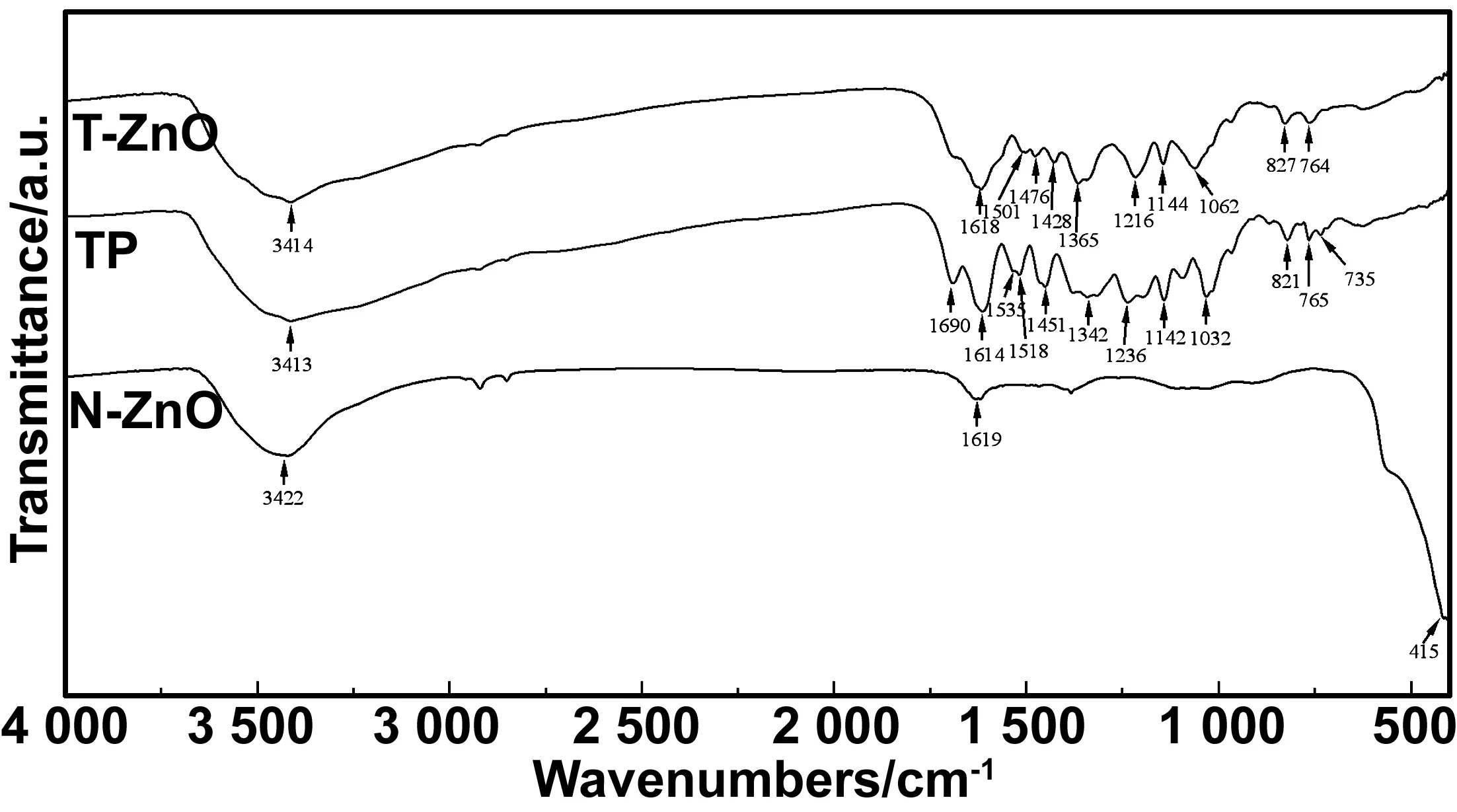
图5 介孔纳米氧化锌载体N-ZnO、茶多酚TP及茶多酚-介孔纳米氧化锌配合体T-ZnO的红外光谱图
TP的曲线中,3 413 cm-1为—OH伸缩振动峰,1 690 cm-1处为酯羰基—CO伸缩振动峰,1 614,1 518,1 535,1 451 和1 342 cm-1处是苯环骨架振动吸收峰,1 236和1 032 cm-1处分别为芳醚C—O—C的对称和反称伸缩振动峰,1 142 cm-1处为苯环C—H的面内弯曲振动峰,821,765,735 cm-1处分别为苯环—CH官能团的三取代、间双取代、邻双取代面内弯曲振动峰。
配合体T-ZnO中的羟基吸收峰轻微蓝移至3 414,1 365 cm-1处可能是Zn2+及亚甲基的倍频吸收峰[27]。EGCG等连苯三酚类衍生物和过渡金属离子发生配位反应时,配位主要发生在连苯三酚类衍生物分子两个相邻的酚羟基上,其中连苯三酚类衍生物的第三个酚羟基不参与配位,但可促进另外两个酚羟基的离解从而使配位更稳定[28],故TP的735 cm-1吸收峰在T-ZnO中消失,可能是Zn—O配位键的形成或振动导致苯环的邻双取代位的面内弯曲振动受限,同时821 cm-1峰蓝移至827 cm-1,说明三取代位也受到Zn2+的配合影响导致弯曲受限。1 690 cm-1峰减弱,这可能茶多酚中的酯羰基C=O与Zn2+配合所致[27],这与zhang等[29]的研究现象一致。由此可以推测,N-ZnO载体表面Zn2+与茶多酚发生了配位反应,且可能存在与羰基和羟基两种基团的配合方式。
2.2.3 前驱体、介孔纳米氧化锌载体和配合体的热性能分析
对Pre-N、N-ZnO、TP和T-ZnO分别进行热重分析,由图6(a)、(b)可以发现,Pre-N在250 ℃开始快速分解,在262 ℃达到最大分解速率拐点,在272 ℃达到终止点,前驱体Pre-N完全转变为纳米介孔氧化锌载体N-ZnO。证明热处理温度270 ℃可以保证前驱体的完全转化,同时介孔结构不被过分破坏。N-ZnO升温全程均较为稳定,仅在30~100 ℃之间有少量失重,这可能是因为其内部吸附了少量水分。TP和T-ZnO的失重分为两个阶段,第一阶段在30 ℃开始即有缓慢的失重,这可能是茶多酚内部游离水和结合水的蒸发脱除所致[30],随温度提升至210 ℃,TP出现一个较快的分解失重过程,并在235 ℃时达到最大分解速率,随后分解速率减缓并持续至800 ℃。T-ZnO与TP具有相似的失水过程,但第一阶段失重率明显大于TP,可能是因为配合体制备过程中吸收了更多的水分。210~800 ℃的失重可能为TP及T-ZnO中TP成分解为H2O、CO2、CO的过程[27],二者在到达800 ℃时,TP失重87.4%,T-ZnO失重55.6%,均未完全分解,但配合体T-ZnO第二阶段的总失重率明显低于TP,说明茶多酚TP和载体N-ZnO形成了稳定的配合体T-ZnO,提高了TP的热稳定性。
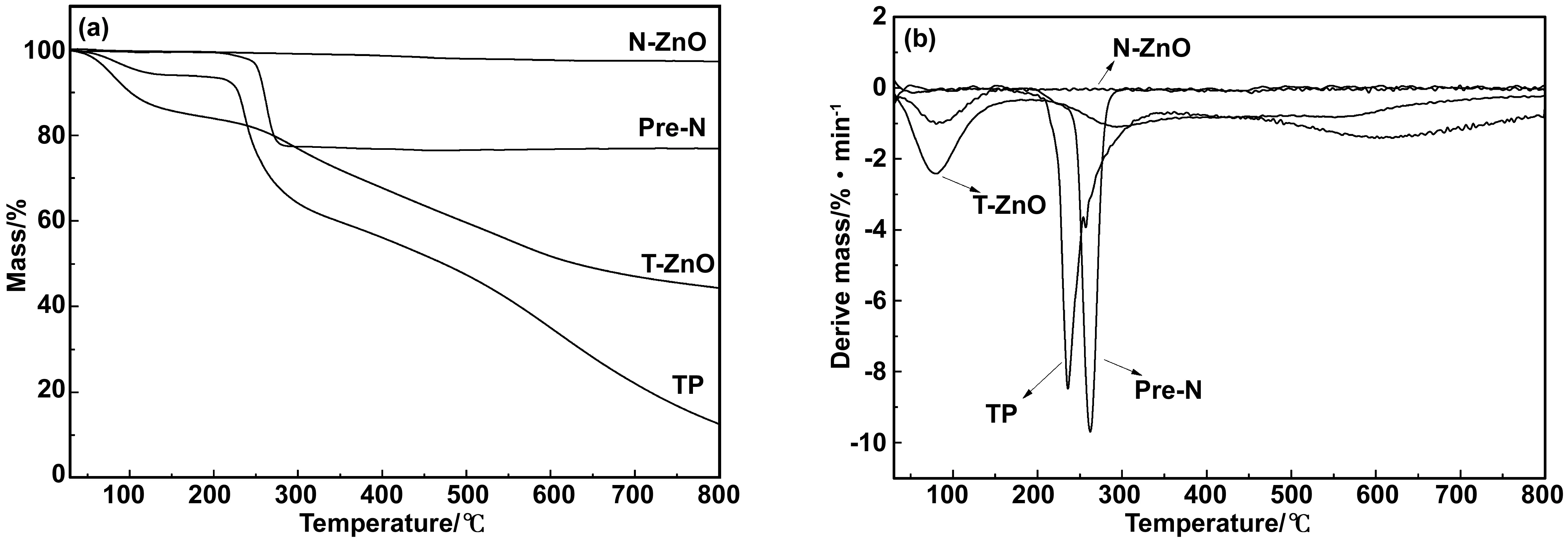
图6 Pre-N、N-ZnO、TP、T-ZnO的TGA(a)和DTG(b)曲线
2.2.4 配合体中茶多酚的搭载量分析
洗脱液吸光度法:图7为茶多酚在去离子水中溶解后的线性标准曲线,标准曲线方程为A=0.02621X-0.00177(R2=0.99998),分别测量3个不同稀释梯度的溶液吸光度,并计算溶液中总的游离TP质量,最终结果取平均值。混合洗脱液中游离TP为1.18 g,故配合体中TP的搭载量为4.82 g,最终计算搭载量约为76.28%.
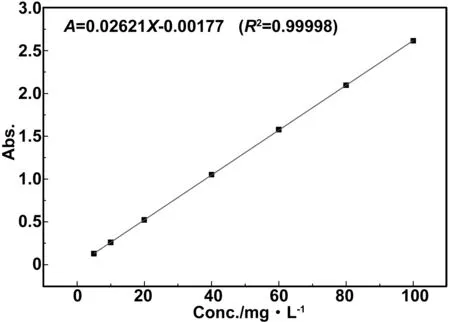
图7 茶多酚-去离子水溶液的吸光度/浓度线性标准曲线图
配合体ICP-OES测试法:使用电感耦合等离子体发射光谱仪(ICP-OES)测定配合体中Zn元素的占比,可知Zn元素占配合体中的比率约为20.52%,换算可得到ZnO约占配合体总质量的25.54%,即TP搭载量约74.46%,与洗脱液吸光度法测试结果接近。
2.3 配合体对茶多酚的控释性能分析
图8为T-ZnO在不同pH值的PBS缓冲液中对茶多酚的释放特性拟合曲线。T-ZnO中茶多酚总含量按照2.2.4中ICP-OES测试法得到的TP搭载量74.46%进行计算,释放率的计算依据式(4):

图8 不同pH条件下配合体T-ZnO对茶多酚的释放曲线

(4)
可知,pH值为4.0和5.5条件下,茶多酚的初期释放速度明显快于pH=7.4条件,释放4 h时,pH=4.0条件下茶多酚释放率达到50.72%,pH=5.5条件下释放率已达到57.33%,而pH=7.4条件下仅释放38.33%,释放24h时,pH=4.0条件下已释放79.13%,pH=5.5条件下已经释放90.74%,均接近最大释放率,而pH=7.4仅释放72.89%,随后仍有一定的释放量。可见不同pH条件可以有效调控配合体中茶多酚的释放速率。pH=5.5和7.4条件二者最终释放率均为90%左右,而pH=4.0条件下最终释放率仅80%,可能是因为多酚类化合物含有大量酚羟基,可游离出H+使溶液显示酸性[28],因而过低的pH值使得缓冲液体系中H+较多,抑制了配合体体系中茶多酚的向外游离。
2.4 配合体DPPH自由基清除性能分析
DPPH自由基是一种人工合成的稳定有机自由基,常用于评价化合物的抗氧化活性[31]。表1为TP、T-ZnO在0.5和24 h时对DPPH自由基清除率表。不同浓度条件下,TP对DPPH自由基均有较好的清除效果,清除率在91%~96%之间,证明茶多酚具有很强的抗氧化能力。T-ZnO在较低浓度时对DPPH自由基的初期清除率较低,随反应时间推移,清除率有较大提升。0.5 h时 2和4 mg/10mL浓度的清除率仅为63.41%和88.45%,而24h之后分别提升至94.79%和93.83%,较高浓度情况下,无论初期还是长期的清除率均较高,且高于TP组,10 mg/10mL条件下,0.5和24 h清除率最大可以达到96.16%和98.53%。说明T-Zno在较低浓度时具有延迟清除DPPH自由基的效果,可能与T-ZnO的控释效应有关,而在较高浓度下T-ZnO对DPPH自由基清除效果优于TP。
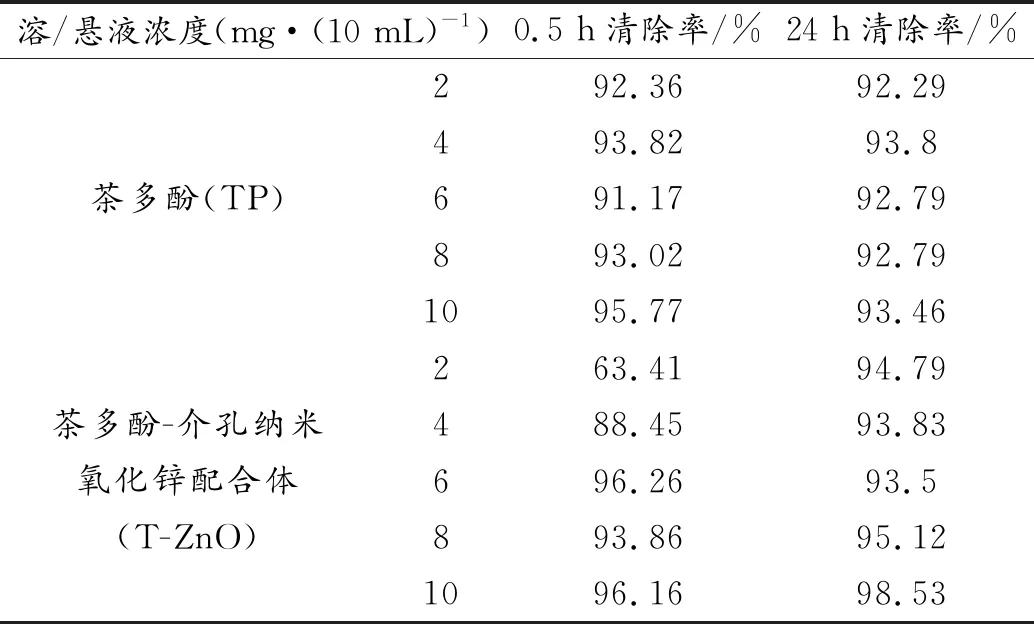
表1 茶多酚TP及配合体T-ZnO的DPPH自由基清除率
2.5 配合体的抑菌性能分析
图9是TP、N-ZnO及T-ZnO分别对大肠埃希氏菌和金黄色葡萄球菌的抑菌圈实图。表2是对应的抑菌圈直径数据。可知TP、N-ZnO及T-ZnO对大肠埃希氏菌和金黄葡萄球菌均有一定的抑菌性能,N-ZnO及T-ZnO针对两种菌都出现了内外双层抑菌圈,且内圈透明度较高,外圈透明度相对较低,可能是因为N-ZnO和T-ZnO抑菌成分从孔内向外扩散过程中,内侧浓度较高,细菌生长受抑制程度高,外缘浓度较低,细菌生长受到部分抑制,TP则没有出现双层抑菌圈。TP和N-ZnO对大肠埃希氏菌(属革兰氏阴性菌)的抑菌圈明显小于对金黄葡萄球菌(属革兰氏阳性菌),原因是这两种细菌细胞壁结构差异造成对抗菌剂的敏感性不同[32-33]。配合体T-ZnO结合了两者特点,也具有相似特征,但整体抑菌能力仍弱于N-ZnO,可能是因为T-ZnO因吸附搭载大量茶多酚导致自身粒径增大,与细菌的接触面积减小,同时因未调整至适宜pH值导致配合体中TP不易释放。
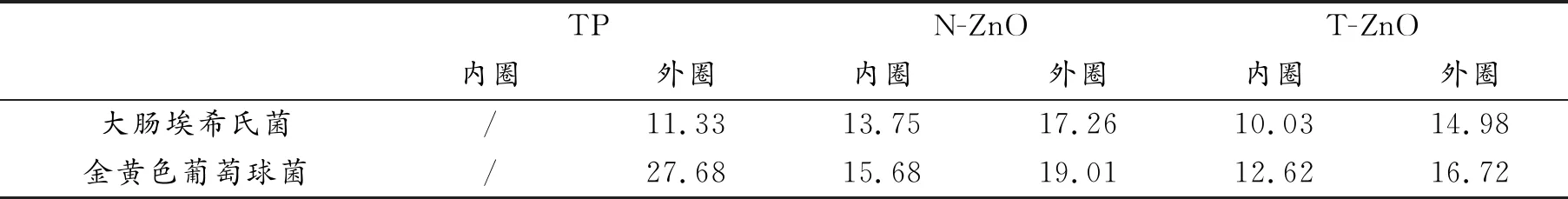
表2 TP、N-ZnO及T-ZnO对大肠埃希氏菌和金黄色葡萄球菌抑菌圈直径
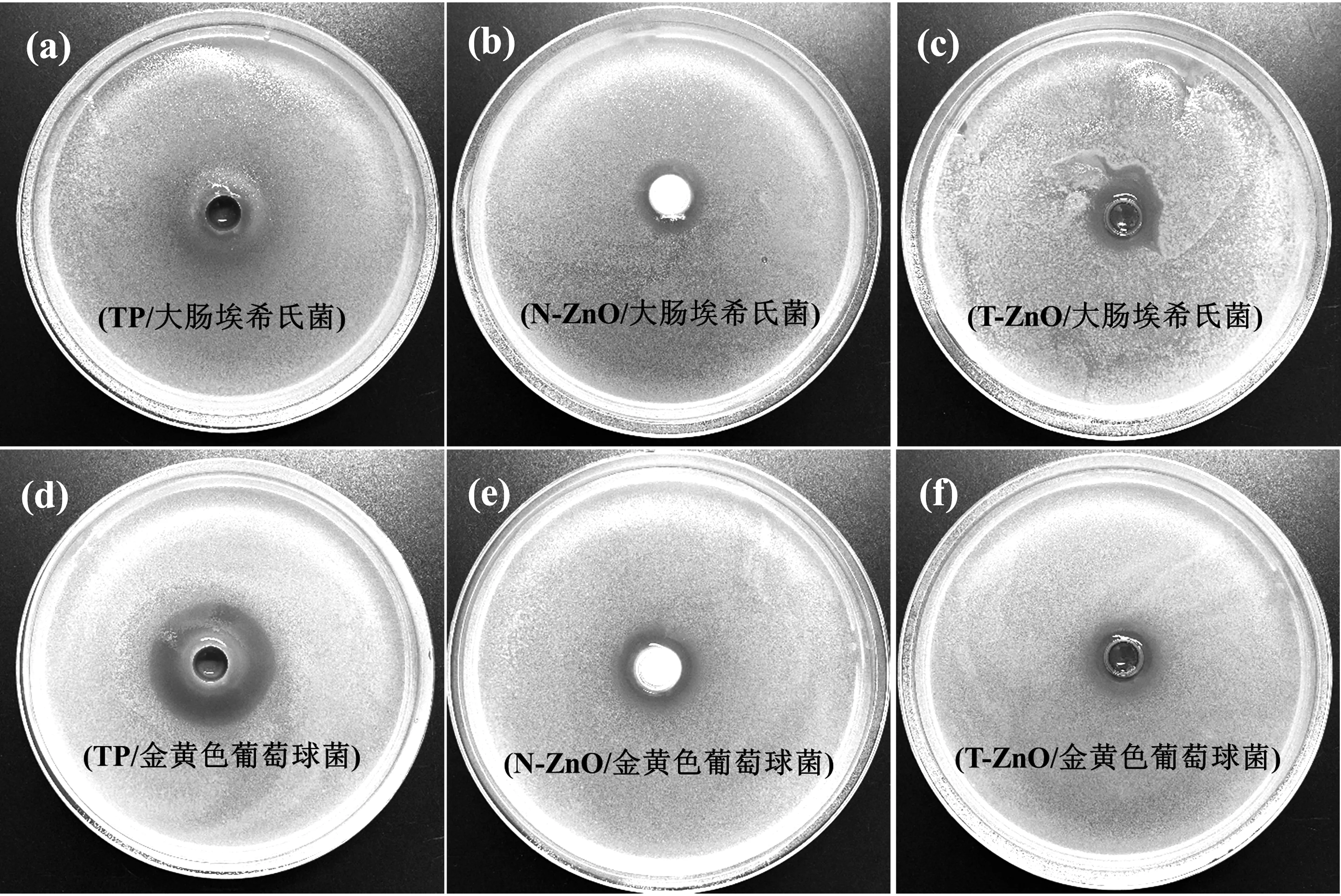
图9 TP、N-ZnO及T-ZnO分别对大肠埃希氏菌和金黄色葡萄球菌的抑菌圈图
表3为3种抗菌材料对大肠埃希氏菌和金黄色葡萄球菌的最小抑菌浓度(MIC),氯化三苯四氮唑(TTC)作为细菌呼吸的氢受体加入培养基,被活菌摄取后,在脱氢酶作用下,无色的TTC会转化为红色的三苯甲腙(TF),使活菌被染色。因此观察混合培养基中颜色变化和TTC被还原程度即可间接衡量菌体活性[22, 34]。大肠埃希氏菌组,N-ZnO的MIC值为320 μg/mL,TP和T-ZnO均为1 280 μg/mL,金黄色葡萄球菌组,TP、N-ZnO和T-ZnO的MIC值分别为320,80和160 μg/mL。三者对于大肠埃希氏菌和金黄色葡萄球菌均有明显的抑菌效果,但对后者的抑菌能力优于前者,这与抑菌圈实验结果一致。N-ZnO本身对大肠埃希氏菌和金黄色葡萄球菌都具有优异的抗菌性能,T-ZnO对大肠埃希氏菌的抑制能力与TP一致,对金黄色葡萄球菌的抑制能力则优于TP。
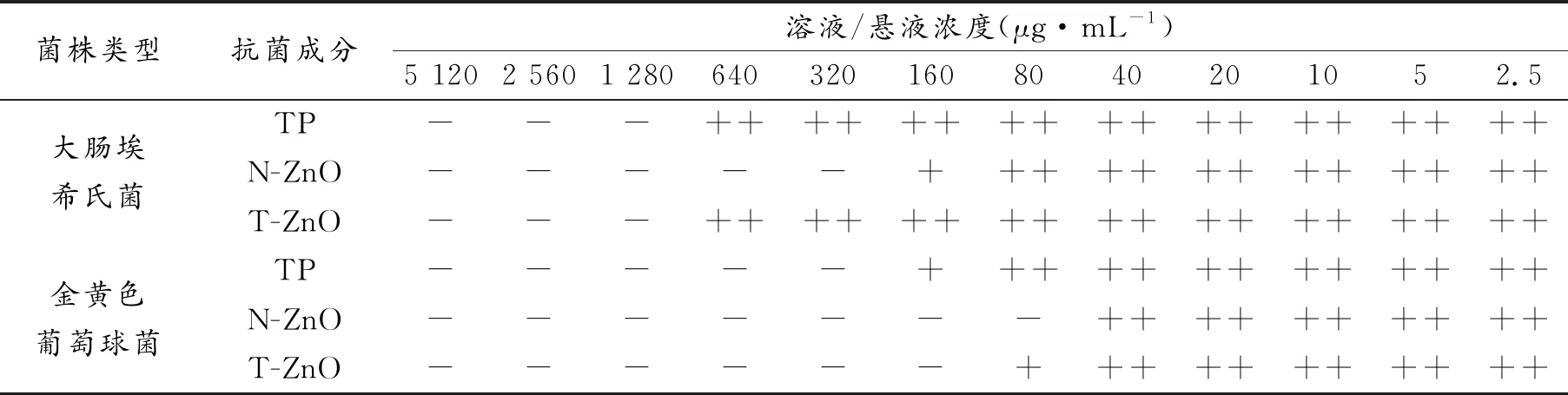
表3 TP、N-ZnO及T-ZnO的最小抑菌浓度(MIC)
3 结 论
(1)采用两种锌源物分别制备了的介孔纳米氧化锌,通过XRD、TEM、氮气吸附脱附测试等手段进行表征,两种产物均具有六方晶系纤锌矿结构。以硝酸锌为锌源的制备产物N-ZnO在结构上优于醋酸锌为锌源的制备产物C-ZnO,N-ZnO的比表面积80.614 m2/g,平均孔径为7.426 nm,孔容为0.424 cm3/g,C-ZnO的比表面积68.854 m2/g,平均孔径为8.155 nm,孔容为0.416 cm3/g。
(2)以N-ZnO为载体,成功制备了搭载茶多酚的控释活性配合体T-ZnO,搭载量高达74.46%~76.28%,且具有明显pH响应控释效果,弱酸性条件可以促进配合体中茶多酚的释放,pH=5.5条件下释放最快,但强酸性会抑制茶多酚的释放,pH=5.5和7.4条件下最大平衡释放量达到90%,pH=4.0条件下最大平衡释放量仅80%
(3)T-ZnO具有显著的DPPH自由基清除效果,在较低浓度下,0.5 h清除率相对低于茶多酚,但24 h后清除率优于茶多酚,具延迟清除效果。
(4)制备的介孔纳米氧化锌载体N-ZnO和配合体T-ZnO对大肠埃希氏菌和金黄葡萄球菌均具有明显抑菌效果,但在未控制pH值的条件下N-ZnO的抗菌性能更优异。如对T-ZnO进行pH调控,则有望进一步提高其抗菌效果。
