小鼠心肌I/R模型中HIF-1α对IL-2的表达调控作用及其机制研究
2022-09-07黄仲略杨威黄菲菲高翔
黄仲略,杨威,黄菲菲,高翔
心肌梗死是临床最常见的心血管疾病之一,可导致心室功能障碍、耗氧量增加,影响心脏功能甚至导致心肌纤维化[1]。在心肌细胞的缺血/再灌注(I/R)过程中,大量的活性氧累积可引起心肌细胞凋亡,目前尚无缓解心肌I/R损伤的有效方法[2]。发生I/R后,缺氧微环境可促进缺氧诱导因子-1α(HIF-1α)的表达,而HIF-1α则会调控细胞凋亡,促进VEGF的表达诱导血管再生[3]。研究发现白细胞介素(IL)-2与VEGF的水平呈正相关,且参与血管再生[4]。也有研究表明IL-2的升高会减轻心脏的I/R损伤,但具体机制尚不清楚。本研究主要分析I/R小鼠模型中HIF-1α对IL-2的表达调控作用及对心脏损伤的影响。
1 材料与方法
1.1 动物、试剂和材料BALB/c小鼠(SPF级,雄性,8~10周)。HP SONOS 5500型的超声心动图仪(飞利浦公司,美国)。HIF-1α过表达、siHIF-1α质粒以及相应的阴性对照(negative control,NC)(吉玛公司,中国)。三苯基氯化四唑(TTC)、HE和TUNEL染色试剂盒(碧云天公司,中国)。Trizol试剂(Aidlab公司,中国)。Trizol和RNeasy Mini试剂盒(QIAGEN GmbH公司,德国)。SYBR Premix Ex TaqTM试剂盒(TaKaRa公司,中国)。兔多克隆HIF-1α一抗(ab179483)、兔单克隆IL-2一抗(ab243650)、兔单克隆VEGF一抗(ab150375)和山羊抗免疫球蛋白G二抗(1:1000稀释,#ab6721)(Abcam公司,美国)。PDVF膜(EMD Millipore,美国)。ECL显色试剂盒(Thermo Fisher公司,美国)。
1.2 分组和干预将60只小鼠随机分为对照组、I/R组、I/R+HIF-1α和I/R+siHIF-1α组(n=15)。通过经典结扎法构建I/R模型[5],腹膜内注射1%戊巴比妥(20 g/L,2 ml/kg)麻醉,仰卧固定后连接心电图,迅速开胸后,小心撕开心包腔后暴露心脏,利用5-0号缝合线结扎冠状动脉(冠脉)前降支,但不完全扎紧,心电图ST段升高至0.5 mV以上即可。30 min后,将心脏迅速放回胸腔内,简单缝合胸腔,腹腔注射8×105U的青霉素预防感染。对照组小鼠仅暴露心脏相同时间但不结扎。I/R+HIF-1α和I/R+siHIF-1α组尾静脉注射HIF-1α过表达或siHIF-1α质粒,每次2 mg/kg,每周2次,连续1周[6]。通过注射等量的NC质粒作为对照组。1周后通过小鼠眼眶收集外周血,颈椎脱臼处死后取出心脏组织。
1.3 动物实验观察指标及方法
1.3.1 Western blot将心肌梗死边缘的心肌组织经研磨、裂解后通过4℃离心12 000 rpm,5 min,收集总蛋白。在8%的SDS-PAGE凝胶的上样孔中每个加入30 μg总蛋白进行电泳分离,并将其转移到PVDF膜上。在室温下将膜浸入5%脱脂牛奶中2 h封闭非特异性抗原。随后,将膜与HIF-1α、IL-2和VEGF一抗在4℃下孵育过夜,将膜与二抗在室温下孵育1 h。使用化学发光试剂显示,使用Quantum One软件分析灰度计算蛋白相对于GAPDH的表达量,计算HIF-1α、IL-2和VEGF蛋白的相对表达水平。
1.3.2 ELISA应用ELISA检测心肌损伤指标,外周血离心2000 rpm,20 min后收集上层血清抗体反应后显色,酶标仪检测450 nm处吸光度,根据标准曲线计算肌酸激酶同工酶(CK-MB)和肌钙蛋白(cTnT)浓度。
1.3.3 TTC检测梗死百分比将新鲜心脏组织样品放入切片研磨机中,在-20℃冰箱中冷冻30 min后进行切片。将心脏组织从心尖段沿心脏短轴方向切成约2 mm厚的薄片,每片心脏3~4片。 将切好的切片置于2%的新鲜的TTC溶液中,充分接触TTC溶液。0.5 h后取出切片,用4%多聚甲醛固定,拍照,计算心肌梗死面积(以切片中心肌梗死部分面积占总切片面积的百分比表示)。
1.3.4 HE染色心肌梗死边缘的心肌组织在室温下用4%多聚甲醛固定6 h。用乙醇脱水(从低浓度到高浓度)后,将组织包埋在石蜡中。将石蜡包埋的小鼠肌肉组织切成5 μm切片,将切片固定于载玻片上,室温下放入苏木精中染色10 min。自来水洗涤1~2 min后,将玻片置于10%冰醋酸中10 s,置于1%氨水中,直到切片变蓝后,自来水清洗1~2 min后,将玻片放入曙红中10 s。在乙醇(浓度分别为70%、90%、95%、100%,每个浓度5 min)中脱水后,将玻片置于二甲苯中2 min;重复此步骤1次,最后用中性胶密封玻片。在倒置显微镜下观察载玻片。
1.3.5 TUNEL染色石蜡包埋心肌梗死边缘的心肌组织,制成5 μm的切并用二甲苯脱石蜡2次,每次10 min,经过梯度乙醇透脱水(乙醇浓度:100%、95%、90%、80%和70%)。切片在37℃的潮湿暗箱中用50 μl的TUNEL反应溶液处理60 min。随后用苏木精对细胞核进行染色,然后常规脱水、脱色和固定。检查细胞凋亡率并使用光学显微镜400的放大倍数捕获图像,计算TUNEL阳性细胞数的比例作为凋亡指数。
1.3.6 RT-qPCR使用TRIzol试剂从心肌组织中提取总RNA,Nanodrop 2000进行定量。使用RNeasy Mini试剂盒分离mRNA。使用SYBR Premix Ex TaqTM进行RT-qPCR反应:95℃下持续2 min 58℃下维持20 s,在72℃下反应20 s(该步骤40个循环),以GAPDH为内参使用2-ΔΔCt法计算IL-2和VEGF mRNA的相对表达水平。
1.4 统计学处理统计分析采用SPSS 19.0软件进行数据处理。数据以平均值±标准偏差(±s)表示。多组间比较进行方差分析,两两比较使用SNK-q检验。以P<0.05为差异具有统计学意义。
2 结果
2.1 各组I/R小鼠心肌组织中HIF-1α表达水平比较四组梗死边缘组织中HIF-1α水平比较,差异具有统计学意义(P<0.05)。I/R组的HIF-1α蛋白水平高于对照组(P<0.05);I/R+HIF-1α组的HIF-1α蛋白水平高于I/R组(P<0.05);I/R+siHIF-1α组的HIF-1α蛋白水平低于I/R组(P<0.05),图1。

图1 Western blot检测各组I/R小鼠心肌组织中HIF-1α表达水平
2.2 HIF-1α对I/R小鼠心肌损伤指标的影响四组心肌损伤指标比较差异具有统计学意义(P<0.05)。I/R组的CK-MB和cTnT水平高于对照组(P<0.05);I/R+HIF-1α组的CK-MB和cTnT水平显著低于I/R组(P<0.05);I/R+siHIF-1α组的CK-MB和cTnT水平高于I/R组(P<0.05),表1。

表1 HIF-1α对I/R小鼠心肌损伤指标的影响(n=15)
2.3 HIF-1α对I/R小鼠梗死面积的影响如图2所示,白色为心肌梗死部位。四组心肌梗死面积比较差异显著(P<0.05);I/R组的梗死面积(34.14±3.42%)高于对照组(P<0.05);I/R+HIF-1α组的心肌梗死面积(22.37±2.18%)低于I/R组(P<0.05);I/R+siHIF-1α组的心肌梗死面积(49.86±4.56%)高于I/R组(P<0.05)。
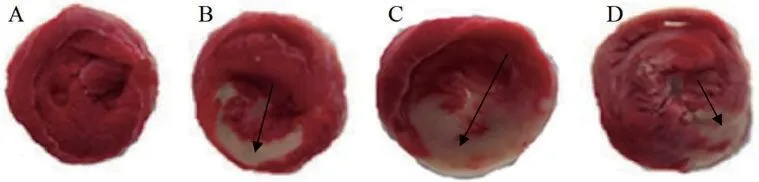
图2 TTC染色检测HIF-1α对I/R小鼠梗死面积的影响
2.4 HIF-1α对I/R小鼠心肌梗死边缘心肌组织损伤的影响对照组细胞核染色清晰,细胞质染色均匀,细胞排列有序。I/R组细胞核染色变深或变浅,心肌细胞染色变浅,形状发生改变,排列紊乱。I/R+HIF-1α组细胞排列异常和损伤程度较轻。I/R+siHIF-1α组的损伤程度较I/R组严重,图3。
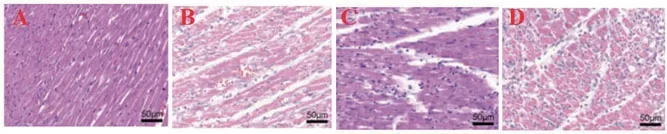
图3 HE染色检测HIF-1α对I/R小鼠梗死边缘心肌组织损伤的影响
2.5 HIF-1α对I/R小鼠心肌梗死边缘心肌细胞凋亡的影响如图4所示,蓝色为细胞核,棕色为TUNEL阳性细胞核,提示细胞凋亡。四组心肌细胞凋亡情况比较差异显著(P<0.05)。I/R组的凋亡指数(21.26±2.56%)显著高于对照组(2.13±0.25%)(P<0.05);I/R+HIF-1α组的凋亡指数(12.75±2.03%)显著低于I/R组(P<0.05);I/R+siHIF-1α组的凋亡指数(30.83±3.57%)显著高于I/R组(P<0.05)。

图4 TUNEL染色检测HIF-1α对I/R小鼠梗死边缘心肌细胞凋亡的影响
2.6 HIF-1α对I/R小鼠心肌梗死边缘心肌组织中IL-2和VEGF mRNA表达水平的影响四组IL-2和VEGF mRNA水平比较,差异具有统计学意义(P<0.05)。I/R组的IL-2和VEGF mRNA水平高于对照组(P<0.05);I/R+HIF-1α组的IL-2和VEGF mRNA水平显著高于I/R组(P<0.05);I/R+siHIF-1α组的IL-2和VEGF mRNA水平低于I/R组(P<0.05),表2。

表2 HIF-1α对I/R小鼠梗死边缘心肌组织中IL-2和VEGF mRNA表达水平的影响(n=15)
2.7 HIF-1α对I/R小鼠心肌梗死边缘心肌组织中IL-2和VEGF蛋白表达水平的影响四组的IL-2和VEGF蛋白水平比较差异具有统计学意义(P<0.05)。I/R组的IL-2和VEGF蛋白水平高于对照组(P<0.05);I/R+HIF-1α组的IL-2和VEGF蛋白水平高于I/R组(P<0.05);I/R+siHIF-1α组的IL-2和VEGF蛋白水平低于I/R组(P<0.05),图5和表3。

表3 HIF-1α对I/R小鼠梗死边缘心肌组织中IL-2和VEGF蛋白表达水平的影响(n=15)

图5 Western blot检测HIF-1α对I/R小鼠梗死边缘心肌组织中IL-2和VEGF蛋白表达水平的影响
3 讨论
心血管疾病是全球死亡的主要原因[7],I/R损伤是心肌梗死后导致心肌细胞损伤和凋亡的关键病理基础,但是I/R后缓解心肌组织损伤促进心脏修复的机制仍不清楚。
缺血缺氧是I/R的主要特征,可直接促进HIF-1α的表达。HIF-1α在介导对缺氧的适应性反应中起关键作用[8]。在缺氧条件下,氧依赖性PHD1/2/3酶抑制HIF-1α通过泛素-蛋白酶体途径降解,HIF-1α积累并转移到细胞核[9]。HIF-1α通过HRE启动子核心序列5'-RCGTG-3'与HRE 结合的形成异二聚体复合物,从而促进VEGF、诱导型一氧化氮合酶等的转录和合成,进而在细胞和全身水平调节对缺氧的反应[10]。研究表明,心肌I/R后β-连环蛋白的稳定会促进HIF-1α的表达[11]。也有研究表明在I/R后诱导HIF-1α的表达有助于缓解心肌损伤[12]。本研究利用结扎法成功构建小鼠I/R模型,小鼠HIF-1α蛋白的水平升高,并出现大量的心肌细胞凋亡。在建模后通过注射HIF-1α过表达或siHIF-1α质粒调控HIF-1α的表达,结果显示I/R后上调HIF-1α会减少心肌梗死面积,缓解心肌组织损伤并抑制心肌细胞凋亡。
为进一步分析HIF-1α缓解心肌I/R损伤的机制,本研究也检测了IL-2和VEGF转录和蛋白表达的水平。IL-2是调控T细胞增殖分化和抗炎反应的重要细胞因子[13]。研究显示肝I/R后IL-2会调控肝内白细胞浸润参与损伤后的修复[14]。IL-2与VEGF的水平正相关,与血管再生有关。HIF-1α可激活VEGF的转录,提高蛋白的表达,促进血管再生,促进心肌I/R后的修复[15]。此外,IL-2可与受体结合促进胃癌血管生成[16]。本试验中,心肌I/R小鼠模型中IL-2和VEGF mRNA和蛋白的水平均升高,表明提高HIF-1α的表达则会进一步上调IL-2和VEGF转录及其蛋白表达,抑制HIF-1α则会下调IL-2和VEGF mRNA和蛋白的表达。结合文献,我们认为 I/R后HIF-1α的升高会促进IL-2和VEGF mRNA和蛋白的表达,从而诱导血管再生恢复缺血心肌的血液灌注,进而抑制心肌细胞损伤和凋亡,促进I/R后的恢复。
本文局限性在于,HIF-1α调控IL-2和VEGF转录和蛋白表达的分子机制及HIF-1α促进IL-2和VEGF对心肌I/R损伤后炎性反应、血管生成、细胞凋亡的影响仍需深入研究。
综上所述,小鼠I/R模型中HIF-1α可通过促进IL-2的表达缓解心肌组织损伤,HIF-1α可能是治疗心肌梗死的关键。
