基于网络药理学和分子对接工具探究田基黄注射液抗病毒性肝炎的活性成分及作用机制
2022-09-07胡萍童周肖雪洋孔璐琦胡琳珍
胡萍,童周,肖雪洋,孔璐琦,胡琳珍
(湖北大学生命科学学院,湖北大学中药生物技术湖北省重点实验室, 湖北 武汉430062)
0 引言
病毒性肝炎是由不同肝炎病毒引起的一种传染病,或将进一步恶化为肝纤维化和肝癌[1]等疾病.据WTO数据显示,每年大约有145万人死于病毒性肝炎[2].目前,治疗病毒性肝炎的药物主要有干扰素、核苷酸类似物等,但由于它们易产生耐药性,临床应用非常受限制.中草药作为我国历史悠久的传统药物,具有多成分、多靶点及毒性低等特点[3].田基黄注射液是由地耳草水提物制取的单味制剂,具有清热解毒、散痰化肿和保肝护肝等功效,临床上常用于治疗小儿黄疸和各类急慢性肝炎等疾病.文献报道田基黄注射液具有抑菌、抗肿瘤和抗病毒性肝炎等药理活性[4].然而,田基黄注射液抗病毒性肝炎的具体作用机制尚少见报道.
网络药理学是基于文献调研和各类数据库为基础而构建网络,从而将中药-疾病-靶点联系起来,进而系统分析中药多组分对疾病多靶点的作用机制[5-6].本研究运用网络药理学和分子对接工具对田基黄注射液抗病毒性肝炎的活性成分及作用机制进行探索,为未来进一步深入研究奠定理论基础和研究方向.
1 方法
1.1 田基黄注射液活性化合物获取从TCMSP (http://lsp.nwu.edu.cn/tcmsp.php) 数据库中筛选田基黄注射液的活性化合物.采用口服生物利用度(OB)≥30%和药物相似性(DL)≥0.18作为筛选阈值.
1.2 活性化合物的相关靶点STITCH (http://stitch.embl.de/)、SwissTargetPrediction (http://swisstargetprediction.ch/)、PharmMapper (http://lilab-ecust.cn/pharmmapper/) 3个数据库中以“Homo sapiens”和概率值≥0.7为标准筛选潜在活性化合物的预测靶点.去除每个数据库中的重复基因后,将3个数据库的并集基因导入到Uniprot (http://www.uniprot.org/) 数据库中,获得各个基因的ID格式;在GeneCards (https://www.genecards.org/) 数据库中筛选病毒性肝炎的已知靶点;再用OmicShare (https://www.omicshare.com/) 将筛选后得到的化合物预测靶点与疾病已知靶点取交集,得到化合物和疾病的重叠靶点.
1.3 PPI网络构建将重叠靶点导入STRING数据库 (https://www.string-db.org),以“Homo sapiens”和置信度0.4为标准,构建蛋白相互作用网络.
1.4 GO和KEGG富集分析在DAVID数据库中 (https://david.ncifcrf.gov/) 对重叠靶点进行GO和KEGG富集分析.GO分析主要从生物过程,细胞组分和分子功能进行分析;运用Graphpad软件对GO结果进行可视化.对重叠靶点进行KEGG富集分析,选择排名前十的KEGG通路为可能的信号通路.
1.5 网络构建利用Cytoscape3.7.2构建“活性化合物-重叠靶点-通路”网络,并运用Cytoscape3.7.2的Network Analyzer分析有效成分及靶点的网络拓扑参数.
1.6 分子模拟对接分别从TCMSP数据库和PDB数据库中下载活性化合物的分子结构和重叠靶点的蛋白结构.运用DS20程序进行化合物-靶点虚拟对接,并用PyMOL进行化合物-蛋白复合物的3D可视化分析.
2 结果
2.1 活性化合物的获取田基黄注射液主要成分为地耳草的水提取物,在TCSMP数据库中,输入“diercao”按照OB≥30%、DL≥0.18为阈值共筛选出8种活性化合物,分别是quercetin、mairin、kaempferol、β-sitosterol、sitosterol、tetramethoxyluteolin、poriferasterol monoglucoside_qt和3,5,7,3′,5′-pentahydroxy flavonol.
2.2 筛选重叠靶点利用STITCH、SwissTargetPrediction和PharmMapper 3个数据库预测8种活性化合物的相关靶点,筛选标准为活性化合物与假定靶点之间的相互作用≥0.7.去除重复后,共获得243个假定靶点.从GeneCards数据中筛选已知病毒性肝炎的靶点,并将已知靶点与假定靶点进行交集,共获得5个重叠靶点(图1),分别是F2、MET、EGFR、AKT1和MAPK1.

图1 重叠靶点
2.3 重叠靶点GO和KEGG通路分析为了阐释活性化合物与重叠靶点之间的关系,我们进一步探究了这些重叠靶点可能具有的生物功能.我们将5个重叠靶点进行GO和KEGG分析.图2是GO对化合物的生物学功能注释结果.此外,KEGG的结果(图3)显示了关键靶基因(MAPK1、AKT1、 EGFR、MET)在Rap1信号通路、Ras信号通路和PI3K-AKT信号通路上有较多富集.
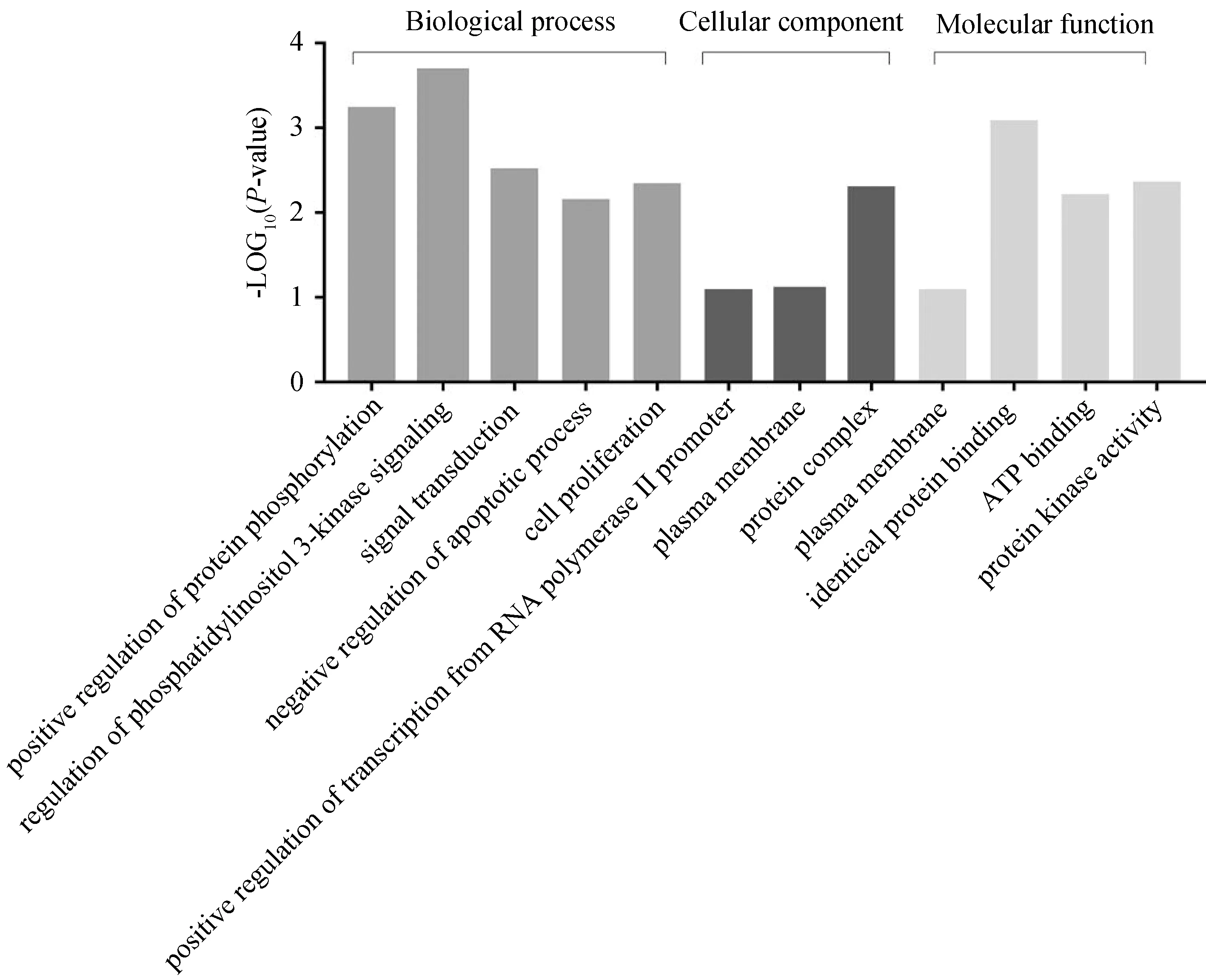
图2 重叠基因富集结果
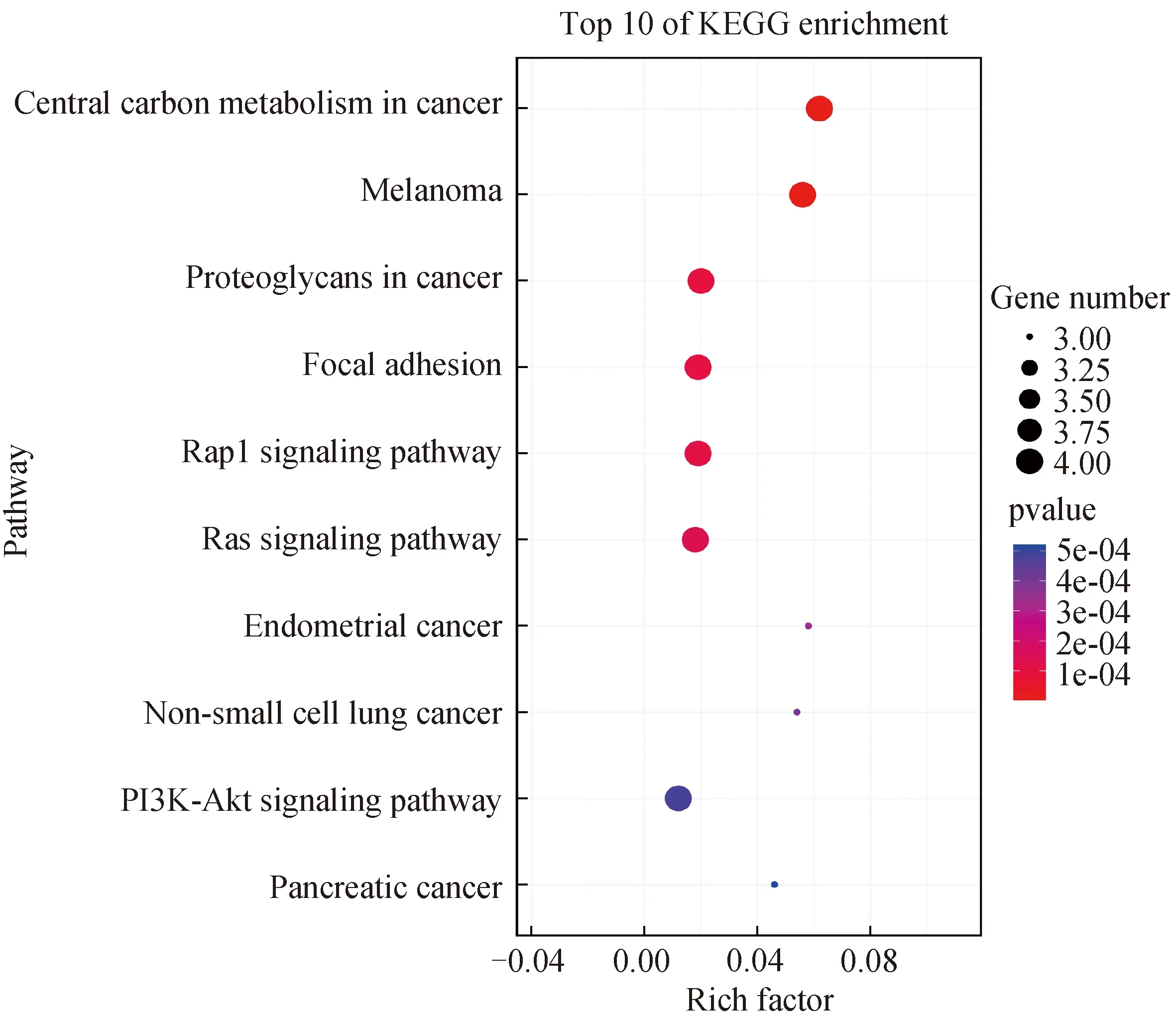
图3 KEGG富集分析结果
2.4 PPI网络构建将5个重叠靶点导入STRING数据中,得到重叠靶点的相互作用网络(图4).该网络是由5个节点和7条边组成.其中,平均节点度为3.2,平均局部聚类数为0.867,PPI富集值P值为0.109.
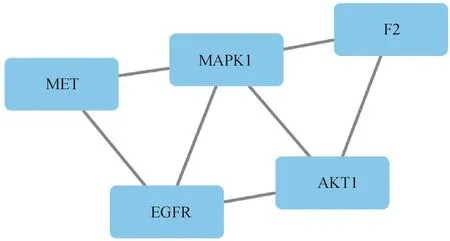
图4 重叠靶点相互作用网络
2.5 网络建设与分析为了进一步探讨活性化合物与重叠靶点之间的关系,我们利用Cytoscape3.7.2软件构建了“活性化合物-重叠靶点-通路”网络(图5).根据网络分析选择排名靠前的活性化合物为quercetin、β-sitosterol和sitosterol.

图5 活性化合物-重叠靶点-通路网络
2.6 活性化合物和关键靶点分子模拟对接选择“活性化合物-重叠靶点-通路”网络排名靠前的活性化合物quercetin、beta-sitosterol和sitosterol与重叠靶点基因进行分子模拟对接,考察化合物与靶点结合能力及稳定性.一般来说,结合能越低,构象越稳定.结合能 < 0 kcal/mol,分子与靶点具有结合能力.结合能<-7 kcal/mol表示分子与靶点具有较强的结合能力和一定的稳定性.Ki(抑制率常数)< 10 μmol/L,分子与靶点具有较好的抑制活性.将活性化合物quercetin、β-sitosterol、sitosterol分别与MAPK1 AKT1 EGFR MET进行分子对接,发现quercetin、beta-sitosterol、sitosterol分别与MAPK1 AKT1 EGFR MET具有较负的结合能和较低的抑制率常数(表1).用PyMOL对化合物-蛋白的结合情况进行可视化分析(图6).
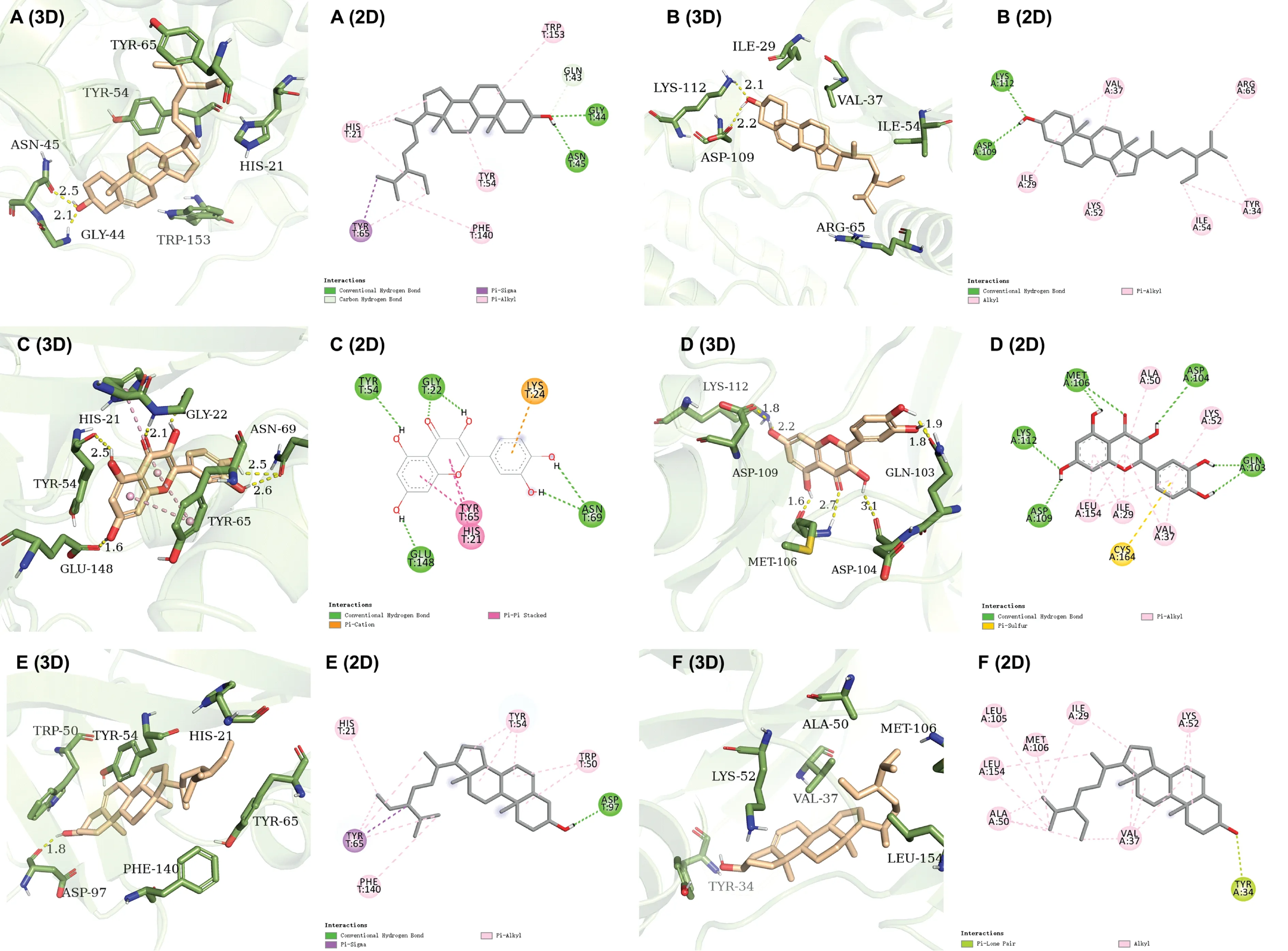
图6 活性化合物与关键靶点分子对接3D和2D可视化
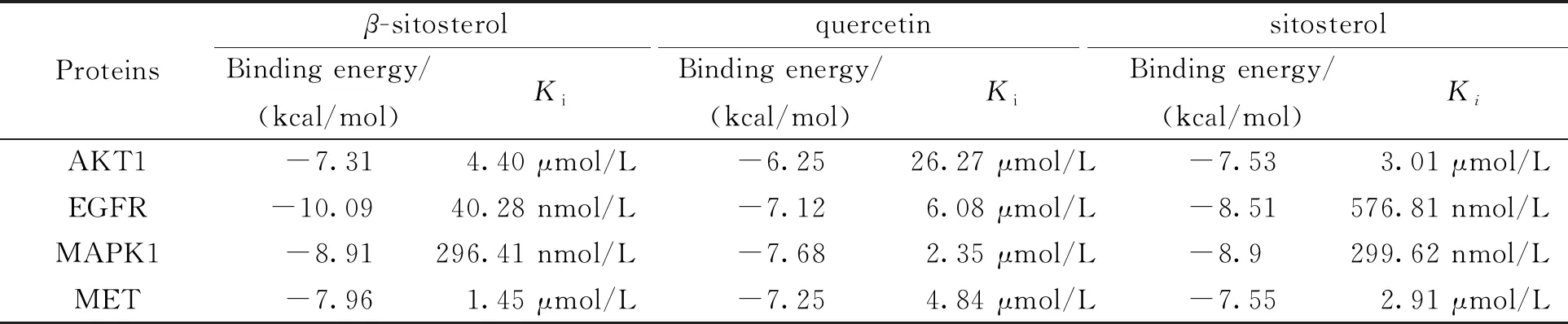
表1 活性化合物与靶点分子对接结果
3 讨论
运用中药进行疾病治疗是现代医疗的有力治疗手段之一.然而,中药的有效成分比较复杂,且通常作用于多个靶点,导致很多中药制剂的作用机制不明确.本研究旨在通过运用网络药理学和分子模拟对接工具来探讨田基黄注射液抗病毒肝炎的作用机制.我们通过网络药理学数据分析发现,槲皮素、山奈酚、β-谷甾醇是田基黄的主要活性化合物.槲皮素是一种黄酮化合物,具有抗氧化、抗凋亡以及抗炎等药理作用,对肝纤维化和肝硬化具有缓解作用[7].乙型肝炎病毒X蛋白(hepatitis B virus X protein, HBx)是一种由154个氨基酸组成的分子量为16.5 kD的病毒蛋白[8],而槲皮素能够有效改变HBx诱导的几个关键癌基因表达,具有抗病毒肝炎的药理活性[9].β-谷甾醇是存在于植物的天然甾醇[10],具有改善糖尿病、抗癌、缓解焦虑和镇静等药理作用[11-13],其在较高剂量时可以有效减少肝脏胆固醇的形成[14],具有保肝护肝的作用.山奈酚是主要存在于茶叶、花椰菜中的一种天然黄酮醇,具有抗炎、抗氧化和抗肿瘤等药理活性[15-16].Kumar等人发现山奈酚可以通过抑制活性氧的生成,减少对细胞DNA的损伤[17],从而发挥保肝护肝的功效.
通过对化合物靶点预测和疾病靶点分析,我们发现MET、EGFR、AKT1和MAPK1可能是田基黄注射液抗病毒性肝炎的关键作用靶点.其中,EGFR是一种膜受体,属于受体酪氨酸激酶家族.Masanori等人发现,EGFR的表达与HBV的复制有关,过表达的EGFR能够促进HBV的转录[18].BH-AS1是一种长链非编码RNA,通过激活MAPK通路来提高乙肝表面抗原的水平,进而促进肝癌的形成[19].此外,HCV通过PI3K-AKT途径促进了AKT1的磷酸化,从而促进了HCV的复制与翻译.以上研究表明,田基黄注射液治疗抗病毒性肝炎可能与作用于这些关键靶基因有关.
通过构建“活性化合物-重叠靶点-通路”网络,我们发现上述关键靶基因与Rap1信号通路和Ras信号通路有关.HBV可激活PI3K/AKT通路,抑制糖原合成酶激酶3-β(glycogen synthase kinase3-β, GSK3β)表达,从而促进细胞存活和增殖,最终促使肝癌的形成[20-21].Zhang等人发现HCV可通过激活Ras/Raf/MEK/ERK信号通路,而Ras/Raf/MEK/ERK又可促进溴结构域包含蛋白7(bromodomain containing 7, BRD7)表达,从而促进肝癌细胞增殖[22].Rap1是小GTP酶Ras亚家族成员之一,G蛋白偶联受体和死亡结构域相关受体等都会激活Rap1[23].而且,Rap1突变体可以调控ERK通路,如在再生障碍性T细胞中,Rap1抑制Ras-ERK介导的IL-2表达;而在正常T细胞中过表达Rap Gap则会增加ERK活性[24-25].最后,我们采用DS20程序,将预测的活性成分与关键靶点的相应蛋白进行分子模拟对接,结果发现化合物能够与蛋白有数值较负的结合能和较低的抑制率常数;通过PyMOL程序,将化合物-蛋白进行可视化分析,发现化合物能较好地结合在蛋白的口袋空腔中,并能与氨基酸残基形成氢键作用和疏水作用(图6),进一步验证了有效成分及靶点预测的可能性.
本研究通过运用网络药理学数据分析和分子对接工具,对田基黄注射液抗病毒性肝炎的活性成分及作用机制进行了探索,为未来进一步深入研究田基黄的药理作用机制奠定了基础和方向,也为中药有效成分分析及作用机制探讨提供了研究思路.
