谷胱甘肽稳定金纳米簇的电化学发光用于汞离子的高灵敏检测
2022-09-07雷茹淋唐瑶肖艳张修华王升富
雷茹淋,唐瑶,肖艳,张修华,王升富
(1.铜仁职业技术学院,贵州 铜仁554300;2.湖北大学化学化工学院,湖北 武汉430062)
0 引言
几十年来,重金属离子对环境的污染和身体的伤害一直是全世界关注的一个重点问题[1].世界卫生组织国际癌症研究机构公布的致癌物清单中,汞和无机汞化合物位于3类致癌物.汞是一种常见的环境污染物,通常通过工业释放至环境并传播.例如在发电厂的燃烧、固体废弃物的燃烧等过程中,都会产生一些汞蒸气.这些汞蒸气进入大气中后,被氧化成水溶性汞离子(Hg2+)随着雨水降落到地面上,对水和土壤造成污染.水里的微生物,可以将无机汞变为剧毒的甲基汞[2-4].而甲基汞作为一种具有神经毒性的环境污染物,通过食物链累积在水中动物的体内,进而在人体中累积,与人体中蛋白质中的巯基相互作用,对中枢神经系统、肝脏、胃肠道等器官造成严重损害,对人类健康和自然环境构成严重威胁[5-6].因此,开发有效的分析方法用于检测环境中的汞离子是十分有意义的.目前,已发展了一些Hg2+分析方法,例如,Doong等利用掺杂的石墨烯量子点发展一种荧光分析方法,检测废水中的Hg2+[7],Cheng等采用CdSe@CdS 量子点功能化的MoS2以及DNA探针发展了一种Hg2+电化学发光传感器[8].然而,这些分析方法仍然面临一些不足,如分析设备昂贵,试剂成本高,分析操作复杂,生物毒性大等.因此,开发简单方便、成本低、生物相容性好的Hg2+分析方法十分必要.
金属纳米簇是一类超小尺寸的金属纳米材料,由几个至上百个金属原子,在配体的保护下,聚集而成,尺寸大小通常在2 nm左右[9-10].由于具有超小的尺寸,金属纳米簇产生较强的量子尺寸效应,使得金属颗粒原本连续的能级产生分裂,得到类似于分子的分裂能级结构,因而金属纳米簇具有“类分子”的发光性能[11].其中,金属纳米簇的电化学发光(ECL)性能在近些年来尤为吸引了关注[12].在众多的分析方法中,ECL分析具有一些独特的优势,例如零背景噪声、良好的时间和空间可控性、快速的响应速度、高灵敏度和低成本等.因此,ECL分析已被广泛地应用于环境、医疗和工业等领域[13].作为ECL领域的一种新型发光材料,金属纳米簇与传统的钌、鲁米诺等ECL发光试剂相比,具有一些明显的优势,例如低的生物毒性、高的稳定性、可调的发光性能,简单的合成操作、易标记等.因此,金属纳米簇在ECL领域是一类非常有前景的新型发光纳米材料.利用金属纳米簇构建ECL分析传感器,有望开发性能良好的分析方法用于环境中污染物的监测.
本工作以谷胱甘肽(GSH)做配体合成了金纳米簇(GSH-Au NCs),对所制备的GSH-Au NCs 的尺寸,形貌及光学性能进行了表征,将其修饰于玻碳电极(GCE)表面,构建了基于GSH-Au NCs的ECL传感器(图1),用于汞离子的检测.当溶液体系中存在Hg2+时,Hg2+可通过亲金属相互作用与金纳米簇相结合[14],从而猝灭GSH-Au NCs的ECL信号.GSH-Au NCs ECL信号猝灭的程度与Hg2+浓度成线性关系,检测范围可达0.1 μmol/L~1 mmol/L,检出限为18 nmol/L(S/N=3).且所构建的GSH-Au NCs的ECL传感器能够用于实际样品自来水中Hg2+的检测,具有一定的实用价值.与以往的方法相比,本工作提出的分析方法简单方便,易于构建,同时具有较好的灵敏度和选择性,有望为环境监测中有害物质Hg2+的定量分析检测提供一条快速、简便的新途径.
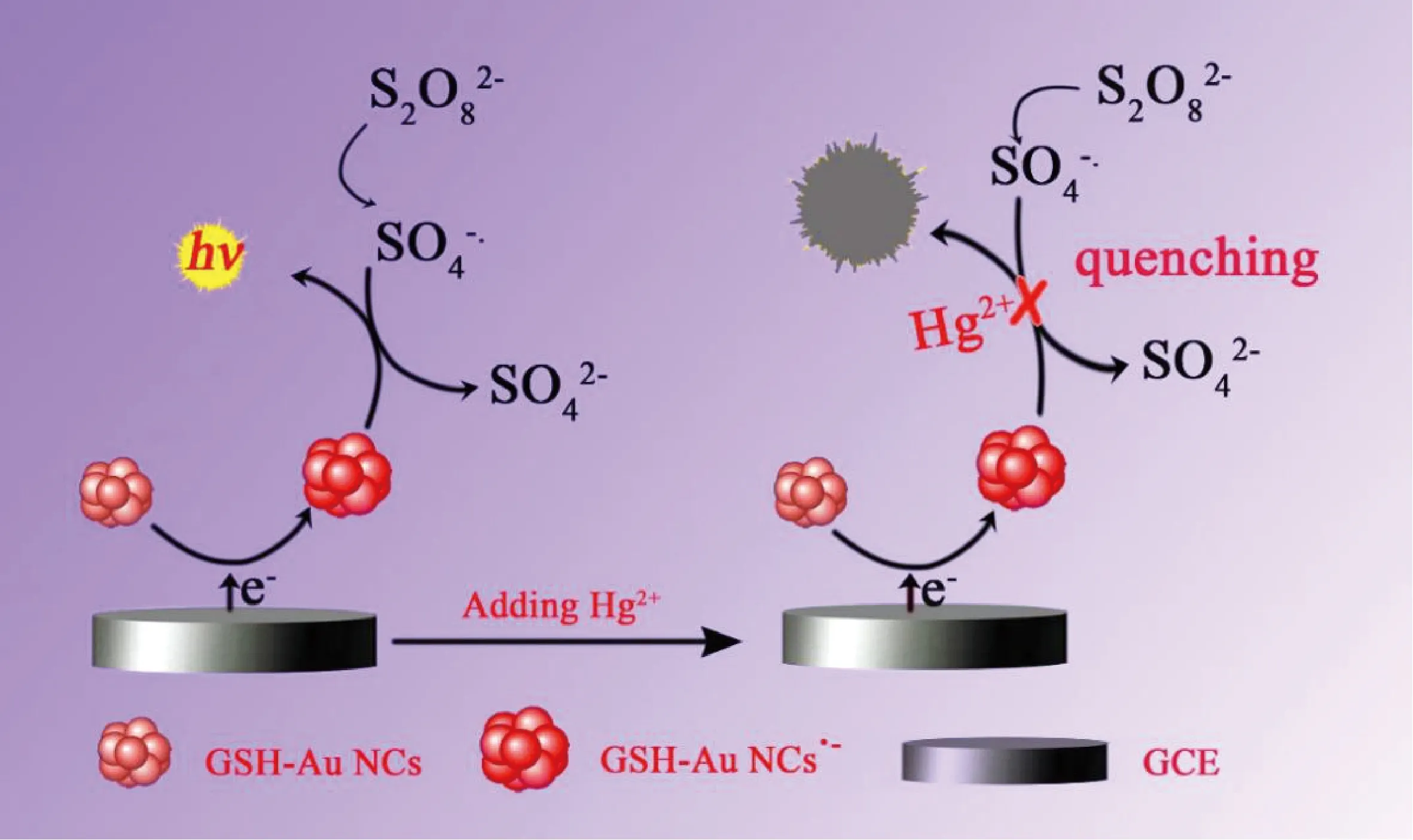
图1 GSH-Au NCs 电化学发光传感器用于Hg2+检测的示意图
1 实验部分
1.1 实验材料氯金酸(HAuCl4) 购自美国Sigma公司;谷胱甘肽(GSH)、乙二胺四乙酸(EDTA)购自阿拉丁试剂公司(上海,中国);氢氧化钠(NaOH)、磷酸二氢钾(KH2PO4)、磷酸氢二钠(Na2HPO4)等其他无机盐试剂均购自国药集团(上海,中国),所用试剂均为化学分析纯,使用时并未进行进一步纯化,实验用水均为二次蒸馏水(18.25 MΩ·cm).
1.2 实验仪器透射电子显微镜TEM(日本JEOL),加速电压为200 kV;电化学发光检测仪MPI-E型(西安瑞迈);电化学工作站CHI 660E(上海辰华);荧光光谱仪RF-5301(日本岛津);UV-2700 紫外-可见光谱仪(日本岛津UV-2700);纳米粒度分析仪(马尔文,英国);傅里叶变换红外光谱仪(尼高力,美国);X线光电子能谱分析(PE公司,美国);pH 320-S酸度计(梅特勒-托利多,瑞士).
1.3 谷胱甘肽稳定的金纳米簇(GSH-Au NCs)合成称取0.040 g GSH溶解于4 mL H2O中,搅拌条件下,将3 mL质量分数为0.8%的HAuCl4溶液逐滴缓慢加入GSH溶液中,搅拌10 min后,溶液逐渐由浑浊变为澄清,再向其中加入42 mL H2O,继续搅拌5 min后,加热溶液至70 ℃反应12 h,得到GSH-Au NCs.将GSH-Au NCs用透析袋(MWCO=3 500 Da)进行分离纯化,然后将所得的GSH-Au NCs放入4 ℃的冰箱保存备用.
1.4 电极的制备将玻碳电极用Al2O3抛光,然后依次置入水、乙醇、水中超声.重复两次超声操作后,取5 μL GSH-Au NCs滴涂到预处理干净的电极表面,常温下干燥后,得到GSH-Au NCs/GCE备用.
1.5 Hg2+的ECL检测在2 mL电解质溶液中,加入20 μL不同浓度 Hg2+,混合均匀后,测量传感器在混合电解质里的电化学发光.利用三电极体系进行ECL测试:GSH-Au NCs/GCE为工作电极,饱和甘汞电极为参比电极,铂电极为对电极.采用的电解质溶液为0.1 mol/L K2S2O8的PBS缓冲溶液(0.1 mol/L,pH=7.4).所采用的ECL测试条件:扫描电压为0 ~ -2 V,扫描速率为0.1 V/s,光电倍增管为600 V,放大级数为4.
2 结果与讨论
2.1 GSH-Au NCs合成与表征根据文献报道的方法合成了谷胱甘肽稳定的金纳米簇[15],采用TEM对所合成的GSH-Au NCs的形貌尺寸进行了表征,结果如图2(A)所示,水热法制备的GSH-Au NCs呈现出均匀分散的球形颗粒,粒径大小为(2.0 ± 0.1)nm,表明制备的Au NCs为超小尺寸的纳米材料.对其进行紫外吸收及荧光发射光谱表征,由图2(B)中紫外吸收光谱可以看出,GSH-Au NCs从440 nm处开始出现吸收,无传统大尺寸金纳米颗粒的等离子共振吸收(500~600 nm)峰出现,荧光光谱图显示的发射峰在570 nm处,进一步表明了GSH-Au NCs的成功制备.在此基础上,采用XPS分析对所制备纳米材料进行了元素价态表征,结果如图2(C),其中金Au 4f7/2的结合能位于84.0 eV,表明HAuCl4被还原,得到了金纳米簇.另外,与GSH的红外吸收光谱相比,GSH-Au NCs的红外吸收光谱中,在2 500 cm-1巯基的振动峰消失(图2(D)),表明GSH通过巯基与金形成Au-S键结合到金纳米簇表面,对金纳米簇起到保护作用.表征结果表明上述合成条件能够成功制备出谷胱甘肽为配体的稳定发光金纳米簇.

图2 (A) GSH-Au NCs的透射电镜图;(B) GSH-Au NCs的紫外吸收及荧光发射光谱;(C) GSH-Au NCs中Au 4f轨道的X线光电子能谱;(D) GSH-Au NCs及GSH的红外吸收光谱
2.2 电化学发光原理GSH-Au NCs是一种“类分子”的纳米材料,其超小的尺寸产生了较强的量子尺寸效应,使得金属原来连续的能级结构产生分裂,从而形成类似于分子的分裂能级,因而GSH-Au NCs可具有电化学发光的性能.GSH-Au NCs的ECL机制属于共反应剂机制[16].本工作中,GSH-Au NCs/S2O82-ECL体系可能发生的ECL反应如下:
GSH-Au NCs + e-→ GSH-Au NCs•-,
S2O82-+ e-→ SO42-+ SO4•-,
GSH-Au NCs•-+ SO4•-→ GSH-Au NCs*+ SO42-,
GSH-Au NCs*→ GSH-Au NCs +hν.
当体系中存在Hg2+时,由于Hg2+能与金纳米簇通过亲金属相互作用而结合,形成Hg-Au金属键,从而改变金纳米簇组成结构,造成GSH-Au NCs的ECL发光猝灭[14](图 1),利用ECL发光信号的猝灭可定量对体系中存在的Hg2+进行检测.
2.3 检测条件的优化
2.3.1 电解质浓度的优化 由于ECL强度受体系中共反应剂浓度的影响,首先研究了GSH-Au NCs的ECL强度与共反应剂K2S2O8的浓度之间的相关性.如图3(A)所示,随着反应体系中K2S2O8浓度的不断增加,GSH-Au NCs的ECL强度也相应随之增加,而当溶液中K2S2O8的浓度增加到高于0.1 mol/L后,由于受到电极表面积和发光试剂浓度的限制,GSH-Au NCs的ECL强度基本不再变化.根据此实验结果,综合考虑到ECL强度以及试剂消耗的问题,从而选用0.1 mol/L K2S2O8作为共反应剂的最佳浓度用于后续研究.
2.3.2 金纳米簇浓度的优化 由于ECL发光试剂含量对ECL体系的发光强度也起到了决定性的关键作用,进一步研究了电极表面GSH-Au NCs的浓度对检测体系ECL信号强度的影响.首先配置了浓度为0.1、0.3、0.5、0.7、0.9和1.1 mg/mL的GSH-Au NCs溶液,然后将不同浓度的GSH-Au NCs溶液滴涂到电极表面,测其ECL信号.结果如图3(B)所示,电极ECL信号随GSH-Au NCs浓度的增加而增加,当金纳米簇浓度增加到0.7 mg/mL后,其ECL强度基本保持不变.因此选用0.7 mg/mL GSH-Au NCs滴涂作为电极制备条件.
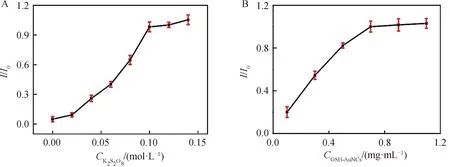
图3 共反应剂K2S2O8 的浓度(A)及GSH-Au NCs的浓度(B)对电极体系电化学发光信号的影响
2.4 Hg2+的ECL检测考察了所制备的GSH-Au NCs/GCE电极对水中汞离子的分析检测效果,将GSH-AuNCs/GCE电极插入到含有不同浓度Hg2+(0.01、0.05、0.1、0.5、1、10、50、100、500、1 000 μmol/L)的电解质溶液中,测量溶液体系的ECL信号.如图4(A)所示,当溶液中Hg2+的含量不断增加时,GSH-Au NCs的ECL信号被猝灭的程度不断增加,当Hg2+的含量达到100 μmol/L,ECL信号被猝灭的程度基本到达平台.通过对曲线进行拟合(图4(B)),得到GSH-Au NCs ECL信号的猝灭对水中汞离子检测的线性方程为y=0.25x+ 0.28 (R2=0.99),检测范围为0.1 μmol/L~1 mmol/L,检出限LOD为18 nmol/L(S/N=3).尽管我国生活饮用水中汞的安全浓度限值是大约是5 nmol/L左右,但往往日常生活中,部分生活污染用水,水产养殖用水及工业排放废水中,所含汞含量会大大超标,而远高于5 nmol/L,我们所构建的分析方法能够有效分析检测,部分生活用水或工业排放废水中的汞含量情况,为水中汞污染的鉴别有供一种潜在方法,有望在实际应用中体现一定价值.
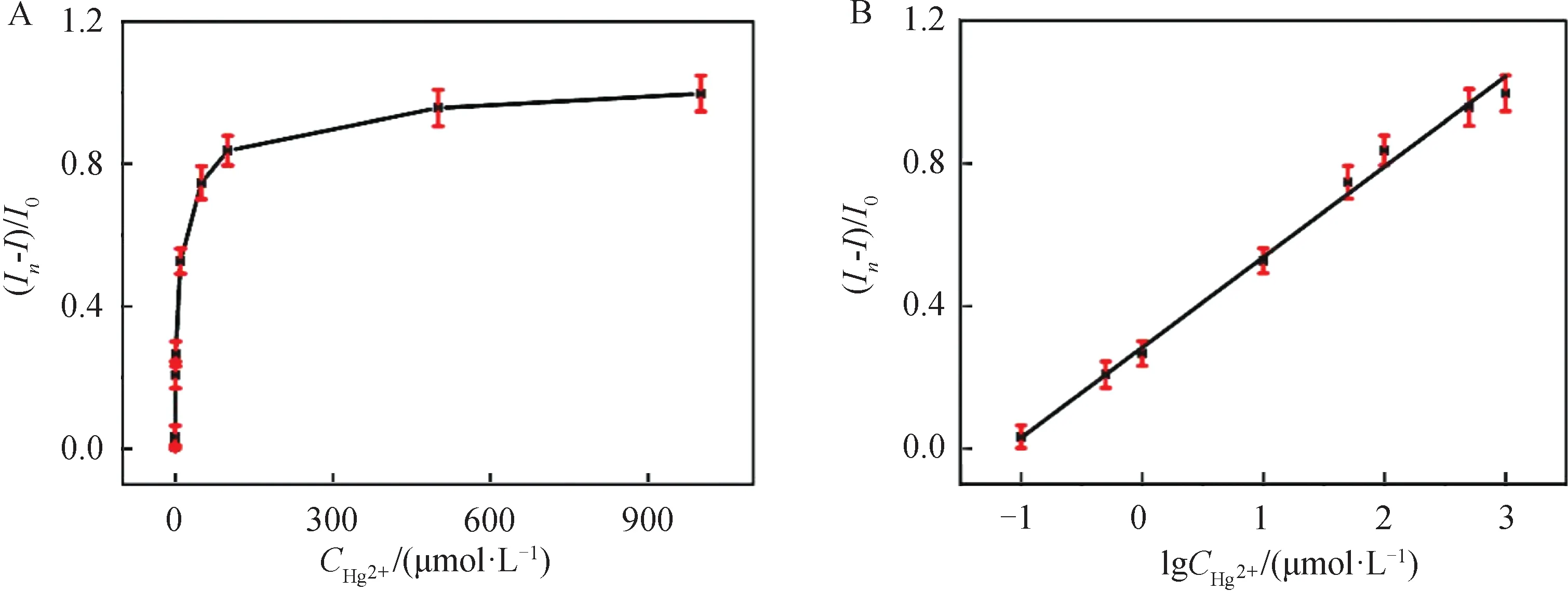
图4 (A) 不同Hg2+浓度下,GSH-Au NCs的ECL猝灭效率;(B) GSH-Au NCs 的 ECL 猝灭效率与Hg2+浓度之间的线性关系;(I0和I分别是添加 Hg2+ 前后,GSH-Au NCs 的ECL强度)
分析方法对目标物的选择性也是决定该方法分析检测效果好坏的重要因素,研究了所构建的方法对Hg2+分析的选择性,研究了GSH-Au NCs的ECL信号对一些常见金属离子(包括K+、Na+、Mg2+、Al3+、Fe2+、Ca+、Zn2+、Cu2+和Ag+)的响应情况.在选择性研究实验中,干扰离子的浓度为500 μmol/L,Hg2+浓度为50 μmol/L.实验结果表明:Cu2+会对GSH-Au NCs的ECL产生一定的猝灭效果,除Cu2+外的其他离子对Hg2+的测定没有干扰(图5).根据文献报道,Cu2+对GSH-Au NCs的ECL的猝灭,是由于Cu2+易于与GSH-Au NCs表面的羧基配位结合,从而通过电子转移作用猝灭GSH-Au NCs的ECL发光[17].目标物Hg2+对GSH-Au NCs的ECL的猝灭,源于Hg2+能够与金纳米簇通过亲金属相互作用,形成Hg-Au金属键,影响纳米材料的组成,而这种破坏是不可逆的.因此,可以根据Cu2+和Hg2+对GSH-Au NCs的ECL不同的猝灭机理,对Cu2+和Hg2+的响应加以区分.当在含有Cu2+的电解质溶液中,加入强的络合剂EDTA混合均匀后,进行GSH-Au NCs的ECL测量,结果显示,GSH-Au NCs的ECL基本没有被猝灭,而在含有Hg2+的电解质溶液中,加入EDTA后,GSH-Au NCs的ECL依然保持猝灭.因此,可以通过加入EDTA来消除Cu2+对Hg2+检测的干扰,使得该分析方法对Hg2+具有良好的选择性.
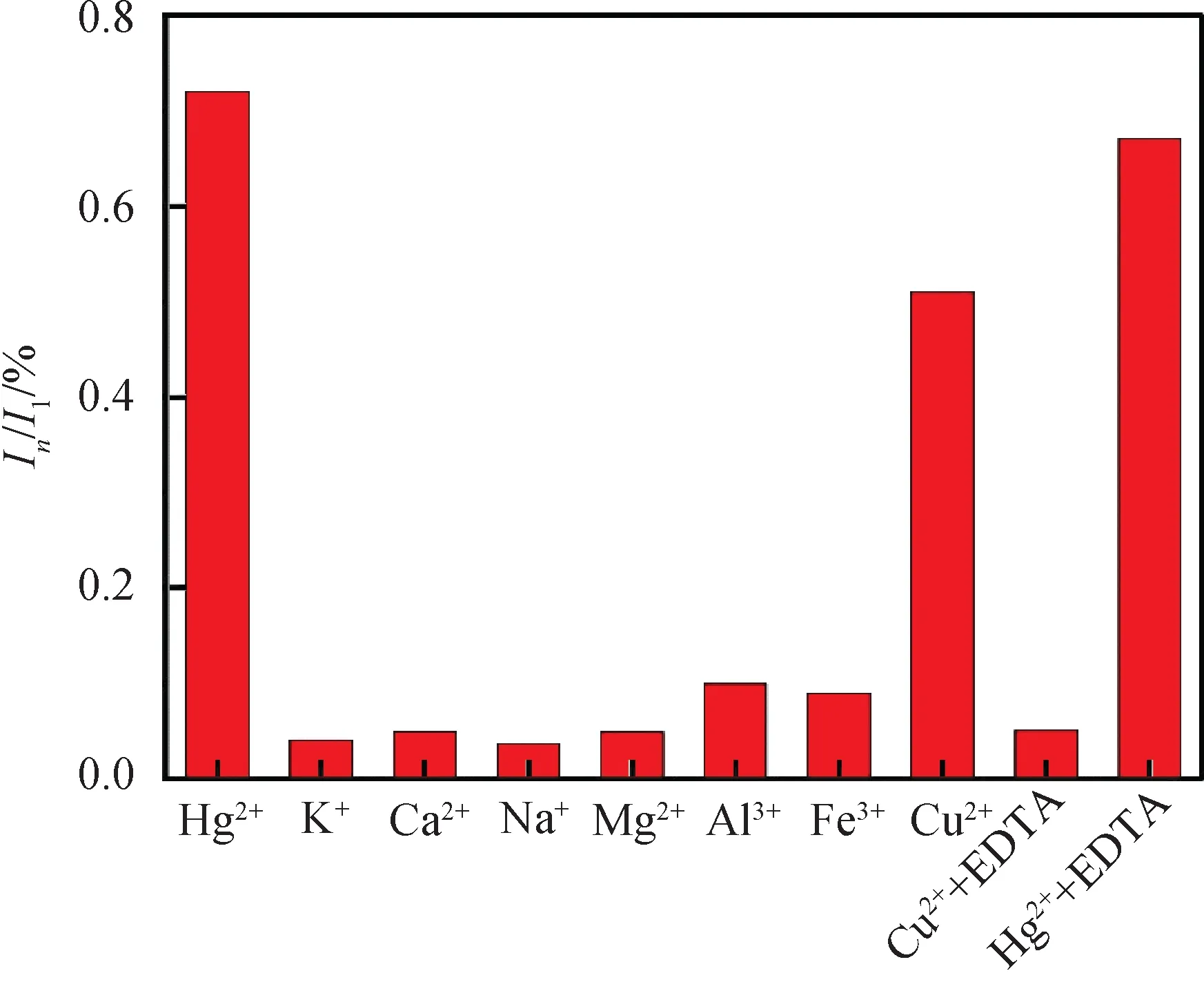
图5 GSH-Au NCs 电化学发光传感器对Hg2+分析的选择性
分析传感器的稳定性对分析方法的实际应用具有重要的影响,对所构建的GSH-Au NCs电极的ECL稳定性进行了研究,结果如图6所示,在连续扫描下,发现GSH-Au NCs的ECL信号十分稳定,表明构建的传感器具有良好的稳定性.

图6 GSH-Au NCs 电化学发光传感器的稳定性
对GSH-Au NCs修饰电极的批间重现性和使用寿命进行了考查.实验结果显示,在相同条件下,所制备的6根修饰电极的ECL信号基本保持一致(图7(A)),说明GSH-Au NCs电极的修饰具有良好的批间重现性,且所制备的修饰电极在放置的7 d时间内,第n天的ECL信号与第1天的相比,衰减十分微弱(图7(B)),表明电极能够在一定时间范围内稳定保存,具有较长的使用寿命,以满足分析测试的需求.
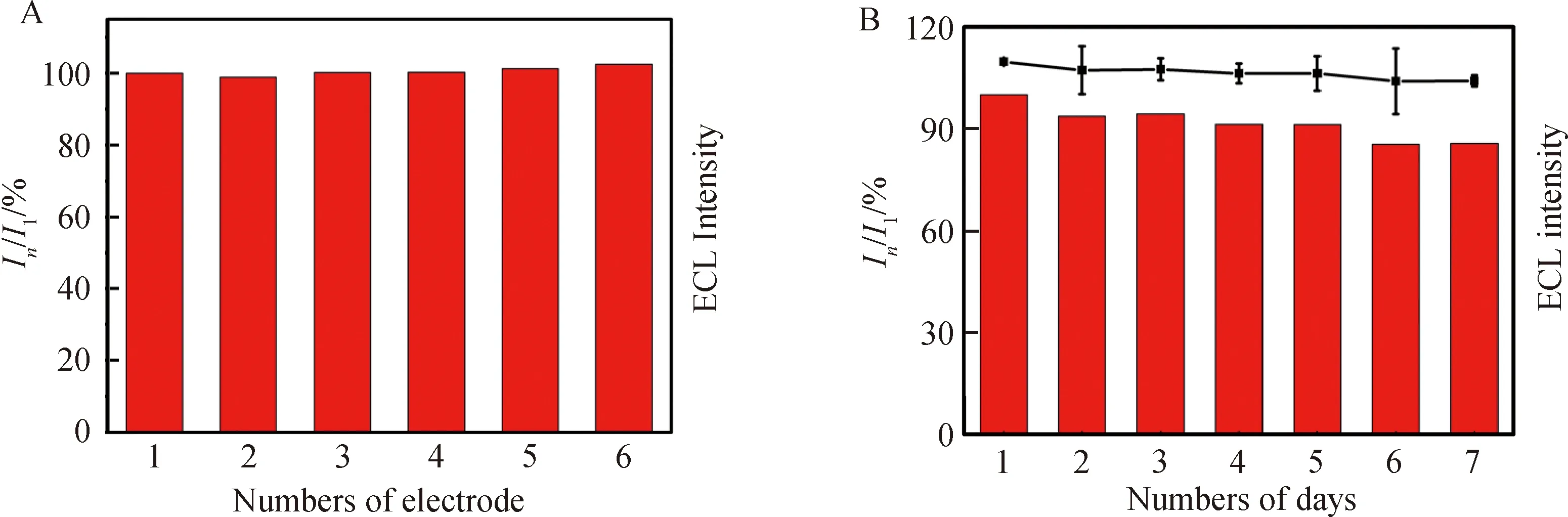
图7 (A)不同批次GSH-Au NCs 电极的ECL信号(In为不同批次电极的ECL强度);(B)GSH-Au NCs 电极放置7 d内的ECL信号变化(I1和In分别是第1天和第n天所测量的电极的ECL强度)
2.5 实际样品中Hg2+的检测选取自来水作为实际样品,进行加标回收实验,结果如表1所示,利用Hg2+对GSH-Au NCs的ECL信号的猝灭响应,所构建分析方法的回收率在97.7%~103.0%之间,RSD在1.7%~3.1%之间,这表明所构建的分析方法可用于自来水中Hg2+的检测,具有一定的实用价值.
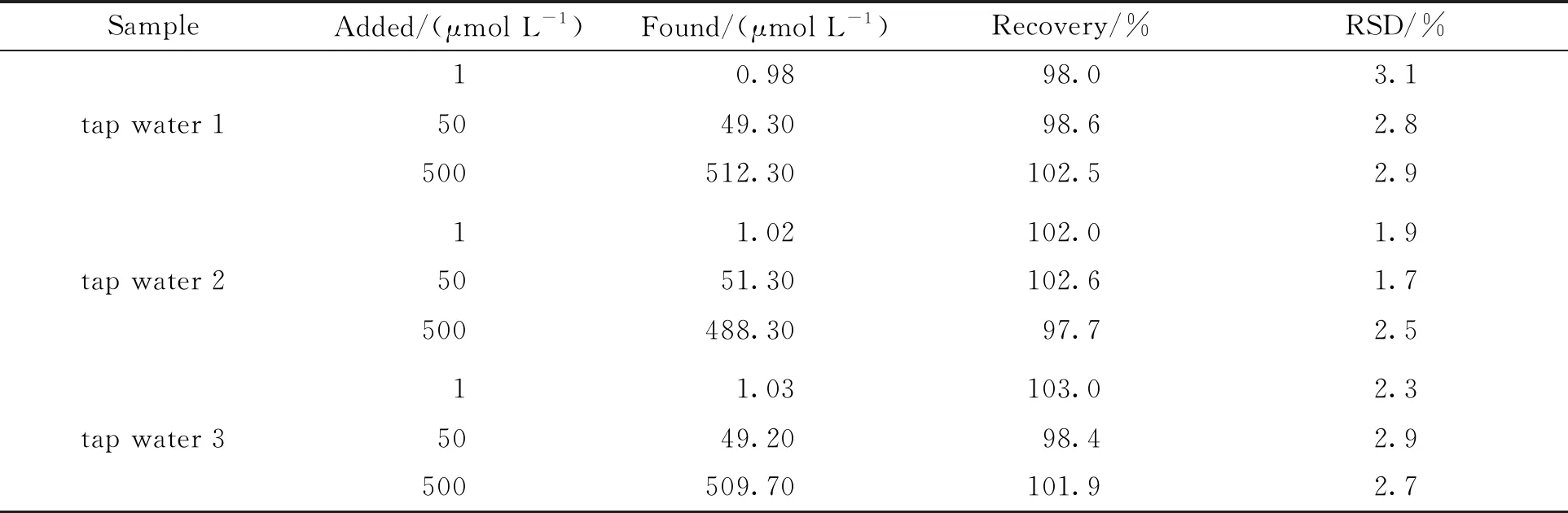
表1 自来水样中Hg2+的加标回收分析
3 结论
本研究合成了具有良好分散性、稳定性和电化学活性的GSH-Au NCs,将其修饰在电极表面,利用GSH-Au NCs的电化学发光性能,成功实现了对Hg2+的高灵敏、高选择性分析.在Hg2+存在条件下,由于Hg2+与Au NCs之间的亲金属相互作用,从而结合到GSH-Au NCs表面,破坏金纳米簇的组成,因而猝灭GSH-Au NCs电化学发光信号,GSH-Au NCs的ECL猝灭程度可以用于溶液中Hg2+的定量分析.该分析方法对Hg2+的检测范围为0.1~1 mmol/L,检测限为18 nmol/L(S/N=3),用于测自来水中的Hg2+,回收率在97.7%~103.0%之间,具有一定的实用价值.本文中所报道的方法与之前的方法相比,避免了复杂的合成步骤和标记修饰过程等缺点,简单方便,易于构建,成本低,同时具有较好的灵敏度和选择性,有望为环境监测中Hg2+的定量分析检测提供一条快速、简便的途径.
