ZIF-8 SQDs电化学发光传感器超灵敏检测miRNA-141研究
2022-09-07李婧雯戢凯伦陈苗苗张修华王升富
李婧雯,戢凯伦,陈苗苗,张修华,王升富
(湖北大学化学化工学院, 湖北 武汉 430062)
0 引言
miRNA-141作为miRNA-200家族中的一员,是一种具有22个核苷酸的内源性非编码RNA信号分子,可作用于不同靶点调控相应信号转导通路,进而参与细胞生长凋亡、新陈代谢等多种生命活动[1]. 研究表明,miRNAs-141的异常表达与多种癌症直接相关[2],如卵巢癌、乳腺癌、前列腺癌和胰腺癌等,可作为疾病标志物在癌症的早期诊断、预后及治疗中展现出巨大的应用潜力. 然而,由于miRNA-141的序列短、易降解,在生物体中的丰度低以及各种miRNA之间的高度相似性等特点[3],使得高灵敏和特异性地分析检测miRNA-141成为了一项极具挑战性的任务. 目前,电化学[4]、荧光[5]、光电化学[6]和电化学发光(ECL)[7]等多种分析方法实现了对miRNA-141的检测. 其中,ECL作为光谱法及电化学法相结合的一种技术[8],凭借其良好的可控性、超高的灵敏度以及较低的背景信号等优点在生物分析中受到了科研工作者的广泛关注.
硫量子点(SQDs)作为一类新兴发光硫纳米材料,具有优异的水分散性、低毒性、易于修饰及良好的生物活性等突出优势[9-10]. 然而,由于合成时间长、发光效率低且长期稳定性差的问题,限制了其在ECL方面的应用. 由无机金属节点与有机配体通过自组装相互连接而形成的金属有机框架(MOFs)多孔材料[11],不仅具有比表面积大,孔隙率高,晶格稳定,易于设计和合成等优点,且其内腔可以装载不同类型的功能纳米材料而表现出更为优异的性能,而被陆续开发并被广泛应用在光学、传感、气体吸附、催化等众多领域[12]. 基于此,将MOFs作为载体对SQDs进行封装,可以提升SQDs发光效率及长期稳定性,为拓宽SQDs在ECL中的分析应用提供思路.
信号放大作为实现目标物痕量检测的关键策略之一,如滚环扩增[13]、链置换扩增[14]、杂交链反应[15]等已被广泛用于生物传感器. 虽然这些信号放大策略可以显著提升低浓度目标物检测的灵敏度但仍然存在一些缺陷,包括重现性较差、易受环境影响、操作复杂等. 而催化发卡自组装(CHA)[16]是一种基于无酶等温DNA反应而进行信号扩增的一种策略,具有操作简便、成本低、放大效果好等优势,在核酸传感器的设计上发挥了重要的作用.
本研究结合CHA信号放大策略,采用ZIF-8作为基质对SQDs进行封装,通过链霉亲和素(SA)和生物素(Biotin)之间的特异性识别能力,将二茂铁(Fc)标记的发卡DNA H1修饰到电极上,构建了基于ZIF-8/SQDs纳米复合材料的ECL生物传感器用于miRNA-141的分析检测(图1). Fc与SQDs之间的能量转移可以猝灭传感器ECL信号,当目标物miRNA-141存在时,发卡DNA H1打开,Fc远离电极表面,使ECL信号恢复. 当修饰有Au NRs的发卡DNA H2与DNA H1碱基互补配对后,释放出miRNA-141进入循环,捕获更多的DNA H2-Au NRs,Au NRs不仅具有良好的导电性,还可作为SQDs的ECL共反应促进剂,进一步实现信号放大. 该传感器对miRNA-141具有良好的响应行为、出色的抗干扰性能以及长期稳定性,实现了miRNA-141高灵敏检测,拓宽了SQDs基的材料在ECL中的生物分析应用.
1 实验
1.1 实验试剂和仪器过硫酸钾(K2S2O8),六水合硝酸锌(Zn(NO)2·6H2O),二甲基咪唑(2-Methylimidazole),壳聚糖(CS),氢氧化钠(NaOH),升华硫粉(S),磷酸二氢钠(NaH2PO4·2H2O),磷酸氢二钾(K2HPO4·12H2O),硼氢化钠(NaBH4),氯金酸(HAuCl4·3H2O),十六烷基三甲基溴化铵(CTAB),四氯铂酸钾(II)(K2PtCl4),硝酸银(AgNO3),L-抗坏血酸(AA),聚乙二醇(PEG, Mn=400 Da)和6-巯基-1-己醇(MCH)购于上海阿拉丁科技股份有限公司. 本研究所涉及到的试剂均为分析纯,且未进一步纯化. 使用过程中的超纯水(18.25 MΩ·cm)由Ukpro水净化系统产生. 所用的DNA脱氧核糖核苷酸链与RNA核糖核苷酸链均由生工生物工程(上海)股份有限公司提供,具体序列如下:
MicroRNA-141∶5′-UAA CAC UGU CUG GUA AAG AUG G-3′
MicroRNA-21∶5′-UAG CUU AUC AGA CUG AUG UUG A-3′
MicroRNA -155∶5′-UUA AUG CUA AUC GUG AUA GGG GU-3′
三碱基错配目标物(3MT):5′-UAA CAC CGU CCG GCA AAG AUG G-3′
发卡DNA H1∶5′-Fc-ACT GTC TTT TCC ATC TTT ACC AGA CAG TGT TAT TTT-bition-3′
发卡DNA H2∶5′-SH-TAA CAC TGT CTG GTA AAG ATG GAA AAG ACA GT-3′
上述DNA均离心后溶解在Tris-HCl(pH=7.4)的缓冲溶液中,在4 ℃条件下冷藏保存.
电致化学发光检测仪:MIP-E型,西安瑞迈分析仪器有限公司;电化学工作站:CHI 660E,上海辰华分析仪器有限公司;紫外可见分光光度计:UV-2700,日本Shimadzu公司;荧光光谱仪:RF-5301PC,日本Shimadzu公司;透射电子显微镜:TecnaiTMG2F30,日本Shimadzu公司;扫描电子显微镜:S-4800,日本Hitachi公司;超声波清洗仪:Branson 2000,美国Branson公司.
1.2 SQDs的合成根据文献报道的合成方法合成SQDs[17]:三颈烧瓶中加入1.4 g升华硫粉与4.0 g NaOH,再将烧瓶密封抽出瓶中的空气并通入氧气,注入3.0 mL PEG(Mn=400 Da)和50 mL超纯水;将混合物在70 ℃下搅拌反应,溶液由深黄色逐渐变为淡黄色,反应10 h后将得到的SQDs进行透析,冷冻干燥后冷藏避光保存备用.
1.3 ZIF-8/SQDs的合成取一定量SQDs粉末加入20 mL的Zn(NO)2·6H2O(0.897 0 mmol)水溶液中,超声30 min混合均匀,再加入20 mL的2-甲基咪唑(7.904 mmol)水溶液,常温搅拌24 h后离心,分别用水和乙醇洗涤多次,获得的白色沉淀即为ZIF-8与SQDs的复合物,产物在60 ℃下真空干燥后密封保存[18].
1.4 Au NRs的合成将CTAB(7.5 mL, 0.1 mol/L)与HAuCl4(100 μL, 24 mmol/L)混合均匀后用超纯水稀释至9.4 mL,磁力搅拌均匀,加入新制的NaBH4(0.6 mL, 0.0 125 mol/L),溶液的颜色立即由鲜黄色变成棕色;取120 μL溶液加入到CTAB(100 mL, 0.1 mol/L)、HAuCl4(2.04 mL, 2 4 mmol/L)、AgNO3(1.05 mL, 10 mmol/L)和AA(480 μL, 0.1 mol/L)的混合溶液中,搅拌3 min,37 ℃条件下静置反应12 h. 取上清液分离纯化后,将得到的Au NRs分散于去离子水中4 ℃下保存[19].
1.5 ECL生物传感器的制备玻碳电极(GCE)用氧化铝粉末打磨、抛光,再依次用超纯水、乙醇、超纯水超声处理. 先将2%的壳聚糖溶液与ZIF-8/SQDs混合均匀后取10 μL修饰于干燥后的电极表面,接着取10 μL链霉亲和素(1 mg/mL)固定到电极表面,再将10 μL退火处理后的发卡DNA H1滴涂于电极表面,室温下培养1 h后用缓冲溶液冲洗,用10 μL 1 mmol/L的MCH对电极培养45 min进行封闭处理,再用缓冲溶液进行适当冲洗备用.
1.6 miRNA-141的电化学发光检测电极置于含有不同浓度目标物miRNA-141的溶液中培养1 h,再将其浸泡在预先混合搅拌24 h的DNA H2-Au NRs溶液中培养2 h后进行ECL测试.电化学发光检测采用以修饰电极为工作电极,银/氯化银电极为参比电极,铂丝为辅助电极的三电极体系,光电倍增管高压设置为800 V,电位扫描范围:0 ~ -1.9 V,扫描速率:100 mV/s. 电解液含有为0.1 mol/L K2S2O8的0.1 mol/L PBS(pH=7.4).
2 结果与讨论
2.1 Au NRs的形貌表征采用扫描电子显微镜(SEM)和透射电子显微镜(TEM)对合成的Au NRs的外观形貌及尺寸大小进行表征. 由图2(A)和(B)可清晰地观察到制备的Au NRs为立体棒状结构,尺寸均一、分散性较好. 通过粒径统计可知金棒的长度为(45.4±5)nm,直径为(7.5±1) nm(图2(C, D)),与文献报道相似[20].
2.2 ZIF-8/SQDs的形貌结构表征ZIF-8/SQDs的SEM图谱可观察到其为多边形状(图3(A)). 进一步对其进行TEM及高分辨TEM(HRTEM)表征,由图3(B)可知合成的ZIF-8/SQDs边界清晰,呈现出清晰的十二面体方钠石结构,尺寸较均一,平均粒径约为200 nm. 此外,在HRTEM图(图3(C))中捕获到大量的SQDs粒子,表明SQDs被成功包埋在ZIF-8腔体内部且未对其形貌结构产生影响.
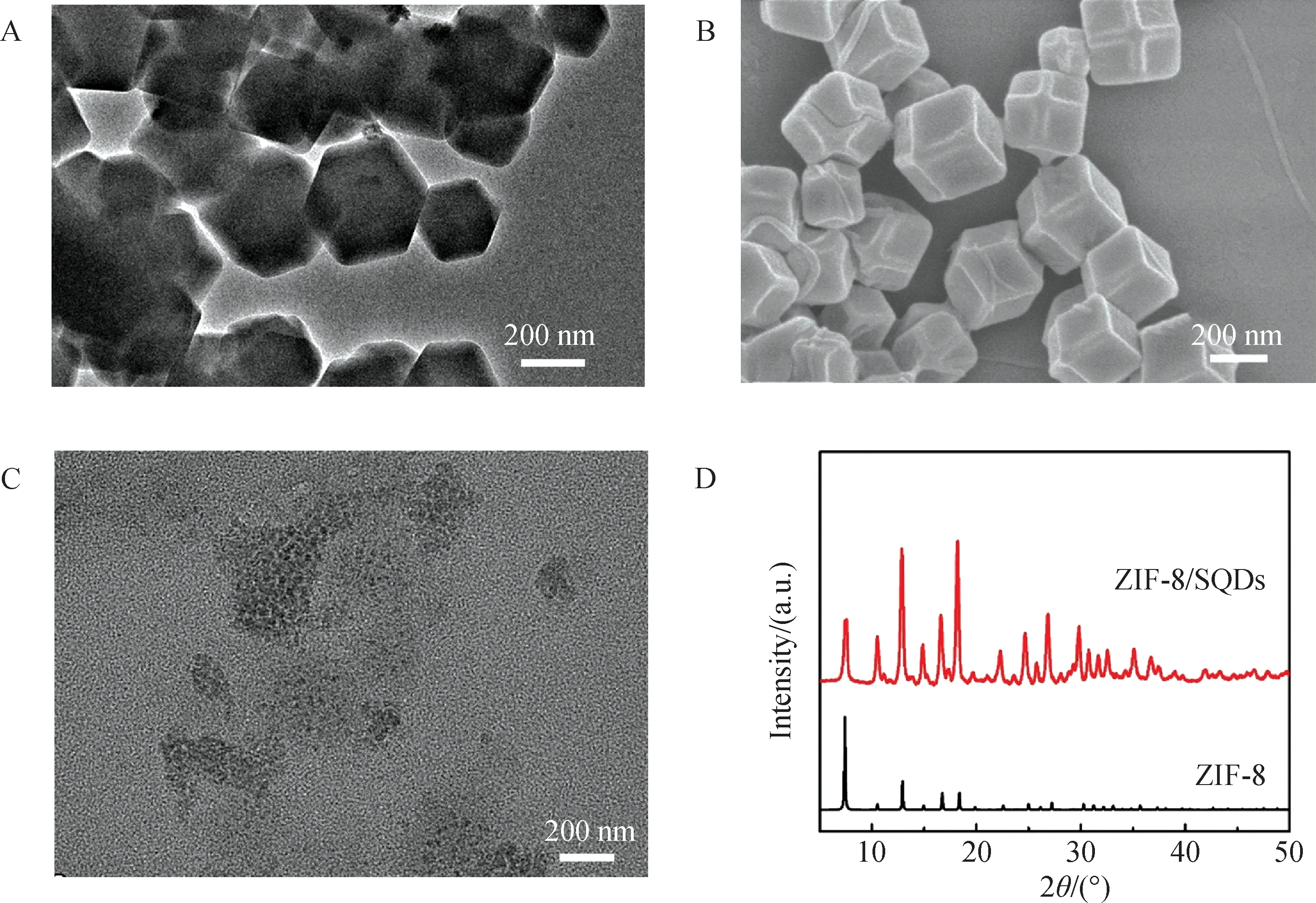
图3 SQDs/ZIF-8的扫描电镜图(A);透射电镜图(B)及高分辨透射电镜图(C);ZIF-8/SQDs和ZIF-8的X线衍射图谱(D)
采用X线衍射(XRD)表征技术对合成的ZIF-8/SQDs进行结构表征. 结果如图3(D)所示,与ZIF-8的标准卡片峰进行对比,可发现ZIF-8/SQDs的XRD图谱与标准图谱中特征峰基本重叠,表明了ZIF-8/SQDs的与ZIF-8的晶体结构基本一致,结晶度较高.
2.3 ZIF-8/SQDs的光谱行为表征采用紫外吸收光谱和荧光光谱对ZIF-8/SQDs的光谱性质进行了表征研究,由图可以看出纯SQDs分别在220 nm与270 nm处存在紫外吸收(图4(A)),ZIF-8仅在210 nm处存在紫外吸收(图4(B)),ZIF-8/SQDs在210 nm及270 nm附近的两个吸收分别应该分别来自于ZIF-8、SQDs的特征吸收峰(图4(C)).
图4(D)为SQDs、ZIF-8及ZIF-8/SQDs的荧光光谱图. 由图可知,SQDs在460 nm处存在明显的发射峰. 纯ZIF-8几乎没有荧光发射,仅在440 nm、527 nm和570 nm处存在微弱的锯齿状小尖峰. 当SQDs与ZIF-8复合后,不仅能观察到460 nm处来自SQDs的发射峰,也同样在440 nm、527 nm和570 nm处存在来源于ZIF-8的齿状峰. 光谱表征结果表明所合成的材料为ZIF-8/SQDs复合物.
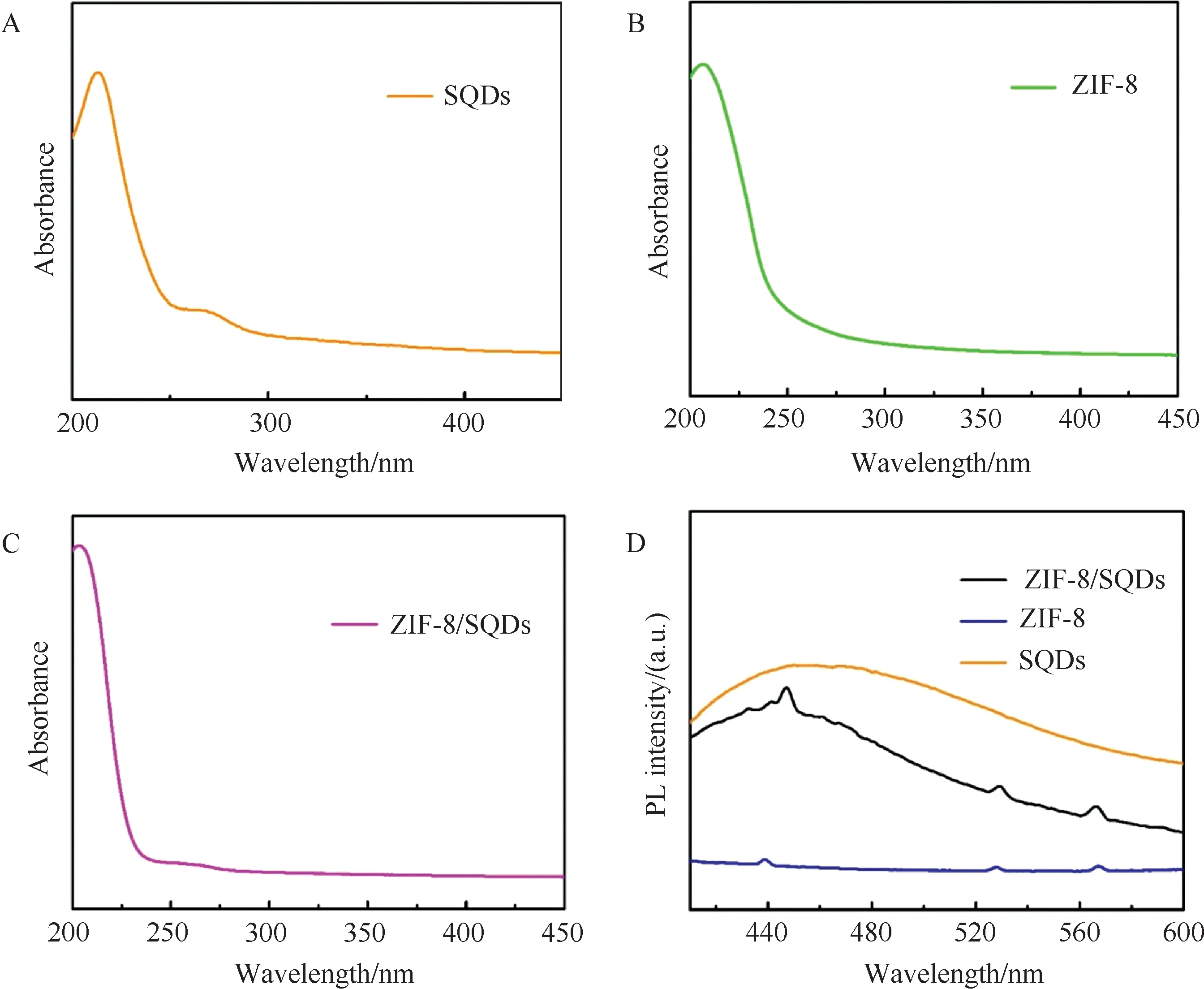
图4 (A)SQDs;(B)ZIF-8;(C)ZIF-8/SQDs的紫外吸收光谱图;(D)SQDs,ZIF-8和ZIF-8/SQDs的荧光光谱图
2.4 传感器对miRNA-141的识别与条件优化如图5(A)所示,当无目标物miRNA-141时,电极表面的二茂铁(Fc)可通过能量转移的形式猝灭SQDs的ECL信号. 而存在目标物miRNA-141时,发卡DNA-H1得以打开,此时Fc远离电极表面,其猝灭作用降低;进一步DNA H2-Au NRs与DNA-H1通过互补碱基配对而被DNA-H1捕获,使得Au NRs靠近电极表面可作为SQDs的共反应促进剂,二者的协同作用大大增强了SQDs的ECL信号.
对Au NRs-DNA H2的培养时间进行了优化. 由图5(B)可知,随着时间的增加,通过催化发卡自组装到电极表面的Au NRs-DNA H2的量也更多,Au NRs不仅具有良好的导电性,还能作为共反应促进剂使共反应剂过硫酸根更易得到电子,对应的ECL信号也逐渐增大. 当培养时间为2 h时,ECL信号达到了平台,因此选择2 h作为Au NRs-DNA H2的培养时间.
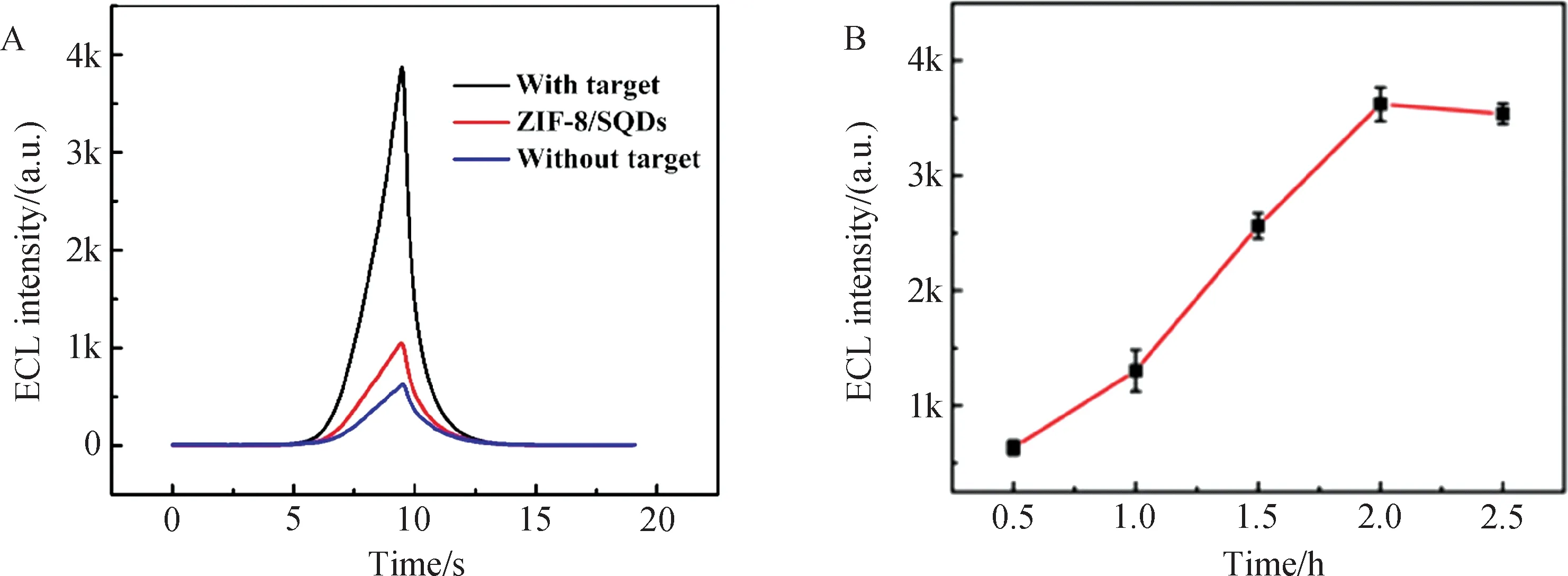
图5 (A)ECL传感器的可行性分析;(B)Au NRs-DNA H2培养时间的优化
2.5 miRNA-141的ECL测定考察了ZIF-8/SQDs ECL生物传感器对miRNA-141分析检测效果. 如图6(A)所示,随着miRNA-141浓度的增加,发夹DNA H1被打开的越多,随之能结合至电极表面的Au NRs-DNA H2也更多,检测到的ECL信号因此增强. 对数据进行拟合,ECL的响应值与miRNA-141浓度的对数在10 fmol/L至1 nmol/L的范围内呈现良好的线性相关(图6(B)),其线性回归方程为I=3 215.3 + 1 048.9 lgc(pmol/L)(R2=0.997 8),检测限(LOD)低至0.86 fmol/L(S/N=3).
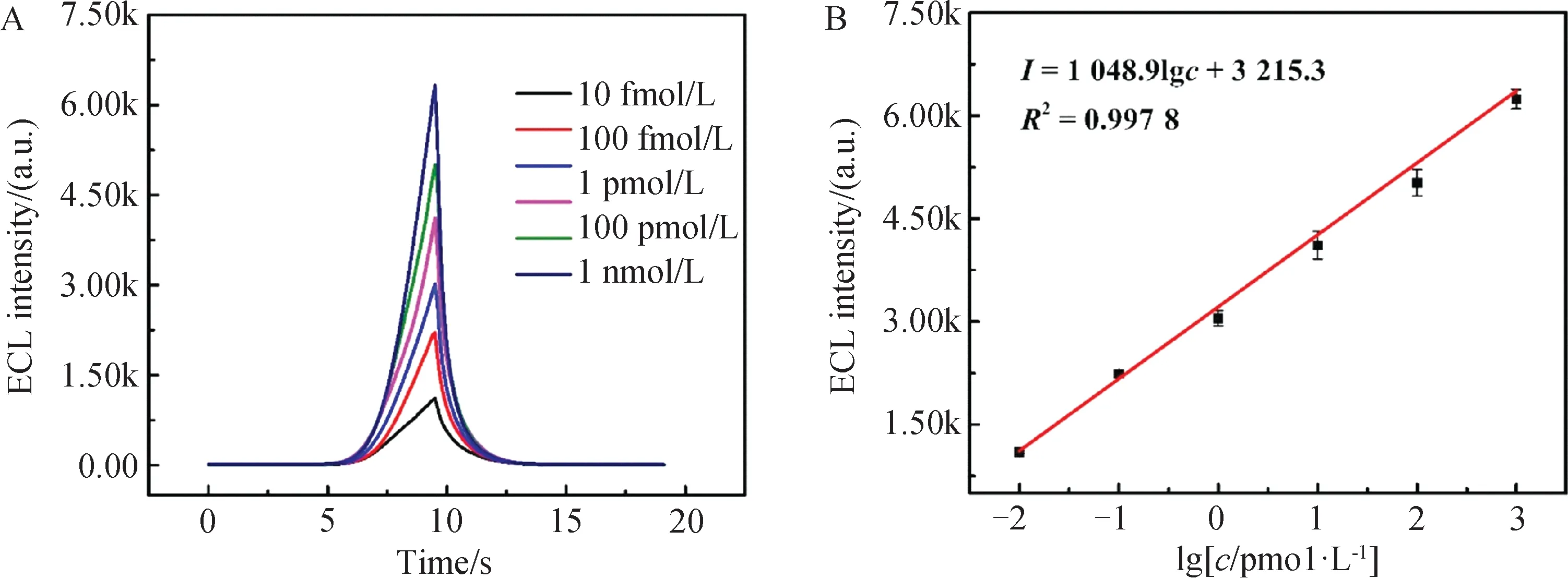
图6 (A)不同浓度miRNA-141的ECL信号;(B)miRNA-141的标准曲线
以浓度100倍于miRNA-141的干扰物,如miRNA-155、miRNA-21和3碱基错配的miRNA-141′(3MT),对构建的ECL生物传感器选择性和抗干扰的能力进行了研究. 由图7(A)可知,上述3种干扰物单独存在时ECL响应都较低,而miRNA-141与各种干扰物的混合液对应的ECL信号与其单独存在时的ECL信号相当,表明该传感器对miRNA-141的检测具有良好的选择性和优异的抗干扰能力.
分别使用9支不同批次的电极对同一浓度的目标物进行平行检测,由图7(B)可知,其相对标准偏差(RSD)为1.1%,表明该传感器具有较好的重现性. 此外,如图7(C)所示,在相同的参数条件下连续13次循环扫描,ECL的信号几乎没有波动,RSD为1.9%,表明其也具有良好的稳定性.
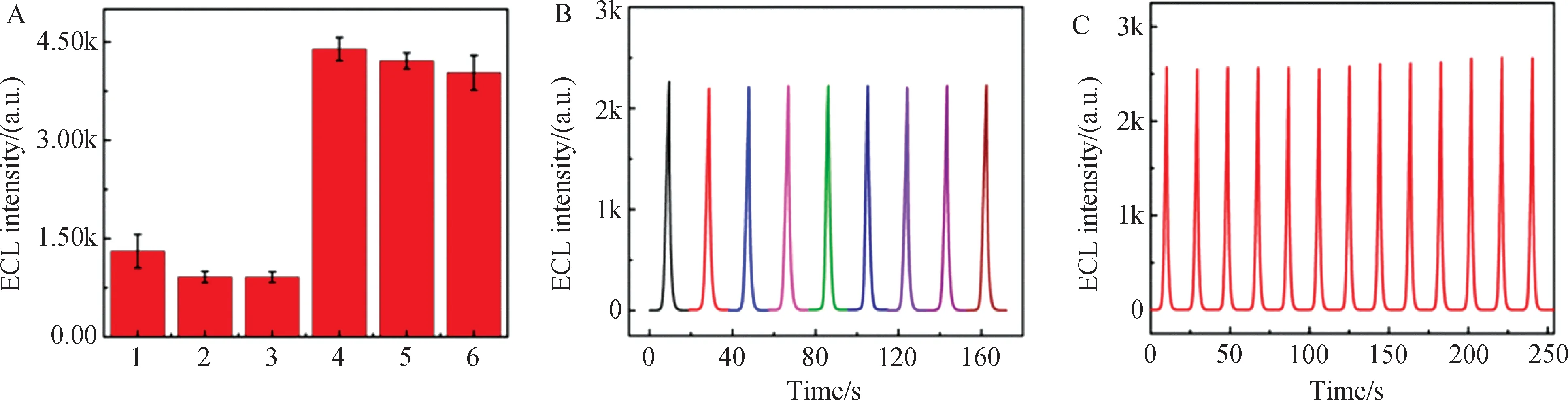
图7 (A)传感器的选择性:1∶3MT,2:miRNA-155,3:miRNA-21,4:miRNA-141+3MT,5:miRNA-141+miRNA-155,6:miRNA-141+miRNA-21;(B)传感器的重现性;(C)传感器的稳定性
3 结论
本研究采用自上而下的方法成功合成了具有蓝色荧光的SQDs,并利用比表面积大、孔隙率高的金属有机框架ZIF-8对其进行封装,构建了以ZIF-8/SQDs作为发光体,结合催化发夹自组装信号放大策略的ECL生物传感器用于疾病标志物miRNA-141的分析检测. DNA标记的Fc与SQDs之间的能量转移导致ECL信号猝灭,当修饰有Au NRs的发卡DNA H2与DNA H1碱基互补配对后,释放出miRNA-141进入循环,实现信号放大. Au NRs具有良好的导电性,并可作为SQDs的ECL共反应促进剂,进而达到超灵敏定量miRNA-141的目的. 该传感器具有良好的选择性和重现性、以及较强的抗干扰能力. 本研究为探索基于SQDs高效可靠的ECL生物传感平台提供了新的思路,对疾病标志物miRNA-141的分析具有一定的潜力.
