线粒体分裂蛋白1在人宫颈癌细胞中过表达能促进线粒体裂变并降低细胞的增殖和迁移能力
2022-09-07李星宇薛春源房廖鑫亢小峰朱俊闻杜祎萌徐小洁
丛 瑞, 李星宇, 霍 楠, 朱 祥, 薛春源, 房廖鑫, 亢小峰, 朱俊闻,杜祎萌, 徐小洁
(军事科学院军事医学研究院生物工程研究所, 北京 100850)
宫颈癌目前仍然是女性最常见的癌症之一,也是女性癌症死亡的主要原因。在我国,宫颈癌在年轻女性中的发病率和死亡率呈显著上升趋势[1]。宫颈癌已成为我国15至44岁女性第2大常见癌症和第3大癌症死亡原因[2]。线粒体分裂蛋白1(mitochondrial fission protein 1, FIS1)是调控线粒体裂变的分子之一,也是目前已知的调控线粒体裂变的关键蛋白质——动力相关蛋白1(dynamin related protein 1, DRP1)唯一的募集分子[3]。FIS1位于线粒体外膜上,具有2个TPR基序,通过相互作用结构域与DRP1结合[4]。FIS1在过表达时能够促进线粒体裂变,并且与许多依赖线粒体裂变的过程相关,例如细胞凋亡和自噬[5]。近年来有研究发现,FIS1在接受顺铂治疗的舌鳞状细胞癌(tongue squamous cell carcinoma, TSCC)细胞中表达上调,且敲低FIS1能够降低TSCC细胞对顺铂的敏感性[6]。另外,FIS1基因的缺失会导致乳腺癌细胞对放射的敏感性减弱[7]。本研究通过生物信息学分析及细胞实验,研究了FIS1在人宫颈癌中的表达及其对宫颈癌细胞系HeLa细胞的线粒体形态及功能的影响,为进一步研究FIS1在人宫颈癌中的具体机制奠定了基础。
1 材料与方法
1.1 材料
人卵巢文库、pCMV-Tag-2B质粒、人宫颈癌HeLa细胞来自于本实验室保存,限制性核酸内切酶BamHⅠ和XhoⅠ、PCR试剂、DNA连接酶(TaKaRa公司);质粒抽提试剂盒、DNA胶回收试剂盒(Tsingke公司);VigoFect转染试剂(威格拉斯生物技术有限公司);DMEM培养基(Gibco公司);胎牛血清(浙江天杭生物科技有限公司);线粒体荧光探针mitotracker(Invitrogen);ROS荧光探针(威格拉斯生物技术有限公司);引物由北京博迈德科技发展有限公司合成,基因测序由北京博迈德科技发展有限公司完成。
1.2 数据获取
基于癌症基因组图谱(The Cancer Genome Atlas,TCGA)数据库(https://tnmplot.com)下载人宫颈癌数据的转录物组信息及临床信息。
1.3 基因表达分析
对于癌症基因组图谱(TCGA)数据库的宫颈癌病人数据,可从TNMplot网站下载肿瘤及癌旁组织的RNA-seq数据。使用R软件v4.0.3进行统计分析[8]。P值<0.05被认为具有统计学意义。
1.4 组织蛋白质提取及Western印迹检测组织中相关蛋白质的表达
按照RIPA(强)试剂盒说明书提取宫颈癌组织及相应癌旁组织的蛋白质,经BCA蛋白质定量后利用Western印迹检测FIS1在蛋白质水平的表达情况。样品中加入与RIPA等量的2×SDS上样缓冲液,煮沸15 min。将煮好后的样品12 000 r/min离心2 min后,取上清进行SDS-PAGE。电泳分离样品经湿转法转移至硝酸纤维素膜上,将膜用5%的脱脂奶粉在常温下封闭1 h,用5%脱脂奶粉以1∶500稀释FIS1抗体,在室温下孵育1.5 h,用TBST洗膜3次,每次浸泡5 min,分别加HRP标记的抗兔二抗(1∶1 000),室温孵育1 h,TBST洗膜3次,每次浸泡5 min。用化学发光法进行显影。
1.5 基于线粒体分裂蛋白1表达量的差异基因分析
使用R软件的Limma软件包(版本3.40.2)研究mRNA差异表达[9-11]。在TCGA或GTEx中分析了调整后P值以纠正假阳性结果。“AdjustedP<0.05且log2(倍数变化)> 1或log2(倍数变化)<-1”被定义为阈值mRNA差异表达的筛选。取宫颈癌病人的FIS1表达水平中位数为划分标准,采用中位法将表达水平高于中位数的病人划分为高表达组,将表达水平低于中位数的病人划分为低表达组。功能富集:为了进一步确认潜在目标的潜在功能,通过功能丰富对数据进行了分析。基因本体论(GO)是一种广泛使用的工具,用于注释具有功能的基因,尤其是分子功能(MF),生物途径(BP)和细胞成分(CC)。KEGG富集分析是实用的可用于分析基因功能以及相关的高级基因组功能信息。为了更好地了解目标基因的致癌作用,R中的ClusterProfiler程序包被用于分析潜在mRNA的GO功能并丰富KEGG途径[12-14]。
1.6 pCMV-Tag-2B-FIS1表达载体的构建
以人卵巢文库为模板,根据NCBI数据库中FIS1基因序列合成引物。上游引物:5′-CGGGATC CATGGAGGCCGTGCTGAAC-3′;下游引物:5′-CCCAAGCTTTCAGGATTTGGACTTGGACACAGC-3′。按照95 ℃预变性5 min,95 ℃变性30 s,58 ℃退火30 s,72 ℃延伸30 s,30个循环,72 ℃ 7 min延伸的条件PCR扩增FIS1基因,产物于4 ℃保存。将PCR扩增的产物进行琼脂糖凝胶电泳,利用胶回收试剂盒回收PCR产物。用BamH?和Xho?在37 ℃,4 h的条件下,双酶切胶回收产物以及pCMV-Tag-2B质粒。将双酶切后的目的基因过柱纯化回收;将双酶切后的质粒进行琼脂糖凝胶电泳,胶回收双酶切后的质粒。将FIS1基因与pCMV-Tag-2B质粒利用T4DNA连接酶在16 ℃过夜的条件下进行连接。将连接产物转化感受态大肠杆菌细胞,将转化后的细胞扩增后置于固体培养基上培养。挑选克隆进行扩增,用扩增后的菌液进行菌液PCR,用BamHⅠ和XhoⅠ双酶切鉴定,选取阳性的菌液扩增并提取质粒。对酶切鉴定结果阳性的克隆进一步测序鉴定。
1.7 pCMV-Tag-2B-FIS1功能突变体的构建
FIS1分子包含6个α螺旋,对α螺旋进行定点突变(亮氨酸突变为脯氨酸,leucine-to-proline, L-to-P)可使FIS1与Drp1的结合发生障碍,从而使FIS1产生功能缺失。本研究中,将FIS1分子中位于α1螺旋的第14位亮氨酸和位于α6螺旋的第110位亮氨酸均突变为脯氨酸,从而获得功能缺失性FIS1突变体(FIS1 L14P/L110P)[15]。以所构建的pCMV-Tag-2B-FIS1表达载体为模板,利用快速定点突变试剂盒(天根生化科技)进行pCMV-Tag-2B-FIS1突变体的构建。依据试剂盒说明书进行突变引物的构建。第14位亮氨酸突变引物,上游引物:5′-CTGGTGTCTGTGGAGGACCCGCTGAAGTTTGAA-3′;下游引物:5′-GGGTCCTCCACAGACACCAGCTCGTT CAGCAC-3′。第110位亮氨酸突变引物,上游引物:5′-AACAACCAGGCCAAGGAACCGGAGCGGCTCATT-3′;下游引物:5′-GGTTCCTTGGCCTGGTTG TTCTGGG GCTCTGT-3′。按照95 ℃预变性2 min,94 ℃变性20 s,55 ℃退火10 s,68 ℃延伸2.5 min,25个循环,68 ℃补充延伸5 min的条件进行PCR扩增。扩增后所得到的PCR产物利用DpnⅠ限制性内切酶进行消化,在37 ℃消化1 h。最终所得消化产物转化感受态细胞。将转化后的细胞扩增后,置于固体培养基上培养,并挑选克隆进行扩增。最后,利用扩增后的菌液进行质粒提取,并将提取所得质粒进行测序鉴定。
1.8 细胞转染和免疫荧光检测
pCMV-Tag-2B空载体、pCMV-Tag-2B-FIS1质粒以及pCMV-Tag-2B-FIS1(L14P/L110P)质粒,均采用相同的转染方法对HeLa细胞进行转染。将HeLa细胞接种于6孔板中,用含有双抗及10%胎牛血清的DMEM培养基在CO2培养箱中培养,在细胞密度约为60%~70%时进行转染。转染前1 h,更换细胞的培养基。将2 μL的VigoFect与100 μL生理盐水混匀,静置5 min。将5 μg质粒与100 μL的生理盐水混合。最后,上述配制好的转染试剂与混匀的质粒混合,室温静置15 min。随后,加入对应的细胞培养皿中。在CO2培养箱中培养6 h后更换培养基,随后继续培养24 h。
转染完成后,利用4%多聚甲醛溶液在室温下固定细胞30 min,再利用PBS漂洗细胞3次,每次5 min。漂洗后,利用细胞透化液(0.5% Triton-100 + 1% NGS的PBS溶液)在冰上对细胞进行透化10 min,再利用1% NGS PBS溶液对细胞进行室温封闭30 min。封闭完成后,以1∶500的比例稀释αR-Flag抗体。利用稀释后的αR-Flag抗体溶液对细胞进行4 ℃过夜孵育。最后,在避光条件下,利用αR-FITC二抗以及DAPI依次对细胞进行染色。染色后,在荧光显微镜下观察细胞并拍照。
1.9 Western印迹检测
待测细胞弃去培养基后,用PBS清洗。向细胞中加入胰酶并在37 ℃消化2 min,再加入PBS吹打消化后的细胞,并将细胞悬浮液收集于离心管中。将细胞悬浮液在4 ℃下,于3 000 r/min离心3 min,弃上清,随后加入3倍于细胞体积的RIPA裂解细胞,冰浴30 min,再加入与RIPA等量2×SDS上样缓冲液,煮沸15 min。将煮好的样品12 000 r/min离心2 min,并取上清进行SDS-PAGE。电泳分离样品,经湿转法转移至硝酸纤维素膜上,将膜用5%脱脂奶粉在常温下封闭1 h,用5%脱脂奶粉以1∶1000稀释Flag标签的单克隆抗体,在室温下孵育1 h,用TBST洗膜3次,每次浸泡5 min。用化学发光法进行显影。
1.10 细胞生长曲线分析
pCMV-Tag-2B-FIS1质粒、pCMV-Tag-2B-FIS1-L14P/L110P质粒与pCMV-Tag-2B空质粒分别转染HeLa细胞24 h。以细胞3 000个/孔的密度接种于96孔板,每组设3个复孔,在第0、1、2、3、4 d,每日的同一时间,加入10 μL的CCK8与90 μL的培养基孵育1 h,用酶标仪检测波长450 nm的吸光度。以培养时间为横轴,平均吸光度值为纵轴绘制生长曲线。
1.11 划痕实验检测细胞的迁移能力
在6孔板背面用马克笔均匀划横线,将HeLa细胞用胰酶消化并用计数板计数。以5×105个细胞/孔的密度接种于6孔板中,置于37 ℃,5%CO2培养箱中培养;待第2 d细胞生长至密度80%~90%时,用200 μL枪头在6孔板中划垂直于背面横线的竖线,用PBS洗3次,洗去划痕所产生的细胞碎片,并加入无血清的DMEM培养基,倒置显微镜观察并进行第1次拍照。继续培养48 h,在相同位置再次拍照。
1.12 线粒体探针染色
将转染pCMV-Tag-2B-FIS1质粒和pCMV-Tag-2B空质粒的人宫颈癌HeLa细胞接种于共聚焦小皿中,37 ℃孵箱培养24 h。细胞贴壁后,弃去小皿中的培养基,用无血清的培养基清洗3次;将Mitotracker Green探针用无血清培养基按照1∶500的比例稀释,每个小皿中加入500 μL的稀释液,37 ℃孵箱内避光孵育30 min。染色结束,用无血清的培养基清洗细胞3次,再加入500 μL无血清培养基保持细胞活性,使用激光共聚焦显微镜进行拍照,使用Image J软件对线粒体连接度进行统计[16]。
1.13 ROS探针流式检测
转染pCMV-Tag-2B-FIS1质粒和pCMV-Tag-2B空质粒的人宫颈癌HeLa细胞用胰酶消化,并用1 mL无血清培养基重悬,再用无血清培养基清洗3次。将ROS探针按1∶1 000的比例用无血清培养基稀释,用稀释液重悬细胞,37 ℃避光孵育20 min。染色结束用无血清的培养基清洗细胞3次,随后再加入500 μL无血清培养基重悬细胞,进行细胞流式检测。
1.14 统计学方法
使用R软件处理数据,采用t检验和重复测量资料的方差分析比较两组数据,P<0.05认为差异具有统计学意义。
2 结果
2.1 FIS1在宫颈癌组织中的表达低于正常组织
本研究基于癌症基因组图谱(TCGA)数据库(https://tnmplot.com),下载了189例宫颈癌组织,以及56例癌旁组织转录物组数据。通过分析发现,与正常组织相比,宫颈癌组织中FIS1低表达(P<0.05)(Fig.1A)。本研究进一步对5对宫颈癌组织以及癌旁组织临床标本进行了FIS1在蛋白质水平表达的检测。由Western印迹结果(Fig.1B)可见,相较于癌旁组织,宫颈癌组织中FIS1在蛋白质水平的表达显著降低(P< 0.05)。FIS1在宫颈癌组织与正常组织中表达水平差异提示,宫颈癌的发生与FIS1分子的生物学功能异常存在相关性。据此推测,FIS1分子在宫颈癌中发挥一定的作用,对于FIS1功能的研究有助于为宫颈癌治疗提供新的治疗靶点。

Fig.1 The relationship between FIS1 expression and clinical characteristics in cervical cancer tissues in the TCGA dataset (A) The expression distribution of the FIS1 gene in tumor tissues and normal tissues, where the horizontal axis represents different groups of samples, the vertical axis represents the gene expression distribution, and different colors represent different groups. Statistical analyses were performed using R software v4.0.3 (Wilcox. tests), * P<0.05. (B) Western blotting was used to detect the expression of the FIS1 protein in cervical cancer and adjacent tissues. T: cervical cancer tissue; N: paracancer tissue. Quantitative analysis was performed using Image J. Compared with adjacent tissues, the expression of FIS1 protein in cervical cancer tissues was significantly reduced, * P<0.05
2.2 不同FIS1表达水平的差异基因分析显示线粒体功能相关通路富集较为广泛
根据TCGA数据中所有宫颈癌组织的FIS1基因的表达水平取中位数,以中位数为标准将病人划分为高表达组和低表达组。高于中位数的为高表达组,低于中位数的为低表达组,将两组进行差异基因分析,筛选与FIS1相关的差异基因。结果显示,与低表达组相比,高表达组上调基因105个,下调基因8个(Fig.2A)。为进一步研究FIS1高表达组与低表达组之间差异基因所参与的生物学通路进程,本研究进一步对113个差异基因进行GO Terms及KEGG通路富集分析。将前20个GO Terms中生物过程(biological process,BP)通路及KEGG通路绘制图形,发现过氧化物酶体增殖物激活受体(peroxisome proliferators-activated receptors, PPARs)信号通路、肽酶的活性调节等调节线粒体功能相关通路富集较为广泛,说明FIS1可能影响细胞线粒体(Fig.2B)。
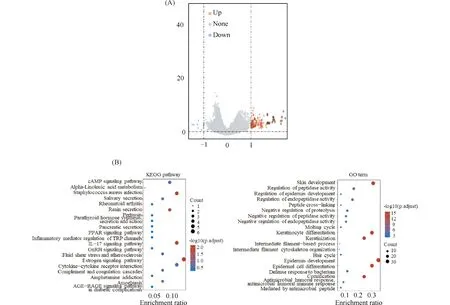
Fig.2 Analysis of differential genes in high-expression and low-expression FIS1 groups (A) Differential genes between the high-expression and low-expression FIS1 groups. Volcano plots were constructed using fold-change values and adjusted P. The red points in the plot represent the over-expressed mRNAs and the blue points indicate the down-expressed mRNAs with statistical significance. RNA-sequencing expression (level 3) profiles and corresponding clinical information for cervical cancer tumors were downloaded from the TCGA dataset. Using the limma package in the R software to study the differentially expressed mRNA. “Adjusted P < 0.05 and Log2 (Fold Change) >1 or Log2 (Fold Change)< -1” were defined as the threshold for the differential expression of mRNAs. (B) KEGG pathway and GO Term-BP pathway enrichment results of differentially expressed genes between high and low FIS1 expression groups. The enriched KEGG signaling pathways were selected to demonstrate the primary biological actions of major potential mRNA. The abscissa indicates the gene ratio and the enriched pathways were presented in the ordinate. Gene ontology (GO) analysis of potential targets of mRNAs. The biological process (BP), cellular component (CC), and molecular function (MF) of potential targets were clustered based on ClusterProfiler package in R software (version: 3.18.0). In the enrichment result, *P<0.05 or FDR <0.05 is considered to be enriched to a meaningful pathway
2.3 FIS1以及FIS1-L14P/L110P在HeLa细胞中的表达定位
以本室保存的人卵巢文库为模板,利用PCR扩增人FIS1基因CDS序列,获得约459 bp的DNA片段,与预期的大小一致。将BamHⅠ和XhoⅠ双酶切后的PCR产物和pCMV-Tag-2B质粒连接,转化感受态细胞,挑克隆进行菌液PCR,得到与目的条带459 bp大小相近的克隆,初步认为是带有人FIS1基因的阳性重组克隆。将阳性克隆扩增后提取质粒,进行双酶切鉴定,可得到2个条带,长度分别约为4 000 bp和459 bp。相应的空质粒经酶切后只有1个条带,表明FIS1基因成功插入pCMV-Tag-2B质粒获得重组质粒pCMV-Tag-2B-FIS1。DNA测序结果表明,插入的DNA序列与人FIS1基因的编码序列完全一致。以pCMV-Tag-2B为模板,进一步利用定点突变技术构建第14位亮氨酸突变为脯氨酸(L14P),以及第110位亮氨酸突变为脯氨酸(L110P)的FIS1突变体质粒的pCMV-Tag-2B-FIS1-L14P/L110P。
利用重组质粒pCMV-Tag-2B-FIS1、突变体质粒pCMV-Tag-2B-FIS1(L14P/L110P),以及空载体pCMV-Tag-2B分别转染HeLa细胞,继续培养24 h后,提取细胞内的蛋白质进行SDS-PAGE。利用Western 印迹检测pCMV-Tag-2B-FIS1和pCMV-Tag-2B-FIS1(L14P/L110P)2种质粒的表达情况。结果显示,转染质粒后,2种质粒均可在HeLa细胞中正确表达,使用Flag-HRP抗体能够在相对分子质量约18 kD处检测到特异性条带,而转染空载体的无条带(Fig.3A)。FIS1是定位于线粒体外膜的跨膜蛋白质[17],其尾部锚定于线粒体外膜而由α螺旋所组成的膜外部分位于细胞胞浆内[18]。本研究利用重组质粒pCMV-Tag-2B-FIS1以及突变体表达质粒pCMV-Tag-2B-FIS1(L14P/L110P)分别对HeLa细胞进行转染。免疫荧光染色后可见(Fig.3B),pCMV-Tag2B-FIS1质粒所表达的FIS1蛋白在细胞质内以点分布为主,提示其锚定于线粒体膜的分布形态以及促进线粒体裂变的生物学功能。而pCMV-Tag-2B-FIS1 (L14P/L110P)质粒所表达的突变型FIS1-L14P/L110P蛋白,在细胞中呈现连接度略显提高的短棒状以及较大的团块状分布,提示FIS1-L14P/L110P锚定于线粒体膜上,且由于其功能缺失因而细胞内线粒体裂变程度弱于过表达FIS1的细胞样本。本结果与已发表的研究结论一致,证明FIS1分子位于细胞胞浆内膜外部分在其介导线粒体裂变的生物学功能中发挥重要作用,FIS1-L14P/L110P的胞浆内α螺旋发生突变可导致功能缺失而其尾部仍锚定于线粒体外膜。
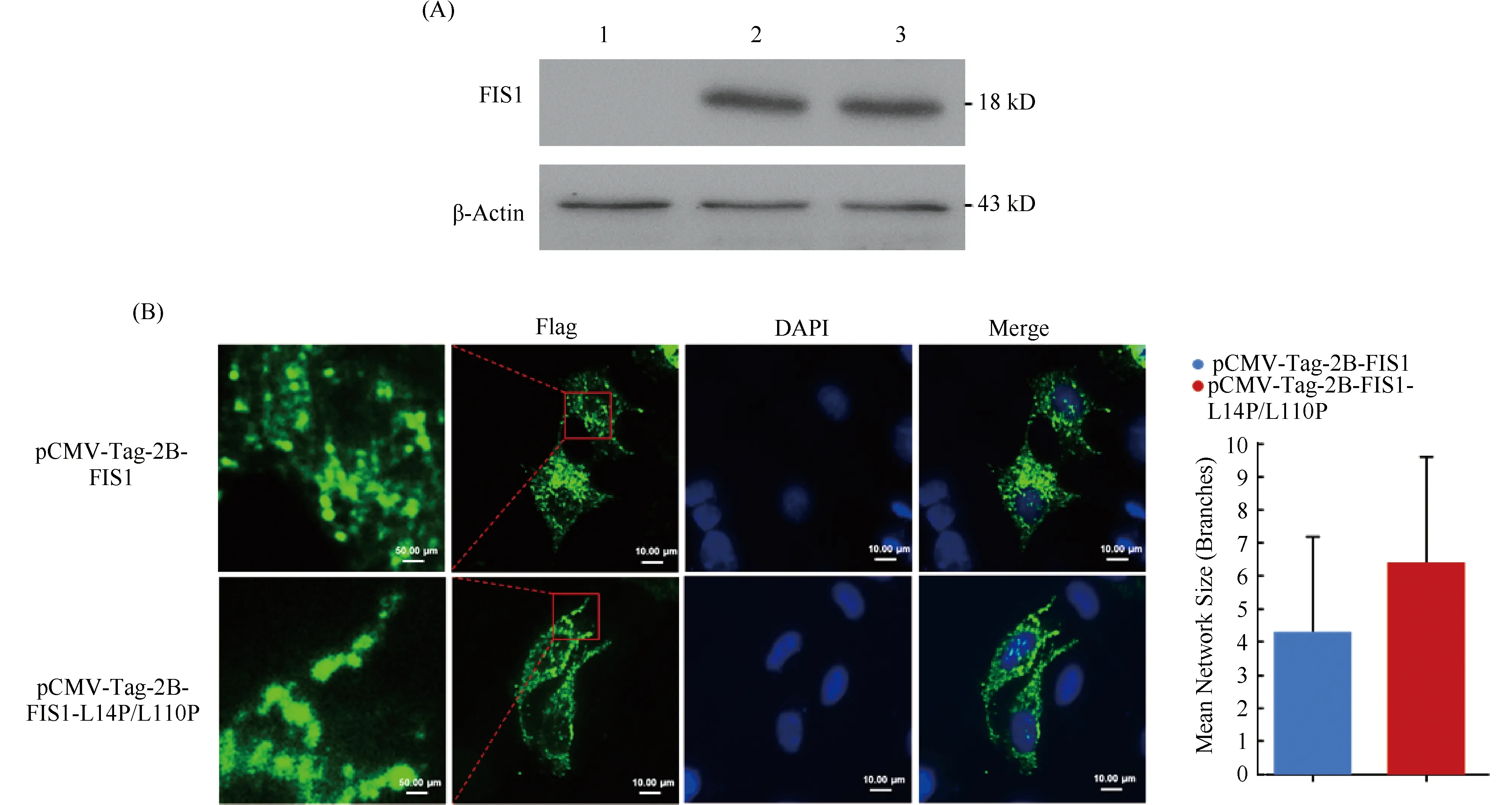
Fig.3 Expression of transfected recombinant plasmids in HeLa cells (A) Western blot detection of expression of recombinant plasmids. 1: HeLa cells transfected with empty vectors. 2: HeLa cells transfected with recombinant plasmid pCMV-Tag-2B-FIS1. 3: HeLa cells transfected with the recombinant plasmid pCMV-Tag-2B-FIS1-L14P/L110P. (B) Immunofluorescence images of HeLa cells transfected with pCMV-Tag-2B-FIS and pCMV-Tag-2B-FIS1-L14P/L110P. Statistical analysis of mitochondrial branches was performed using Image J software. The mitochondrial connectivity of HeLa cells transfected with pCMV-Tag-2B-FIS1 plasmids was slightly reduced than that of HeLa cells transfected with pCMV-Tag-2B-FIS1-L14P/L110P plasmids, but the difference was not statistically significant
2.4 FIS1过表达会降低HeLa细胞的增殖和迁移能力
将pCMV-Tag-2B-FIS1质粒、pCMV-Tag-2B-FIS1(L14P/L110P)质粒与pCMV-Tag-2B空质粒分别转染HeLa细胞。Western印迹结果显示,pCMV-Tag-2B-FIS1与pCMV-Tag-2B-FIS1(L14P/L110P)质粒均在HeLa细胞内成功表达。对细胞进行生长曲线实验,结果显示,相比于转染pCMV-Tag-2B空质粒的HeLa细胞,转染pCMV-Tag-2B-FIS1的HeLa细胞增殖速率显著降低,而转染pCMV-Tag-2B-FIS1(L14P/L110P)的HeLa细胞增殖速率无明显变化(Fig.4A)。进一步对转染pCMV-Tag-2B空质粒、pCMV-Tag-2B-FIS1质粒以及pCMV-Tag-2B-FIS1(L14P/L110P)质粒的HeLa细胞进行迁移能力研究。划痕结果显示,与转染pCMV-Tag-2B空质粒的HeLa细胞相比,转染pCMV-Tag-2B-FIS1质粒的HeLa细胞迁移能力显著降低,而转染pCMV-Tag-2B-FIS1(L14P/L110P)的细胞迁移能力无明显变化(Fig.4B)。综上所述,当过表达FIS1时,宫颈癌细胞增殖能力及迁移能力均出现显著的降低,而当线粒体裂变功能缺失的突变型FIS1(L14P/L110P)过表达时,宫颈癌细胞的生物学行为则未出现显著变化。此研究提示,FIS1对宫颈癌细胞的生物学行为具有显著调控作用,且此调控作用可能与其促进线粒体裂变的功能密切相关。
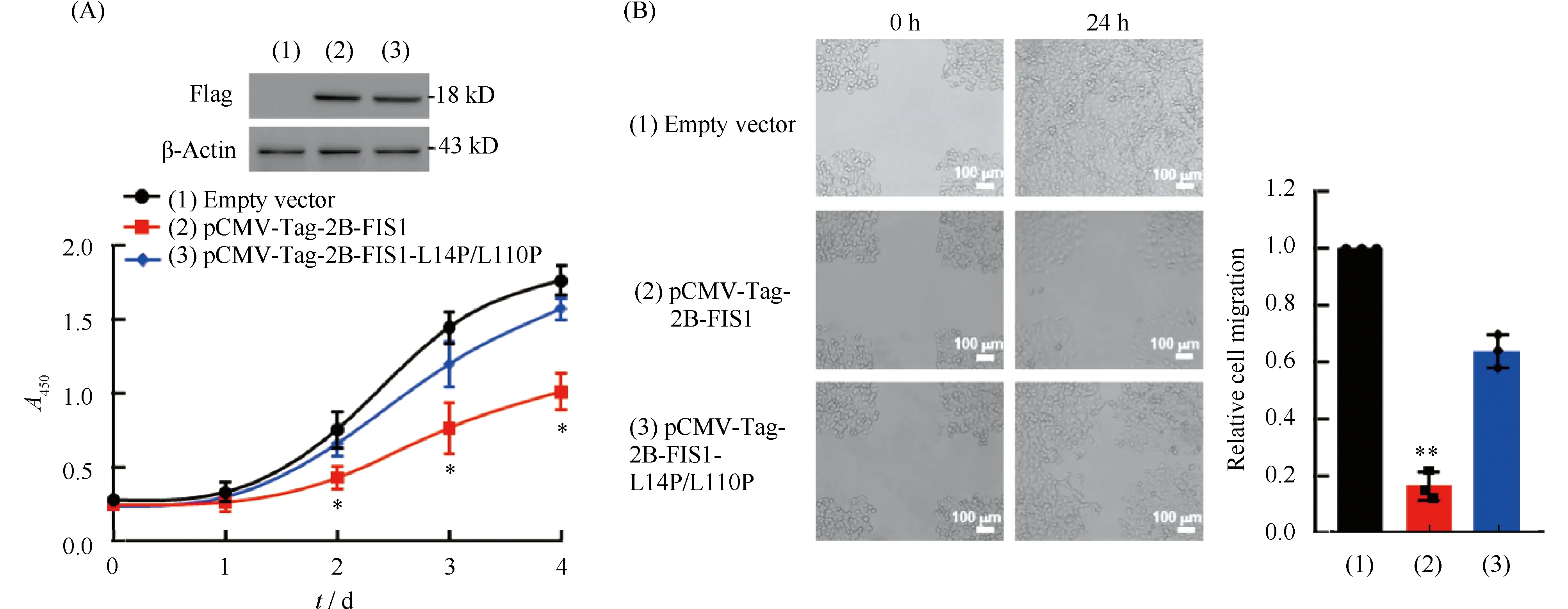
Fig.4 Effects of FIS1 overexpression on the proliferation and migration of human cervical cancer HeLa cells Human cervical cancer HeLa cells were transfected with recombinant plasmids pCMV-Tag-2B-FIS1, pCMV-Tag-2B-FIS1-L14P/L110P and pCMV-Tag-2B empty plasmids. (A) The absorbance was detected with a microplate reader on days 0, 1, 2, 3, and 4 using CCK8 reagents. The proliferation ability of HeLa cells transfected with pCMV-Tag-2B-FIS1-L14P/L110P plasmids did not exhibit obvious differences with that of HeLa cells transfected with empty plasmids. The results showed that the proliferation ability of HeLa cells transfected with pCMV-Tag-2B-FIS1 plasmids was lower than that of HeLa cells transfected with empty plasmids, * P<0.05. (B) After opening the image with Image J software, three horizontal lines were drawn at random and the mean value of the distance between cells was calculate. HeLa cells transfected with pCMV-Tag-2B-FIS1-L14P/L110P plasmids did not show obvious differences with HeLa cells transfected with empty plasmids. HeLa cells transfected with pCMV-Tag-2B-FIS1 plasmids had a reduced migration ability compared with HeLa cells transfected with empty plasmids
2.5 FIS1过表达会增强HeLa细胞的线粒体裂变
将转染重组质粒pCMV-Tag-2B-FIS1和pCMV-Tag-2B空质粒的人宫颈癌细胞HeLa细胞接种于激光共聚焦小皿中,经Mitotracker green探针染色,用激光共聚焦显微镜进行拍照(Fig.5A)。对线粒体分支长度进行统计,转染空质粒pCMV-Tag-2B的HeLa细胞平均长度为17.13±1.39。而转染pCMV-Tag-2B-FIS1重组质粒的HeLa细胞其线粒体分支长度降低为8.67±2.25,线粒体连接度明显降低,两组具有统计学差异(P<0.01)(Fig.5B)。此结果表明,FIS1基因的过表达能使宫颈癌细胞的线粒体裂变增加。
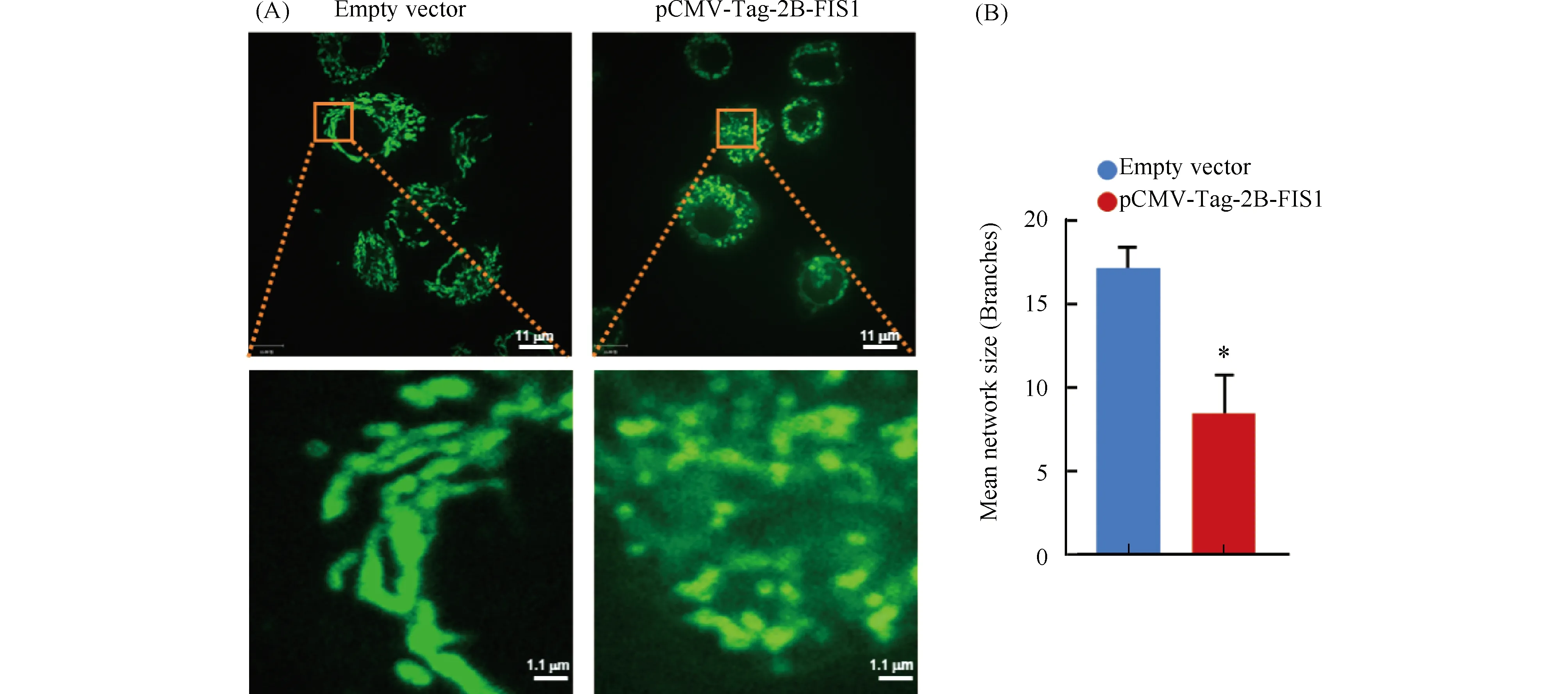
Fig.5 Effects of FIS1 gene expression on mitochondrial fission in human cervical cancer HeLa cells Human cervical cancer HeLa cells transfected with recombinant plasmids pCMV-Tag-2B-FIS1 and pCMV-Tag-2B empty plasmids were seeded in confocal dishes. (A) The Mitotracker Green probe was diluted with serum-free medium at a ratio of 1∶500, and 500 μL of the dilution was added to each confocal dish, and incubated at 37℃ in the dark for 30 minutes. After staining, mitochondrial morphology was observed by LSCM (×600). (B) Statistical analysis of mitochondrial junctions was performed using Image J software. The mitochondrial connectivity of HeLa cells transfected with pCMV-Tag-2B-FIS1 recombinant plasmids was significantly reduced,*P<0.05
2.6 FIS1过表达升高HeLa细胞的活性氧水平
将转染重组质粒pCMV-Tag-2B-FIS1和pCMV-Tag-2B空质粒的人宫颈癌细胞HeLa细胞使用ROS探针染色,并进行流式检测(Fig.6)。结果发现,以转染pCMV-Tag-2B空质粒的HeLa细胞作为对照样本,转染pCMV-Tag-2B-FIS1重组质粒的HeLa细胞其归一化荧光强度为1.35±0.057,表明FIS1蛋白的过表达引起了HeLa细胞内ROS水平的升高。已有多项研究均证明,ROS水平较低的细胞对于诱导细胞凋亡的生理刺激信号以及化疗、放疗等治疗方式均不敏感[19, 20]。宫颈癌细胞内FIS1表达水平低于正常细胞,据此推断其ROS水平低于正常细胞。因此,相比于正常细胞,宫颈癌细胞更易存活及生长。FIS1基因过表达后,HeLa细胞出现ROS升高,这可能是导致HeLa细胞出现增殖和迁移能力降低的重要原因。
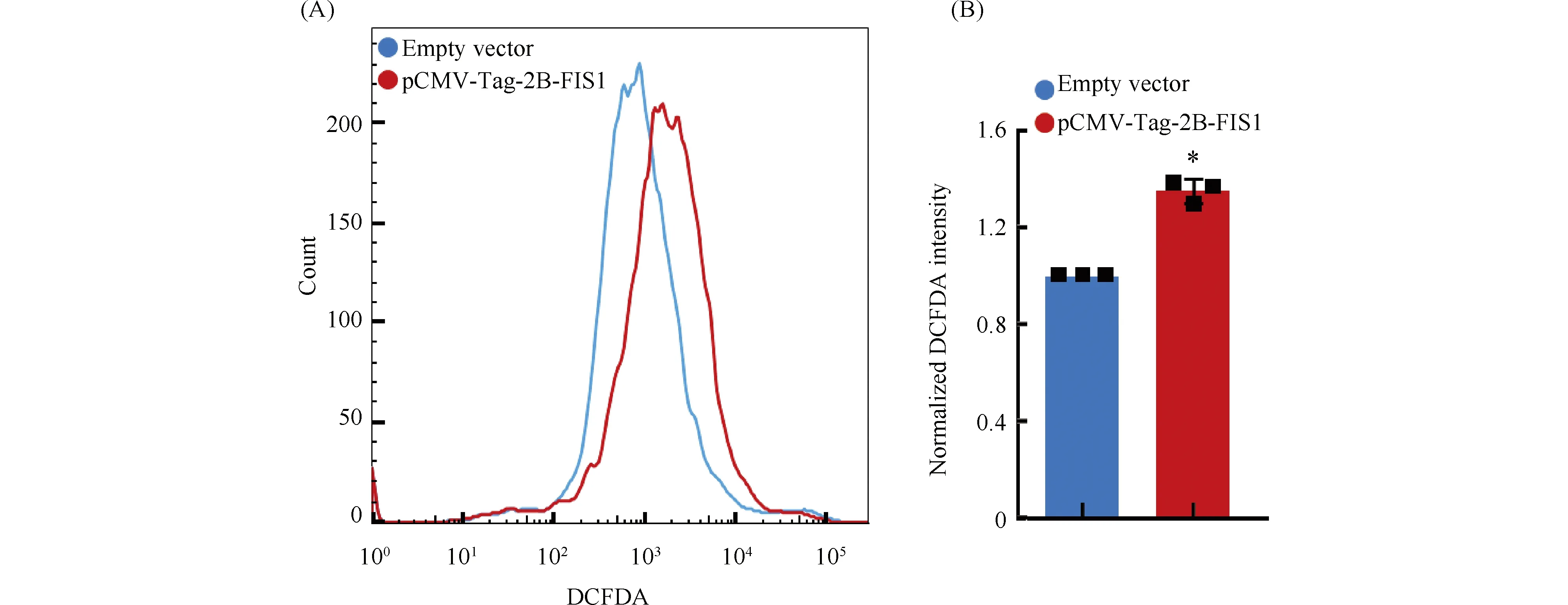
Fig.6 Effects of FIS1 gene expression on ROS levels in human cervical cancer HeLa cells (A) The ROS level in HeLa cells transfected with recombinant vector pCMV-Tag-2B-FIS1 and HeLa cells transfected with pCMV-Tag-2B empty vectors. The human cervical cancer HeLa cells transfected with recombinant plasmids pCMV-Tag-2B-FIS1 and pCMV-Tag-2B empty plasmids were stained with the ROS probe, and then flow cytometry was performed. ROS levels were increased in HeLa cells transfected with pCMV-Tag-2B-FIS1 recombinant plasmids. (B) The histogram represents the normalized DCFDA intensity in HeLa cells, * P<0.05
3 讨论
线粒体不仅是能量工厂,它同时参与了最基本的细胞代谢过程。从ROS产生到钙离子信号传导再到细胞应激反应和凋亡,线粒体都发挥重要作用,这些功能的维持与线粒体的形态变化关联密切[21]。线粒体形态变化是通过不断进行融合和分裂运动来实现[22]。FIS1作为一种位于线粒体外膜且介导分裂的关键蛋白质,可通过与胞浆中募集到的DRP1相结合从而导致线粒体分裂[23]。有研究表明,当细胞受到损伤刺激时会刺激FIS1高表达,过量表达的FIS1会导致线粒体片段化加剧,进而导致细胞凋亡[24]。
肿瘤细胞中的线粒体动力学对维持细胞功能以及抵抗各种压力具有重要意义。目前许多研究发现,线粒体裂变能够影响肿瘤细胞的存活[25]。此外,调节线粒体动力学的蛋白质水平的改变已被建议作为恶性肿瘤的潜在生物标志物或治疗多种肿瘤类型的靶标[26]。线粒体融合与裂变的失衡也会导致线粒体功能障碍,其特征是ROS的产生[27]。
近年来,大量报道发现,FIS1在肿瘤的发生发展中也发挥重要功能[28]。除了线粒体能量供应,线粒体自噬对于肿瘤细胞和肿瘤干细胞(cancer stem cell, CSC)的存活也发挥重要作用[29]。有研究发现,线粒体自噬能够调节CSC的干性,FIS1能够通过线粒体裂变调节线粒体自噬,并促进人肺腺癌CSC的干性[29]。另有研究发现,在白血病的CSC中,FIS1高度表达并且FIS1介导的线粒体自噬能够维持白血病CSC的干性[30]。据报道,FIS1在胃肿瘤中显著过表达。进一步的分析表明,FIS1上调与胃肿瘤的转移显著相关[31]。FIS1调控线粒体功能,过高表达或过低表达均会引起细胞功能的显著异常。Lin 等[32]研究提示,FIS1在乳腺癌中低表达。Zhou 等[33]研究提示,FIS1在肺癌中低表达。肿瘤的发生是一个多步骤与多基因改变的过程,而且体内基因在功能上相互联系、相互作用构成复杂的基因网络。因此,同一基因在不同类型的肿瘤细胞中表达水平可能不同。FIS1在肿瘤发生发展中的作用仍需进一步探究。
本研究通过TCGA数据库中的宫颈癌相关数据的生物信息学分析及生物学实验发现,FIS1在宫颈癌组织中低表达,且FIS1可能调控线粒体相关的生物学功能。进一步的细胞研究结果显示,HeLa细胞内过表达FIS1能够抑制细胞的增殖和迁移,促进线粒体裂变并导致细胞内出现氧化应激损伤。而功能缺失的突变体FIS1-L14P/L110P则在HeLa细胞中未显示出明显的抑制增殖和迁移的生物学功能。本研究提示,FIS1可在人宫颈癌细胞内介导线粒体裂变,引起氧化应激损伤及引发细胞生物学功能障碍。FIS1可能为宫颈癌提供新的治疗靶点。此前已有研究发现,FIS1在乳腺癌、肺癌等多种肿瘤中发挥作用,但FIS1在宫颈癌中发挥的作用尚未报道。本研究为进一步研究FIS1在宫颈癌中具体机制奠定了基础。
