低氧环境对三阴性乳腺癌细胞糖代谢途径的重编程
2022-09-07胡沥予李航真方天星曾凡才
胡沥予, 李航真, 方天星, 戴 雯, 李 翔, 曾凡才*
(1)西南医科大学基础医学院生物化学与分子生物学实验室, 四川 泸州 646000;2)四川省核医学与分子影像重点实验室,西南医科大学附属医院,四川省院士(专家)工作站, 四川 泸州 646000;3)西南医科大学临床医学院2018级临床医学办公室, 四川 泸州 646000)
细胞代谢改变是肿瘤细胞的特征之一。越来越多的研究认为,肿瘤是一种代谢病,肿瘤代谢是目前肿瘤研究的主要方向之一[1, 2]。研究发现,许多癌细胞具有Warburg效应[3]。上个世纪20年代,德国科学家Warburg提出,无论是在有氧还是缺氧的情况下,癌细胞都主要使用糖的无氧氧化作用取代有氧氧化,这种现象称为Warburg效应[4]。Warburg认为,造成这种现象的主要原因是由于癌细胞线粒体存在缺陷,影响其糖的有氧氧化途径[3, 4]。但是,现在的研究发现,大多数具有Warburg效应癌细胞的线粒体是具有功能的,而且这些细胞的Warburg效应是癌症进展、治疗抵抗和预后不良的主要驱动因素[3, 4]。维持癌细胞即使在有氧条件下也通过糖的无氧氧化途径来分解葡萄糖供能的一个重要影响因素是低氧诱导因子-1α(hypoxia inducible factor-1α,HIF-1α)蛋白在常氧下保持了稳定,本来HIF-1α只有在低氧条件下才能保持稳定[5]。当然,在实体瘤中由于血供不足,有些区域长期处于低氧甚至缺氧的微环境中,使HIF-1α蛋白在肿瘤组织中保持稳定。HIF-1α作为一种重要的转录因子,可能调控上百个基因的表达,在肿瘤的发生和发展过程中发挥重要作用,特别是与肿瘤细胞代谢密切相关[6, 7]。早已发现HIF-1α能调控癌细胞的糖代谢,且主要集中于癌细胞Warburg效应的研究。这些研究发现,HIF-1α能通过改变关键酶的活性抑制癌细胞糖的有氧氧化途径,促进糖的无氧氧化途径[6, 8]。当然在低氧环境下,除HIF-1α蛋白稳定是癌细胞的一个主要调节因素外,c-Myc和RAS等癌基因激活,以及p53和PTEN等肿瘤抑制因子的失活也是重要的调节因素[3]。鉴于现有研究主要针对低氧通过影响关键酶的表达改变了糖代谢,并且也未见同时分析低氧对糖代谢中糖的无氧氧化、糖的有氧氧化、磷酸戊糖途径、糖原合成、糖原分解和糖异生6条途径的影响,更是未完整分析是由于糖代谢途径中哪些酶的同工酶或者组成亚基的改变导致糖代谢重编程。本研究拟在本室前期已对低氧细胞模型进行优化的基础上[9],以三阴性乳腺癌(triple-negative breast cancer,TNBC)细胞为研究对象,采用转录物组测序技术(RNA-sequencing,RNA-seq)分析低氧对TNBC细胞糖代谢6条途径的改变,特别是分析6条代谢途径中所有酶的同工酶或组成亚基以及2种重要调节酶的同工酶基因表达变化,并通过Western 印迹检测和乳腺癌组织样本数据库对重要的酶进行验证,旨在进一步认识低氧环境下TNBC的糖代谢重编程分子机制,为三阴性乳腺癌的分子诊断、治疗和预后提供理论依据。
1 材料与方法
1.1 材料
人TNBC细胞系BT549和MDA-MB-231购自中国科学院细胞库(中国上海)。HIF-1α抗体(ab2185)和GYS1(ab40810)购自Abcam公司;β-肌动蛋白(β-actin)(AP0060)和GAPDH(MB001)抗体购自美国Bioworld公司;CA9(sc-365900)、GLUT1(sc-377228)、HK2(sc-374091)、PFK1(sc-166722)、ALDOA(sc-390733)、PGK1(sc-130335)、ENO2(sc-271384)、PKM(sc-365684)、LDHA(sc-137243)、PCK(sc-271029)、PDK1(sc-293160)、PDK2(sc-517284)、PDK3(sc-365378)、PDK4(sc-518061)和G6PD(sc-373886)抗体购自美国Santa Cruz公司;GPI(15171-1-AP)、 TPI1 (10713-1-AP)和PGAM1(16126-1-AP)抗体购自proteintech公司;BCA试剂盒(P0010)、ATP检测试剂盒(S0026)和NADPH+/NADPH检测试剂盒(S0179)均购自上海碧云天生物技术有限公司;丙酮酸脱氢酶活性检测试剂盒(BC0385)和糖原含量检测试剂盒(BC0345)购自北京索莱宝科技有限公司;葡萄糖测定试剂盒(F006-1)购自上海荣盛生物药业有限公司;乳酸(LD)测试盒(A019-2-1)购自南京建成生物工程研究所。
1.2 细胞培养及物理低氧细胞模型的建立
BT549细胞在含10%胎牛血清(Gibco)的RPIM-1640(Hyclone)培养基中培养,培养环境为37 ℃,5% CO2,100%湿度。MDA-MB-231细胞在含10%胎牛血清的Leibovitz’s-15(Gibco)培养基中培养,培养条件为37 ℃,空气,100%湿度。根据细胞生长情况,2~3 d换液或者传代。细胞在氧气浓度为2%的三气培养箱中培养24 h建立物理低氧模型[9]。
1.3 RNA制备与RNA-seq
分别将BT549和MDA-MB-231细胞接种于6孔板中,普通培养箱中过夜培养待细胞贴壁,将低氧组放置于2% O2的三气培养箱中培养24 h,常氧组放置在普通培养箱中培养24 h。每个样本重复4次。6孔板中加入TRIzol试剂,将在TRIzol试剂中保存的样本转移至EP管后放入液氮中保存。并将在TRIzol试剂中保存的样本送华大基因公司(中国武汉),华大基因公司根据测序样品检测标准对所有样本进行质控检测,检测结果为所有送样本均合格。使用BGISEQ-500测序仪对所有样本进行RNA测序分析。
1.4 测序结果分析
对测序原始结果进行质控分析。去除低质量、接头污染以及未知碱基N含量过高的reads以确保结果的可靠性,剔除这些序列后剩余序列即为干净序列。公司进行RNA-seq后对16个样本原始测序数据质量进行评估的结果为过滤后reads比例大于98.64%,Q30(碱基质量值≥30所占百分比)大于92.74%。获得干净序列,使用HISAT2软件将干净序列比对到参考基因组序列。评估结果为总匹配率大于94.13%,唯一位置比对效率大于79.88%。以上结果均表明测序结果良好,可进行基因定量分析。利用RSEM(RNA-Seq by Expectation-Maximization)算法计算各个样品的基因表达量。通过RSEM定量结果来计算16个样本的相关性,各样本生物学重复相关性结果为0.995~0.999。以上分析结果表明,所送样本的测序结果良好且可利用率高,可对其进行下一步分析。
1.5 生物信息学分析
同时使用Studentt检验和差异倍数(fold change,FC)法来筛选差异表达基因。本研究差异表达基因定义为Q<0.05且∣log2FC∣ ≥1。根据GO(Gene Ontology)和KEGG(Kyoto Encyclopedia of Genes and Genomes)通路注释分类,利用R软件中的Phyper函数进行富集分析。一般认为,Q<0.05的函数具有丰富的显著性。这些原始数据在华大基因的Dr.Tom网络平台上进行了分析(http://report.bgi.com)。利用Oncomine数据库(https: //www.oncomine.org)分析糖代谢酶基因在正常乳腺组织和乳腺癌组织中mRNA表达水平。使用Breast Cancer Gene-Expression Miner v4.8数据库(http://bcgenex.ico.unicancer.fr/ BC-GEM/GEM-requete.php)分析糖代谢酶基因在TNBC患者和非TNBC患者mRNA表达。
1.6 Western 印迹检测
BT549或MDA-MB-231细胞中加入RIPA裂解液,将细胞收集到EP管,EP管在冰上裂解10 min后进行超声,在4 ℃离心机15 000 r/min 离心10 min。提取的蛋白质经SDS-PAGE分离后,转移至PVDF膜上。用5%脱脂牛奶室温封闭1 h,在一抗中4 ℃孵育过夜。膜用TBST洗涤15 min×3,在HRP标记的二抗中,室温孵育1 h,TBST洗涤15 min×2,再用TBS洗涤15 min×1,进行化学发光成像。
1.7 葡萄糖摄入量检测
对BT549和MDA-MB-231细胞分别进行常氧和低氧处理24 h,收集各组细胞培养基上清液至EP管中。细胞沉淀提取蛋白质,按照BCA试剂盒步骤测定各组蛋白质浓度。培养基和EP管上清液中葡萄糖含量测定按照葡萄糖测定试剂盒说明书进行,并计算出葡萄糖摄入量,最后用BCA法测定的蛋白质浓度计算每组单位蛋白质量中葡萄糖摄入量。
1.8 乳酸生成量检测
对BT549和MDA-MB-231细胞分别进行常氧和低氧处理24 h,收集各组细胞培养基上清液至EP管中。细胞沉淀提取蛋白质,使用BCA法测定蛋白质浓度。培养基和EP管上清液中乳酸含量按照乳酸测定试剂盒说明书进行,并计算出乳酸生成量。最后用BCA法测定的蛋白质浓度计算每组单位蛋白质量中乳酸生成量。
1.9 丙酮酸脱氢酶活性检测
分别取对数生长期的BT549和MDA-MB-231细胞进行常氧、低氧和低氧+5 mmol/L二氯乙酸钠(sodium dichloroacetate,DCA)处理24 h,收集各组细胞并弃上清液。按照丙酮酸脱氢酶试剂盒说明书,于605 nm波长测定吸光值,并计算丙酮酸脱氢酶活性,最后用BCA法测定的蛋白质浓度计算每组单位蛋白质量中丙酮酸脱氢酶活性。
1.10 NADPH含量检测
对BT549和MDA-MB-231细胞进行常氧和低氧处理24 h,收集各组细胞并弃上清液。按照NADPH+/NADPH检测试剂盒说明书步骤进行操作,测量450 nm处各组吸光度,并根据公式计算NADPH总量,结合BCA法测定的蛋白质浓度计算每组单位蛋白质量中NADPH含量。
1.11 ATP含量检测
对BT549和MDA-MB-231细胞进行常氧和低氧处理24 h,收集各组细胞并弃上清液。按照ATP含量检测试剂盒说明书步骤进行操作。应用化学发光仪检测,通过标准曲线计算各组中ATP浓度,结合BCA法测定的蛋白质浓度计算每组单位蛋白质量中ATP含量。
1.12 糖原含量检测
分别取对数生长期的BT549和MDA-MB-231细胞进行常氧和低氧处理24 h,收集各组细胞并弃上清液。按照糖原含量检测试剂盒说明书,于620 nm波长测定吸光值,并计算糖原含量,最后用BCA法测定的蛋白质浓度计算每组单位蛋白质量中糖原含量。
1.13 统计学方法
采用SPSS 22.0和GraphPad Prism 7.0统计软件进行数据分析和作图,计量资料采用均数±标准差(Mean ±SD)表示。两组间比较采用t检验,多组间比较采用单因素方差分析,以P<0.05表示差异有统计学意义。
2 结果
2.1 两种TNBC细胞在低氧条件下的差异基因表达分析
HIF-1α和CA9均为细胞处于低氧状态的标志分子。BT549和MDA-MB-231在2%低氧浓度下处理24 h,观察到HIF-1α和CA9蛋白质的表达比常氧对照组增加十分明显,说明低氧细胞模型构建成功(Fig.1A)。将同时处理的BT549和MDA-MB-231细胞送华大基因公司进行RNA-seq测序,公司对送测16个样本的质量和测序结果进行质控分析,结果均为良好。利用华大基因公司提供的分析平台设置差异标准为Q<0.05且∣log2FC∣ ≥1,分别对BT549和MDA-MB-231两种细胞常氧组和低氧组进行差异基因表达分析。结果显示,BT549细胞低氧组与常氧组相比,共有334个基因存在表达差异,其中表达上调基因249个,下调基因85个(Table S1);MDA-MB-231细胞低氧组与常氧组相比,共有215个基因存在表达差异,其中表达上调基因有181个,下调基因34个(Table S2);在这些差异表达基因中有较多与糖代谢相关。分别对2种TNBC细胞经低氧处理后的差异表达基因进行GO功能富集和KEGG通路富集,并列出Q值<0.05的前10条通路,发现不论GO功能富集还是KEGG通路富集的分析结果,都比较集中于糖代谢相关通路(Fig.1B,C)。上述结果显示,低氧对细胞糖代谢的影响较大,提示应该更进一步分析低氧改变糖代谢途径的详细过程。因此,后续将具体分析低氧是如何通过改变酶的同工酶或亚基来使糖代谢6条途径发生重编程。
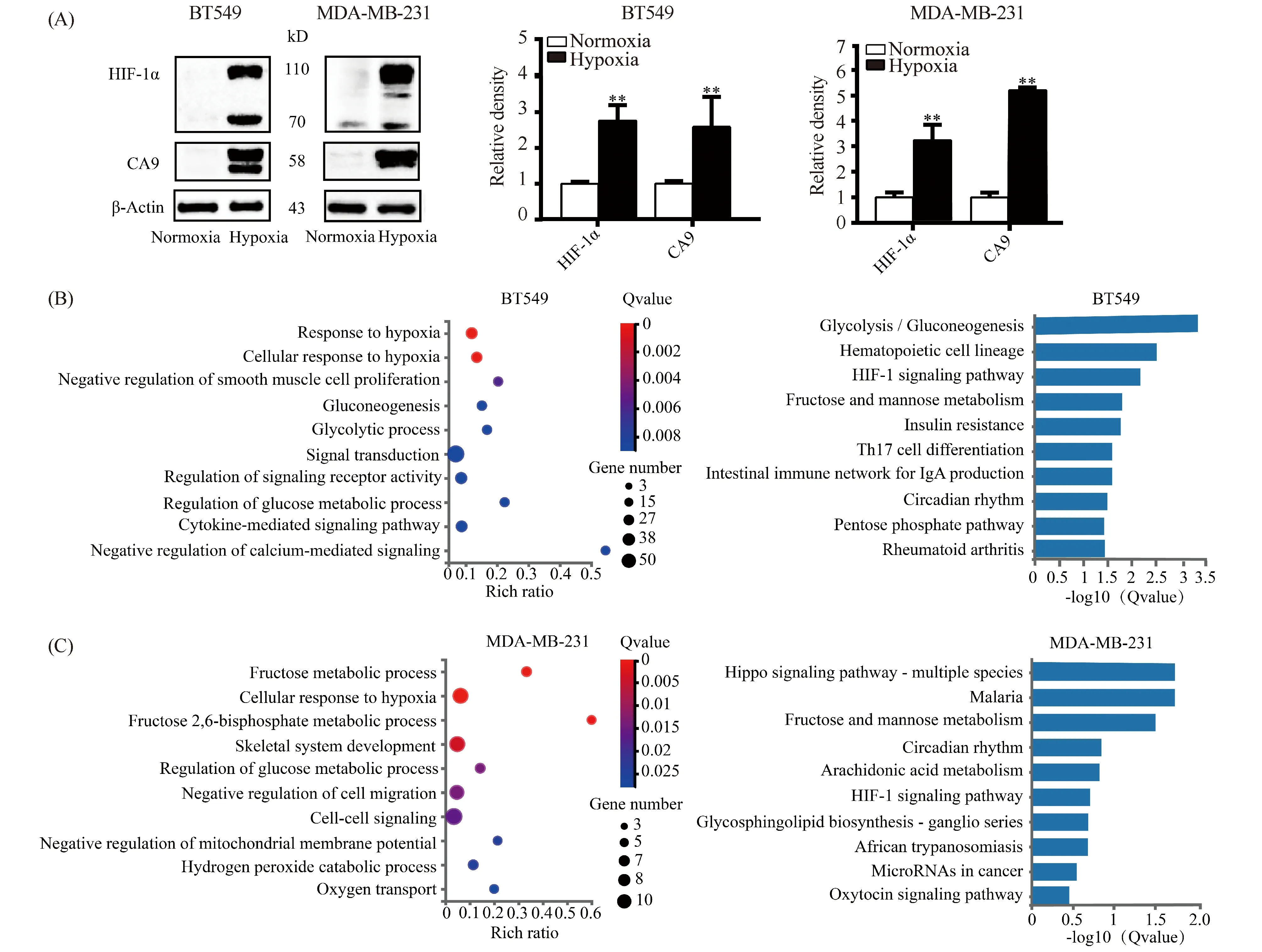
Fig.1 Analysis of differentially expressed genes(DEGs)in hypoxia models of two kinds of TNBC cells (A) Immunoblotting of HIF-1α and CA9 between normoxia and hypoxia groups in BT549 and MDA-MB-231 cells, respectively (n=3). (B) The GO functional enrichment and significantly-enriched KEGG pathway analysis of DEGs in BT549 cells. The chart shows the top ten terms in the order of Q values from low to high. (C) The GO functional enrichment and significantly-enriched KEGG pathway analysis of DEGs in MDA-MB-231 cells (n=4). Abbreviations: HIF-1α: hypoxia inducible factor-1α; CA9: carbonic anhydrase 9
2.2 低氧环境增加2种TNBC细胞葡萄糖的摄取和促进糖的无氧氧化途径
葡萄糖转运蛋白(glucose transporters, GLUTs)是转运葡萄糖进入细胞的主要载体,人体中已发现14种GLUTs,其中GLUT1~GLUT4是转运葡萄糖进入细胞的主要载体。RNA-seq结果显示,这4种GLUTs在BT549细胞中仅GLUT1的mRNA表达量较高,在MDA-MB-231细胞中GLUT1和GLUT3的mRNA表达量较高,并且它们在低氧环境下表达均增加(Fig.2A,B)。GLUT1作为在2种细胞共有较高表达的亚型,低氧处理后在蛋白质水平也是表达增加的(Fig.2C),低氧处理细胞后不仅葡萄糖转运蛋白表达升高,而且葡萄糖的摄取也增加(Fig.2D)。
糖的无氧氧化代谢途径共由11种酶催化11步反应后将葡萄糖转变为乳酸。RNA-seq测序结果显示,低氧使BT549和MDA-MB-231细胞中催化糖的无氧氧化途径全部反应的11种酶基因在转录表达水平均会不同程度的增加,特别是这些酶的同工酶或组成亚基大多数是表达增加(Fig.2A, B)。糖的无氧氧化途径中以下酶具有同工酶或由不同亚基组成:已糖激酶有HK1~HK4四种同工酶,其中HK1和HK2在2种TNBC细胞中的mRNA水平表达较高且均受低氧促进。磷酸果糖激酶-1(PFK-1)是由PFKM、PFKP和PFKL3种基因编码的蛋白质亚基组成的同源或异源四聚体,存在多种同工酶。RNA-seq测序结果显示,除PFKM表达变化不明显外,PFKP和PFKL均在低氧环境下表达升高。醛缩酶有醛缩酶A、B、C三种同工酶,RNA-seq未检测到醛缩酶B(ALDOB)同工酶在2种TNBC细胞中的mRNA表达,而醛缩酶A(ALDOA)同工酶在转录水平的表达量比醛缩酶C(ALDOC)同工酶高较多,但是低氧促进ALDOC在转录水平的表达作用比ALDOA强得多。磷酸甘油酸激酶有2种同工酶,由于PGK2是睾丸特异性表达,仅检测到PGK1的mRNA高表达且受低氧的促进作用。磷酸甘油酸变位酶有4种同工酶,检测到PGAM1的mRNA高表达且受低氧的调控,同工酶PGAM5的mRNA也有一定量的表达,但它未受低氧的影响,其余同工酶未检测到表达。烯醇化酶也有4种同工酶,其中ENO1和ENO2在2种TNBC细胞中的mRNA高表达且受低氧促进。丙酮酸激酶分别由PKM和PKLR基因编码,通过选择性剪接会形成PKL、PKR、PKM1和PKM2四种同工酶,不过RNA-seq测序未能区分剪接异构体,仅检测到PKM基因的mRNA表达,且受低氧的促进作用。糖的无氧氧化代谢途径最后一步反应是由乳酸脱氢酶催化,该酶主要是由LDHA和LDHB两个基因编码的亚基组成5种四聚体同工酶。RNA-seq测序结果显示,LDHA基因的mRNA在低氧条件下增加明显,而LDHB基因表达有所下调(Fig.2A, B)。糖的无氧氧化途径每一步反应的酶都选择了一种在mRNA水平表达升高的同工酶或亚基在蛋白质表达水平进行验证,其结果与mRNA表达水平一致(Fig.2C)。此外,调节糖酵解流量最重要的因素是磷酸果糖激酶-1的活性,而6-磷酸果糖-2-激酶/果糖-2,6-二磷酸酶(PFKFB)的催化产物果糖-2,6-二磷酸是磷酸果糖激酶-1的最强别构激活剂。PFKFB共有PFKFB1-PFKFB4四种同工酶,在2种TNBC细胞中未检测到PFKFB1的mRNA表达,PFKFB3的mRNA表达量最强,PFKFB2和PFKFB4的mRNA表达量接近,但低氧仅能促进PFKFB3和PFKFB4的mRNA表达,特别是对PFKFB4的促进作用十分显著(Fig.2A, B)。检测糖的无氧氧化途径产物乳酸的量,发现在2种TNBC细胞中低氧处理组比常氧组乳酸生成量均增加显著(Fig.2E)。由以上结果可见,低氧不仅增加糖的无氧氧化代谢途径中关键酶基因的表达,还增加非关键酶基因的表达来促进糖的无氧氧化。
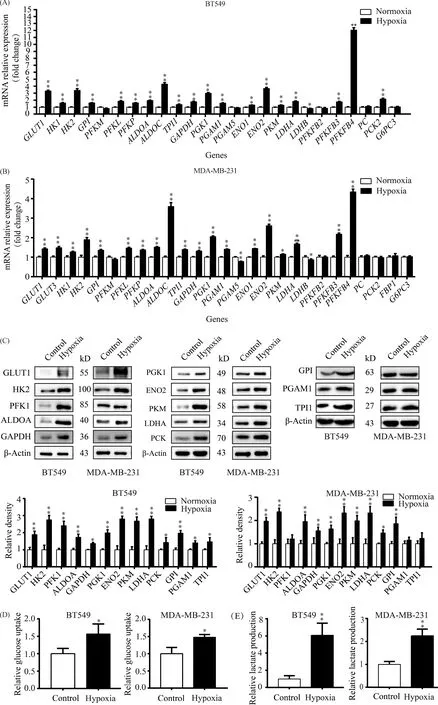
Fig.2 Hypoxia increases glucose uptake and promotes the glycolytic pathway in two kinds of TNBC cells (A) Normalized relative expression of glycolysis and gluconeogenesis enzymes under normoxia and hypoxia groups of BT549 cells. (B) Normalized relative expression of glycolysis and gluconeogenesis enzymes in normoxia and hypoxia groups of MDA-MB-231 cells (n=4). (C) Representative Western blots of enzymes of glycolysis and gluconeogenesis in BT549 and MDA-MB-231 cells under normoxia and hypoxia, respectively. (D) Glucose intake levels of BT549 and MDA-MB-231 cells under normoxia and hypoxia. (E) Lactate production levels of BT549 and MDA-MB-231cells under normoxia and hypoxia.*P < 0.05,** P < 0.01 vs control group (n=3). Abbreviations: GLUT: glucose transporter; HK: hexokinase; GPI: glucose-6-phosphate isomerase; PFK: phosphofructokinase; ALDO: aldolase; TPI1: triosephosphate isomerase 1; GAPDH: glyceraldehyde-3-phosphate dehydrogenase; PGK: phosphoglycerate kinase; PGAM: phosphoglycerate mutase; ENO: enolase; PKM: pyruvate kinase M; LDH: lactate dehydrogenase; PFKFB: 6-phosphofructo-2-kinase/ fructose-2,6- biphosphatase; PC: pyruvate carboxylase; PCK: phosphoenolpyruvate carboxykinase; FBP1: fructose-bisphosphatase 1; G6PC3: glucose-6-phosphatase catalytic subunit 3
糖异生类似于糖的无氧氧化逆过程,但是糖的无氧氧化中由关键酶催化的三步不可逆反应与糖异生途径不能共用,而是由丙酮酸羧化酶(pyruvate carboxylase, PC)、磷酸烯醇式丙酮酸羧激酶(phosphoenolpyruvate carboxykinase, PCK)、果糖二磷酸酶-1(fructose-bisphosphatase 1, FBP-1)和葡糖-6-磷酸酶(glucose-6-phosphatase, G6Pase)这4种糖异生途径关键酶来逆转糖的无氧氧化的三步不可逆反应,其中G6Pase是内质网的多亚基整合蛋白质,由葡萄糖催化亚基(G6PC)和转运蛋白组成。RNA-seq测序结果显示,低氧处理2种TNBC细胞后,糖异生途径中4种关键酶仅在低氧处理BT549细胞中的PCK2基因在转录水平表达增加(Fig.2A, B),并在蛋白质表达水平得到了验证(Fig.2C),而PCK的另一同工酶PCK1在2种细胞中未检测到mRNA表达。FBP-1在BT549细胞中也未检测到mRNA表达,G6PC有3个亚基,仅检测到G6PC3亚基基因在2种TNBC细胞中转录水平有较高表达,但不受低氧的调节(Fig.2A, B)。
综上结果表明,低氧不仅能促进2种TNBC细胞的葡萄糖摄入,而且使催化糖的无氧氧化途径中几乎全部反应的酶都至少有一种同工酶或酶蛋白亚基表达增加,以促进糖的无氧氧化,而低氧不会改变TNBC细胞的糖异生过程。
2.3 低氧环境抑制2种TNBC细胞糖的有氧氧化途径
从葡萄糖分解代谢至丙酮酸这10步反应是糖的无氧氧化和有氧氧化途径共用的反应过程,对于正常细胞如果在有氧的状态下,丙酮酸进入线粒体由丙酮酸脱氢酶(pyruvate dehydrogenase, PDH)、二氢硫辛酰胺转乙酰酶(dihydrolipoyl transacetylase, DLAT)和二氢硫辛酰胺脱氢酶(dihydrolipoamide dehydrogenase, DLD)3种酶组成的丙酮酸脱氢酶复合体(pyruvate dehydrogenase complex,PDC)催化后将丙酮酸转变为乙酰辅酶A,乙酰辅酶A再进入三羧酸循环和氧化磷酸化彻底氧化分解,并生成大量ATP。PDH是由2个α亚基和2个β亚基组成的四聚体酶。其中,α亚基由PDHA1基因编码,β亚基由PDHB基因编码。RNA-seq测序结果显示,低氧处理BT549和MDA-MB-231细胞,组成PDC多酶复合体的3种酶基因在mRNA水平表达均呈下降趋势,特别是在BT549细胞中PDHB、DLAT和DLD在mRNA水平表达明显降低(Fig.3A, B)。更重要的是作为使PDH磷酸化后抑制其活性的丙酮酸脱氢酶激酶(PDK)有PDK1~PDK4四种同工酶。其中,PDK1和PDK3在低氧处理的2种TNBC细胞中,其mRNA表达升高,特别是PDK1增加十分显著(Fig.3A, B),它们在蛋白质水平表达也一致(Fig.3C)。如果在低氧条件下加入PDK的抑制剂二氯乙酸钠(DCA)后,丙酮酸脱氢酶活性得以部分恢复(Fig.3D)。
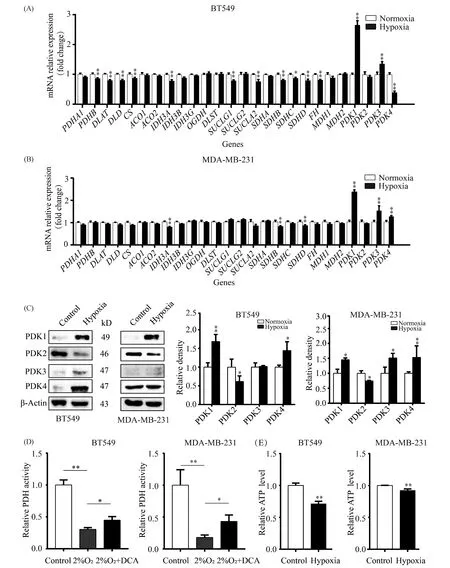
Fig.3 Hypoxia inhibits the aerobic oxidation pathway in two kinds of TNBC cells (A)Normalized relative expression of aerobic oxidation enzymes under normoxia and hypoxia groups of BT549 cells. (B) Normalized relative expression of aerobic oxidation enzymes under normoxia and hypoxia groups of MDA-MB-231 cells (n=4). (C) Representative Western blotting of PDK1-PDK4 in BT549 and MDA-MB-231 cells under normoxia and hypoxia, respectively. (D) The activity levels of pyruvate dehydrogenase in BT549 and MDA-MB-231 cells treated with normoxia, 2% O2 and 2% O2+5 mmol/L sodium dichloroacetate (a specific inhibitor of PDK) were detected for 24 hours. (E) ATP levels of BT549 and MDA-MB-231 cells under normoxia and hypoxia.*P < 0.05,** P < 0.01 vs control group (n=3). Abbreviations: PDH: pyruvate dehydrogenase; DLAT: dihydrolipoyl transacetylase; DLD: dihydrolipoamide dehydrogenase; CS: citrate synthase; ACO: aconitase; IDH: isocitrate dehydrogenase; OGDC: oxoglutarate dehydrogenase; DLST: dihydrolipoamide S-succinyltransferase; SUCLG: succinate-CoA ligase GDP-forming; SUCLA: succinate-CoA ligase ADP-forming; SDH: succinate dehydrogenase subunit; FH: fumarate hydratase; MDH: malate dehydrogenase; PDK: pyruvate dehydrogenase kinase; DCA: sodium dichloroacetate
三羧酸循环的8步反应由8种酶催化,这些酶包括其同工酶或亚基在低氧环境下其mRNA均存在不同程度的表达降低或者降低的趋势,特别是编码异柠檬酸脱氢酶3(IDH3)同工酶A亚基(IDH3A)以及琥珀酸脱氢酶B亚基(SDHB)和D亚基(SDHD)的基因,在低氧处理的2种TNBC细胞中其mRNA表达降低均具有统计学意义(Fig.3A, B)。而且BT549和MDA-MB-231细胞在低氧条件下ATP的生成量均降低,进一步提示低氧环境可能抑制糖的有氧氧化途径(Fig.3E)。
综上,低氧主要通过增加PDK1和PDK3的表达以抑制丙酮酸脱氢酶的活性来抑制糖的有氧氧化途径,同时也可能通过降低糖的有氧氧化途径中部分酶表达来减少该途径的进行。
2.4 低氧环境促进2种TNBC细胞的磷酸戊糖途径
葡萄糖除了被氧化分解供能外,也可通过磷酸戊糖途径生成NADPH和磷酸核糖。低氧处理BT549细胞,6-磷酸葡糖酸内酯酶(PGLS)表达增高,6-磷酸葡糖脱氢酶(G6PD)、磷酸戊糖差向异构酶(RPE)和转酮醇酶(TKT)的基因在转录水平的表达呈不同程度降低,其余酶基因在转录水平的表达未见明显变化(Fig.4A)。而低氧处理MDA-MB-231细胞后G6PD、6-磷酸葡糖酸脱氢酶(6PGD)、磷酸戊糖异构酶(RPIA)、RPE、TKT和转醛醇酶(TALDO1)在转录水平的表达均呈不同程度降低,仅有PGLS未见明显变化(Fig.4B)。上述结果可见,虽然观察到低氧使2种TNBC细胞催化磷酸戊糖途径的酶基因在mRNA水平表达呈不同程度降低,但是在蛋白质水平检测该途径关键酶G6PD的表达却是升高的(Fig.4C),而且在低氧条件下检测磷酸戊糖途径产物NADPH的量也是增加的(Fig.4D)。这些结果提示,低氧可能通过增加关键酶G6PD蛋白质的表达促进了2种TNBC细胞磷酸戊糖途径的进行。
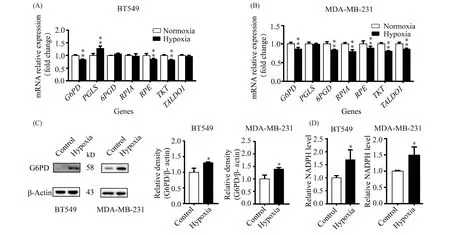
Fig.4 Hypoxia inhibits the pentose phosphate pathway in two kinds of TNBC cells (A) Normalized relative expression of pentose phosphate enzymes under normoxia and hypoxia groups of BT549 cells. (B) Normalized relative expression of pentose phosphate enzymes in normoxia and hypoxia groups of MDA- MB-231 cells (n=4). (C) Representative Western blots of G6PD in BT549 and MDA-MB-231 cells under normoxia and hypoxia, respectively. (D)NADPH levels of BT549 and MDA-MB-231 cells under normoxia and hypoxia.*P < 0.05,**P < 0.01 vs control group (n=3). Abbreviations: G6PD: glucose-6-phosphate dehydrogenase; PGLS: 6-phosphogluconolactonase; 6PGD: 6-phosphogluconate dehydrogenase; RPIA: ribose 5-phosphate isomerase A; RPE: ribulose-5-phosphate-3-epimerase; TKT: transketolase; TALDO1: transaldolase 1
2.5 低氧环境促进2种TNBC细胞的糖原合成途径
RNA-seq测序结果显示,低氧条件下,2种TNBC细胞的磷酸葡糖变位酶的PGM1同工酶、糖原合酶的GYS1同工酶和分支酶GBE1在转录水平的表达明显增加。其中,磷酸葡糖变位酶是糖原合成和糖原分解途径共用的酶(Fig.5A, B)。糖原合酶是糖原合成途径的关键酶,存在2种同工酶,在2种TNBC细胞中仅检测到GYS1同工酶的表达。低氧不仅促进2种TNBC细胞GYS1 mRNA的表达,也明显促进GYS1蛋白的表达(Fig.5C)。糖原磷酸化酶是糖原分解的关键酶,共有3种同工酶,仅检测到糖原磷酸化酶大脑同工酶(PYGB)和糖原磷酸化酶肝的同工酶(PYGL)的mRNA在2种TNBC细胞中的表达。其中,PYGL在2种低氧处理细胞中mRNA水平的表达有明显增加,而PYGB在BT549细胞中mRNA水平的表达有小幅升高,在MDA-MB-231细胞中mRNA水平表达却呈降低趋势。糖原脱支酶(AGL)在mRNA水平的表达仅在MDA-MB-231细胞中有升高(Fig.5A, B)。进一步检测了低氧条件下细胞的糖原含量。结果显示,在BT549细胞中低氧组糖原含量明显高于常氧组,而在MDA-MB-231细胞中低氧组糖原含量也有升高趋势(Fig.5D)。综合上述结果,虽然糖原合成和分解途径的酶在转录水平的表达都存在不同程度的升高,但是低氧促进糖原分解酶基因表达的幅度很小,提示低氧可能通过增加酶基因的表达促进糖原合成途径,而对糖原分解途径影响较小。
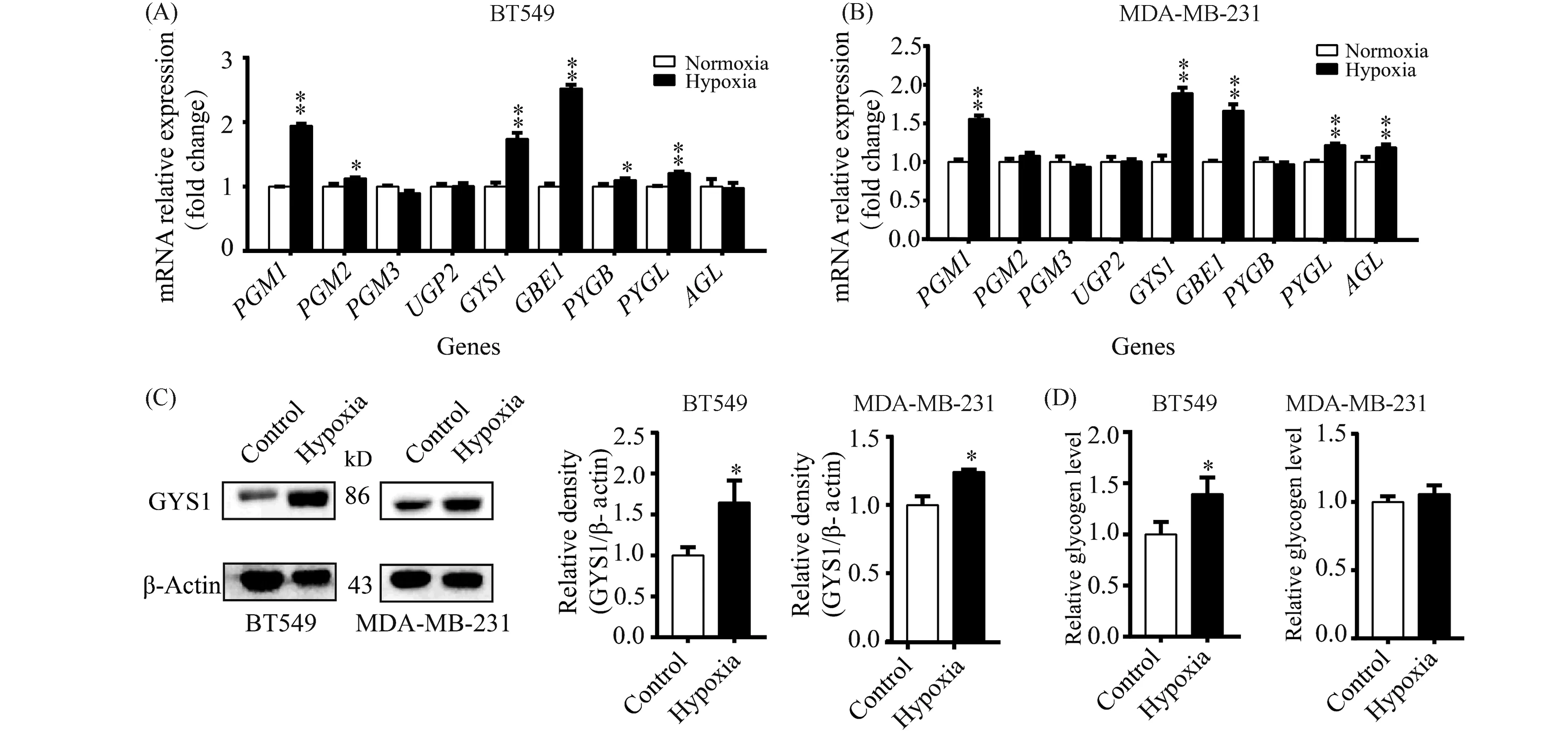
Fig.5 Hypoxia promotes the glycogen synthesis pathway of two kinds of TNBC cells (A) Normalized relative expression of glycogen synthesis and glycogen decomposition enzymes in normoxia and hypoxia groups of BT549 cells. (B) Normalized relative expression of glycogen synthesis and glycogen decomposition enzymes in normoxia and hypoxia groups of MDA-MB-231 cells (n=4). (C) Representative Western blots of GYS1 in BT549 and MDA-MB-231 cells under normoxia and hypoxia, respectively.Glycogen levels of BT549 and MDA-MB-231 cells under normoxia and hypoxia.*P < 0.05,** P < 0.01 vs control group (n=3). Abbreviations: PGM: phosphoglucomutase; UGP2: UDP-glucose pyrophosphorylase 2; GYS1: glycogen synthase 1; GBE1: glycogen branching enzyme 1; PYG: glycogen phosphorylase; AGL: amylo-alpha-1,6-glucosidase,4-alpha-glucanotransferase
2.6 糖代谢途径酶基因在乳腺癌组织中高表达
利用Oncomine数据库,分析乳腺癌患者组织标本(包括76例浸润性乳腺癌和61例正常乳腺组织)的糖代谢途径中主要酶基因mRNA表达水平变化。分析结果显示,GLUT1、ALDOA、GAPDH、PGK1、ENO2、PKM、LDHA、PCK2、PDK1、G6PD和GYS1在浸润性乳腺癌组织中的mRNA表达水平明显增强,而HK2、PFK1和PYGB表达无明显变化(Fig.6)。本文还通过Breast Cancer Gene-Expression Miner v4.8数据库,对糖代谢途径酶基因在TNBC患者中的表达进行了分析。TNBC患者与非TNBC患者相比,糖代谢酶基因GLUT1、PFK1、GAPDH、PGK1、PKM、LDHA、PDK1、G6PD、GYS1和PYGB的mRNA表达水平上调,而ALDOA、ENO2和PCK2的mRNA表达水平下调(Table 1)。上述结果显示,在转录水平上,组织样本的大多数结果与前述细胞研究结果是一致的。
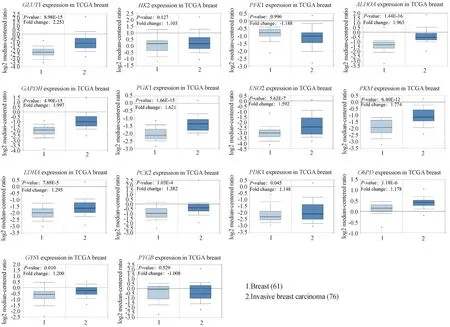
Fig.6 Expression of enzymes of glycometabolism in normal breast and breast cancer tissues Data from Oncomine to analyze the glycometabolism enzyme expression in normal breast (n=61) and invasive breast cancer tissues (n=76)
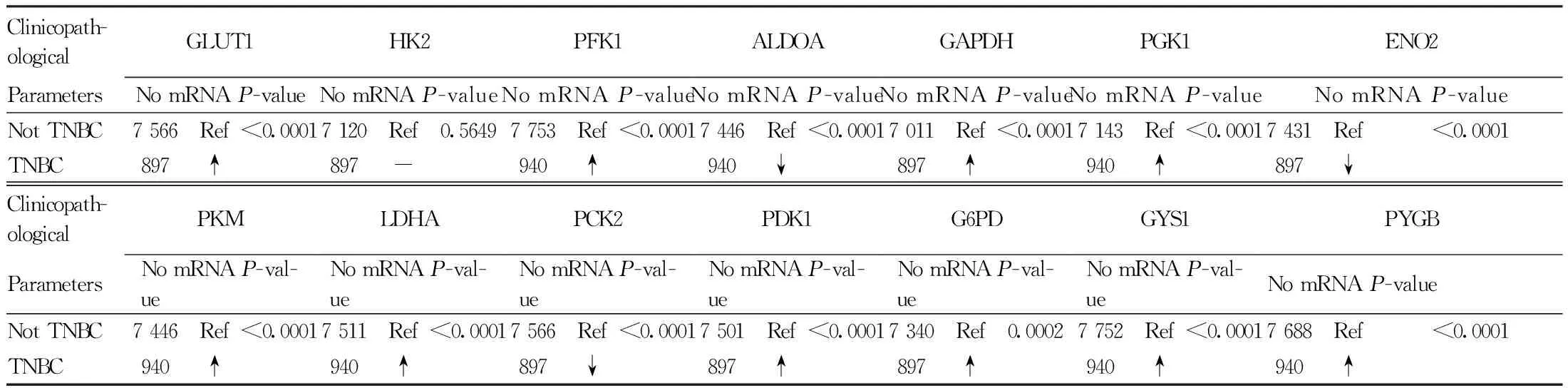
Table 1 The mRNA expression level of glycometabolic enzyme genes are higher in triple-negative breast cancer (Breast Cancer Gene-Expression Miner v4.8)
3 讨论
包括乳腺癌在内的大多数实体肿瘤细胞常处于氧供不足的环境,主要是由于肿瘤微循环的结构和功能异常引起的血流灌注不足所致,肿瘤细胞的这种低氧环境与肿瘤的发生、发展、治疗抵抗和预后不良等密切相关[5, 10]。研究发现,在乳腺癌组织中平均氧浓度低至1.5%[11]。因此,在低氧环境下培养肿瘤细胞以探究低氧对肿瘤细胞的影响机制是肿瘤研究的一种常用方式[12]。本研究应用高通量测序技术,全面地分析了低氧对BT549和MDA-MB-231细胞中催化6条糖代谢途径所有的酶(包括亚基),及其同工酶和2种重要调节酶PFKFB和PDK的同工酶在转录水平表达的影响,并且对重要的酶基因在蛋白质水平和在乳腺癌组织样本数据库中的mRNA表达水平进行了验证。
虽然现有研究已明确低氧会抑制癌细胞糖的有氧氧化,促进糖的无氧氧化、磷酸戊糖途径和糖原合成途径,使癌细胞的糖代谢发生重编程,但是这些研究均未在一种或一类细胞中,同时系统分析低氧对糖代谢这6条途径的影响,而且它们也主要分析低氧对关键酶的影响[3, 13]。其实糖代谢作为细胞最重要的物质代谢之一,糖代谢6条途径的反应步骤多,涉及的酶多,并且这些酶大多数还存在同工酶[3]。生物体内的化学反应是依靠酶催化的,酶活性决定了生化反应的速度,而酶的表达量是决定酶活性的最重要因素之一。因此,为了更详细地阐明癌细胞在低氧环境下糖代谢途径重编程的分子机制,本文检测2种TNBC细胞在低氧环境下6条糖代谢途径中所有的酶(包括组成酶的亚基)及其同工酶、糖酵解途径的重要调节酶PFKFB的4种同工酶和糖的有氧氧化途径的重要调节酶PDK的4种同工酶的表达改变。经过系统地分析,本文对低氧使糖代谢重编程有了更深入的认识。
首先,低氧使2种TNBC细胞中催化糖的无氧氧化途径每一步反应的酶都至少有一种同工酶或酶亚基的表达增加。虽然已知低氧能够促进糖的无氧氧化作用,但是已有研究都主要集中于发现低氧促进了途径中关键酶的表达,未见详细分析酶的不同基因或不同同工酶[8]。本研究发现,虽然催化糖的无氧氧化途径的酶大多数都有同工酶,但它们并不一定都会表达。只要转录水平有表达的同工酶,绝大多数在低氧条件下会增加表达。其中,只有乳酸脱氢酶B亚基(LDHB)在转录水平的表达降低,这也与其功能是相适应的。因为LDHB编码的亚基组成的乳酸脱氢酶主要催化乳酸转变为丙酮酸,而糖的无氧氧化是催化丙酮酸转变为乳酸,这步反应主要由LDHA编码亚基组成的乳酸脱氢酶催化的[14]。在低氧条件下LDHA的表达是增加的。此外,PFKFB作为通过调节磷酸果糖激酶-1来调节糖酵解途径的重要酶,它共有4种同工酶。已有研究发现,低氧会增加PFKFB3和PFKFB4的表达,与本研究结果一致。但是本研究发现,PFKFB4受低氧诱导最强,PFKFB3的mRNA基础表达量高,不过受低氧诱导作用较弱。
其次,低氧降低了三羧酸循环中重要酶在转录水平的表达。已有较多研究发现,低氧通过增强PDK1和PDK3的表达来抑制PDH的活性,以减少丙酮酸生成乙酰辅酶A进入三羧酸循环,最终抑制糖的有氧氧化途径,本文的研究结果与其一致[15, 16]。不过有意思的是,我们发现在低氧环境下,从丙酮酸脱氢酶复合体和催化三羧酸循环酶的同工酶或亚基,它们大多在转录水平的表达都呈下降趋势,特别是组成异柠檬酸脱氢酶3(IDH3)同工酶的A亚基、组成琥珀酸脱氢酶的B亚基和D亚基都明显降低。异柠檬酸脱氢酶有IDH1、IDH2和IDH3三种同工酶,IDH1和IDH2是NADP+依赖的同源二聚体异柠檬酸脱氢酶,只有IDH3是NAD+依赖的在线粒体中催化三羧酸循环反应的异柠檬酸脱氢酶[17]。它是由IDH3A、IDH3B和IDH3G三个基因编码亚基组成的异源四聚体,其中有2个亚基由IDH3A基因编码[18]。因此,如果IDH3A亚基的表达降低会导致IDH3同工酶的减少。有研究发现,琥珀酸脱氢酶的缺陷会使α-酮戊二酸的积累后导致HIF-1α蛋白的稳定以促进Warburg效应[19]。本研究发现,组成琥珀酸脱氢酶的4个亚基中有2个亚基在低氧环境下其mRNA表达水平明显降低。
最后,低氧还促进了磷酸戊糖途径和糖原合成。相对于糖的无氧氧化和有氧化化途径,低氧对于磷酸戊糖途径和糖原合成途径的研究较少。本文的结果显示,低氧小幅度地降低了2种TNBC细胞G6PD在mRNA水平的表达,但在蛋白质表达水平增加明显,特别是磷酸戊糖途径的产物NADPH也是增加的,说明低氧应该是促进了磷酸戊糖途径。至于G6PD在mRNA和蛋白质表达水平的表达不一致,仍有待进一步研究。虽然关于低氧促进糖原合成的研究不多,但是比较有趣的是,Pescador等人[20]研究发现,低氧通过增加GYS1的表达促进糖原合成。Pelletier等人[21]发现,低氧仅增加PGM1的表达促进糖原合成,而Zhu等人[22]又同时检测了低氧促进PGM1和GYS1两种酶的表达。Li等人[23]发现,低氧会增加GBE1的表达。只有我们分析了糖代谢途径中所有酶(包括同工酶)在转录水平的表达,发现低氧会在2种TNBC细胞中比较显著的同时增加PGM1、GYS1和GBE1三种酶在转录水平的表达。其中至少观察到GYS1同工酶在蛋白质水平的表达是升高的。
综上所述,肿瘤细胞代谢重编程是肿瘤细胞适应环境的一个结果,所以当实体瘤中癌细胞处于低氧环境下只能进行代谢重编程以适应环境的改变。本研究详细分析了在低氧环境下2种TNBC细胞通过改变催化糖代谢途径反应中酶的同工酶,或组成亚基的表达来使癌细胞对糖代谢进行重编程以适应低氧环境,对我们进一步认识肿瘤代谢分子机制,寻找肿瘤治疗和诊断的靶点具有一定参考价值。
