长链脂酰辅酶A合成酶家族与恶性肿瘤
2022-09-07张秀娟叶棋浓
张秀娟, 李 玲, 叶棋浓
(军事科学院军事医学研究院生物工程研究所细胞工程研究室, 北京 100850)
癌症作为严重危害人类健康的重大疾病之一,位居大部分国家30~69岁居民死因的前2位。体内糖代谢、脂代谢、氨基酸和核酸代谢功能障碍等是导致癌症的重要原因[1]。正常细胞通过循环系统中的脂质来提供能量,而肿瘤细胞能量代谢重新进行了编程,脂肪酸采用从头合成途径。脂质是油脂和类脂的总称,油脂即是油和脂肪的统称。类脂包括磷脂,糖脂和胆固醇及其酯。脂肪是由甘油和脂肪酸组成的甘油三酯。其中,甘油的分子比较简单,而脂肪酸的种类和长短却不相同。脂肪酸根据其饱和度可分为:饱和脂肪酸、单不饱和脂肪酸、多不饱和脂肪酸。根据其长短可分为:短链脂肪酸、中链脂肪酸和长链脂肪酸。在糖代谢,氨基酸代谢过程中产生的乙酰辅酶A、HCO3-(CO2)、NADPH和ATP等在脂肪酸合酶复合体的作用下合成脂肪酸。脂肪酸作为细胞膜的重要组分,在细胞的生长繁殖过程中必不可少,已经发现脂肪酸在众多的癌症中存在代谢异常。游离脂肪酸通过长链脂酰辅酶A合成酶家族(long chain acyl-coenzyme A synthetase family,ACSLs)以ATP依赖的方式转化为脂肪酸酰基辅酶A,脂肪酸酰基辅酶A进一步参与生理反应和代谢过程。目前,关于ACSLs在恶性肿瘤中的全面研究较少,本文就ACSLs家族在肿瘤中的研究进展作一综述。
1 长链脂酰辅酶A合成酶家族概述
酰基辅酶A合成酶家族有5个成员,包括:短链酰基辅酶A合成酶、中链酰基辅酶A合成酶、长链酰基辅酶A合成酶、泡泡糖酰基辅酶A合成酶(bubblegum acyl-CoA synthetases)和极长链酰基辅酶A合成酶。酰基辅酶A合成酶家族每个成员在细胞的不同位置有独特的底物偏好和酶活性。ACSLs偏好于特定的脂肪酸底物 (链长为12~20个碳原子),催化长链脂肪酸转化为具有活性的酰基辅酶A(其催化反应见Fig.1A)。ACSLs在哺乳动物中有5种亚型,分别为ACSL1、3、4、5和6[8]。它们的氨基酸组成有所不同,但都具有保守的核心AMP结合结构域(见Fig.1B),具有不同底物特异性和功能。在脂肪酸从头合成途径中,TCA循环过程中产生的柠檬酸依次被ATP柠檬酸裂解酶(ATP citrate lyase,ACLY)、乙酰辅酶A羧化酶(acetyl-CoA carboxylase,ACC)、脂肪酸合酶(fatty acid synthase,FASN)和硬脂酰辅酶A去饱和酶(stearyl-CoA desaturation enzyme,SCD)等依次催化成脂肪酸(fatty Acids,FA)。脂肪酸需要在ACSLs作用下转化为脂肪酸-CoA才能进入后续的代谢。脂肪酸-CoA被运输到线粒体,然后被脱氢、加水、再脱氢和硫解,产生1个乙酰辅酶A分子和1个新的少2个碳的酰基辅酶A,在二脂酰甘油酰基转移酶(diacylglycerol acyltransferase,DGAT)催化下,合成甘油二酯(diacylglycerol,DAG)。在甘油三酯合成过程中,糖酵解中间产物甘油醛-3-磷酸(glyceraldeyde 3-phosphate,3-PG)通过酰基甘油-3-磷酸酰基转移酶(acyl glycerol 3 phosphate acyltransferase 2,AGPAT2)和lipin-1(phosphatidate phosphatase LPIN1, lipin-1)转化为甘油二酯, 甘油二酯最终转化为三酰甘油(triacylglycerol,TAG)(反应过程见Fig.2)。ACSLs在组织细胞的代谢中发挥着重要作用,并且不同的亚型有着不同的组织分布和底物偏好性,调控不同细胞内脂肪组成。
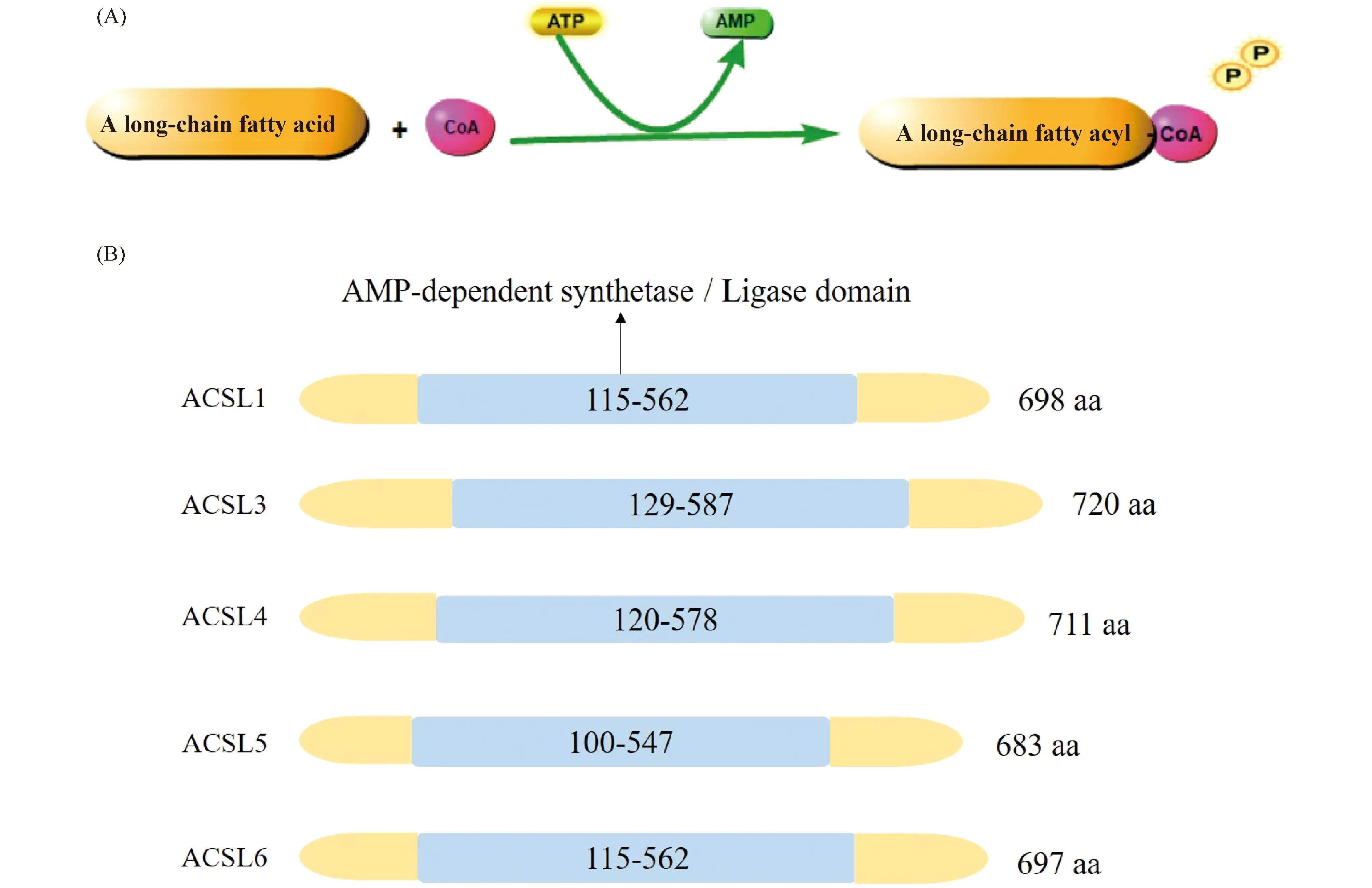
Fig.1 The function and composition of ACSLs (A) A schema for the catalytic reaction of ACSL family members. ACSLs catalyze the conversion of long-chain fatty acids to their active form acyl-CoA. (B) Five subtypes of the long chain acyl-Coenzyme A synthetase family. In mammals, there are five ACSLs (ACSL1,3,4,5 and ACSL6), which share a conserved core AMP-dependent synthetase/Ligase domain. aa, amino acids
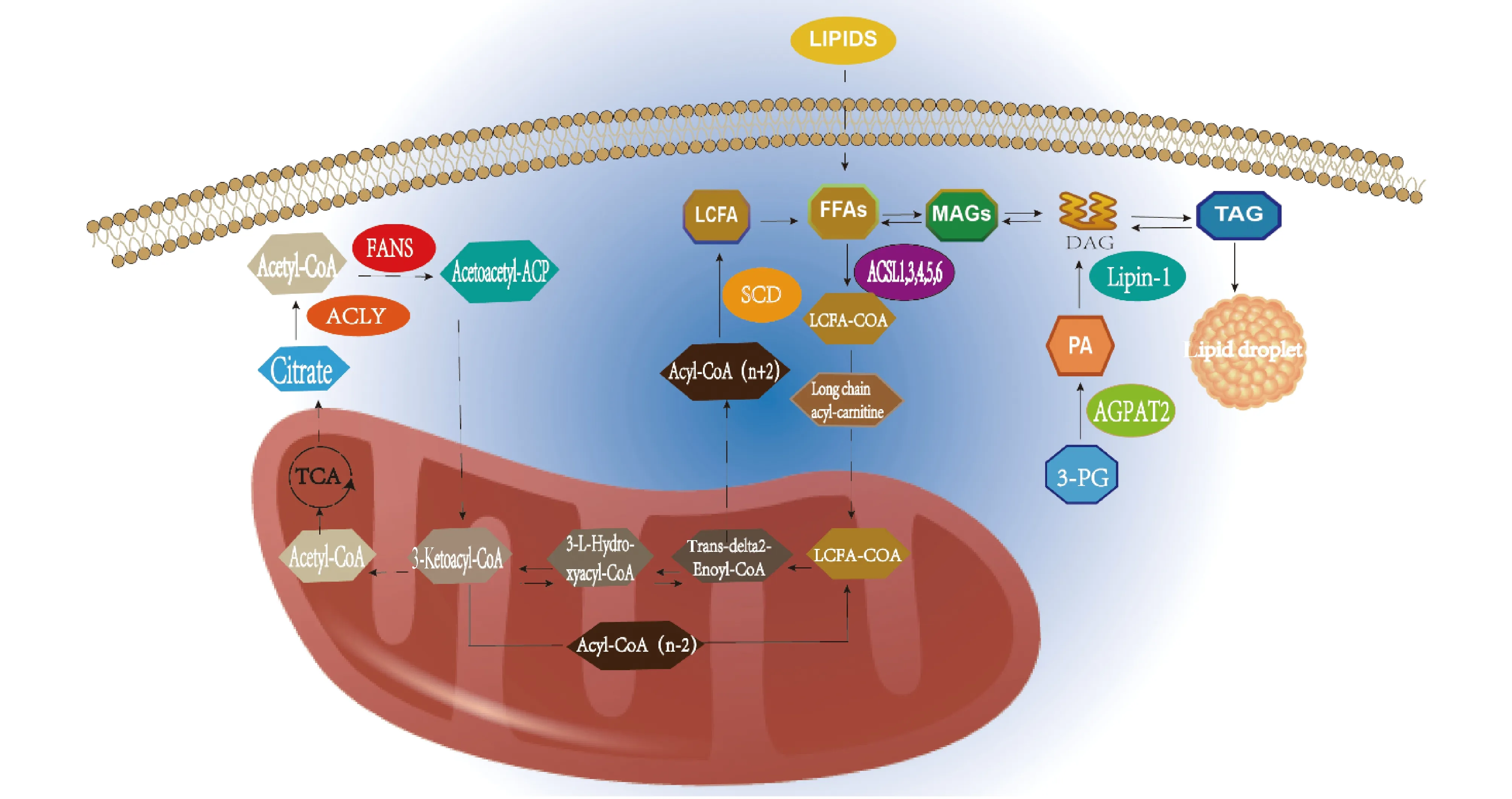
Fig.2 ACSLs and lipid metabolism In the synthesis process of fatty acids, citrate is successively catalyzed into FFAS by ACLY, FASN and SCD. LCFA needs to be converted to LCFA-CoA by ACSLs before it enters subsequent metabolism. During fatty acid oxidation, LCFA-CoA is transported to mitochondria, where it is dehydrogenated, hydrolated, dehydrogenated again and subject to thiolysis to produce a molecule of acetyl-CoA and a new acyl-CoA with two less carbons. In the process of triglyceride synthesis, the glycolytic intermediate 3-PG is converted to DAG by AGPT2 and Lipin-1, and DAG is finally converted to TAG. ACLY, ATP citrate lyase; FASN, Fatty acid synthase; SCD, Stearyl coA desaturation enzyme; LCFA, Long chain fatty acid; ACSL, long chain acyl-Coenzyme A synthetase; FFAs, Free Fatty Acids; MAGs, Monoglycerides; DAG, diacylglycerol; TAG, triacylglycerol; 3-PG, glyceraldeyde 3-phosphate; PA, Phosphoric acid; AGPAT2, Acyl glycerol 3 phosphate acyltransferase 2
2 长链脂酰辅酶A合成酶家族基因与肿瘤
2.1 ACSL1
ACSL1在脂滴、微体和线粒体中大量表达,在肝脏、心脏和脂肪组织中也广泛存在,它能使不饱和脂肪酸油酸和亚油酸水平升高,并优先使用棕榈油酸盐、油酸盐和亚油酸盐。ACSL1与脂肪酸转运蛋白(fatty acid transport protein,FATP)相互作用,促进脂肪酸的摄取和积累,与三酰基甘油积累有关。ACSL1有利于二酰甘油的合成和再酯化,不利于胆固醇的合成和氧化。ACSL1可通过肌细胞蛋白激酶(protein kinase C,PKC)的激活调节胰岛素抗性。心血管诱导敲除ACSL1后无法氧化脂肪酸,使得葡萄糖的使用增加并且抑制自噬。TANK结合激酶1(TRAF family member associated NF-κB activator-binding kinase 1,TBK1)在肝细胞中通过调控ACSL1来调控脂肪酸氧化[10]。癌蛋白乙型肝炎X相互作用蛋白(oncoprotein hepatitis B X-interacting protein,HBXIP)通过激活转录因子Sp1刺激ACSL1的调控[11]。固醇调节元件结合蛋白2 (sterol regulatory element SRE-binding protein,SREBP)在体内及体外可转录激活ACSL1[12]。在恶质病小鼠中,ACSL1下调,其提供了可能干预的肝靶点[13]。在结直肠癌中,ACSL1高表达,ACSL1过表达在结直肠癌中预示高死亡风险和复发风险增加。在肺癌中,ACSL1低表达,能够与富亮氨酸重复序列相互作用蛋白1(LRR binding flii interacting protein 1,LRRFIP1)和转化生长因子β诱导基因22结构域家族成员1(TSC22 domain family member 1,TSC22D1)共表达,ACSL1低表达与不良预后有关。在乳腺癌中,ACSL1高表达。ACSL1的高表达与不良预后相关。ACSL1在胶质瘤,透明细胞肾细胞癌(renal cell carcinoma,RCC)及病态肥胖中表达下调,其异常表达与患者预后密切相关(见Table 1)。
2.2 ACSL3
ACSL3存在于大脑、睾丸和骨骼肌中,主要在能量代谢中发挥合成代谢作用,优先选用肉豆蔻酸、月桂酸、花生四烯酸和二十碳五烯酸为底物。ACSL3是脂肪酸摄取所必需的,与γ-氨基丁酸受体相关蛋白(gamma-aminobutyric acid receptor-associated protein,GABARAPL2)相互作用,连接着类泛素化修饰(ufmylation)和脂滴生物发生。Rab蛋白是膜运输和调节周期的主要调节蛋白质,Rab18与perilipin家族蛋白2(perilipin family proteins 2,PLIN2)相互作用,并与PLIN2和ACSL3形成复合物,促进脂滴的形成[14]。肝的X受体(liver X receptors,LXR)增加了ACSL3的表达及酰基辅酶A合成酶的活性[15]。TNF-α诱导酰基辅酶A合成酶3,促进人内皮细胞脂滴形成[16]。在癌细胞中,ACSL3能够通过磷脂酰肌醇维持较高的前列腺素合成,而前列腺素的增加进一步促进癌症的发生发展,其高表达与前列腺癌患者预后不良相关。ACSL3促进软脂酸触发的成骨细胞基因表达和血管平滑肌细胞的钙沉积。ACSL3基因沉默能够抑制葡萄糖刺激的胰岛素分泌。另外,研究表明,ACSL3在肝癌中过表达,在黑色素瘤中ACSL3表达上调,在卵巢癌中表达下调,在肺癌中表达上调。ACSL3被认为可能是卵巢癌发生发展过程中潜在的抑癌基因(见Table 1)。
2.3 ACSL4
ACSL4存在于肾上腺、线粒体、大脑,结肠和内质网中,在肾上腺中高表达,在大脑中的表达定位于特定的区域,在神经元中表达,不在胶质细胞中表达。对花生四烯酸盐和二十碳五烯酸有明显的偏爱。ACSL4在肾上腺胆固醇酯的形成中发挥重要作用,缺乏ACSL4可导致胆固醇酯贮存量的减少和胆固醇酯组成的改变。ACSL4缺乏与智力迟钝、遗传性肾炎即Alport综合征相关。ACSL4通过转录因子c-Myc上调肝细胞癌(hepatocellular carcinoma,HCC)细胞中主要脂肪生成调节因子固醇调节元件结合蛋白1(sterol regulatory element binding protein 1,SREBP1)及其下游的脂肪生成酶[17]。此外,SREBP1在ACSL4介导的脂肪生成调控以及肝癌细胞增殖和转移中至关重要,因为SREBP1过表达能够挽救与ACSL4抑制相关的脂肪生成缺陷和降低的致癌能力。酪氨酸磷酸酶2(SH2 domain-containing protein-tyrosine phosphatase-2,SHP2)调节ACSL4的表达,影响细胞的类固醇生成能力[18]。过氧化物酶体增殖物激活受体δ(peroxisome proliferator activated receptor δ,PPARδ)活化诱导ACSL4在体内和体外的表达[19]。有研究表明,ACSL4表达的上调与结肠癌的发生发展有关,ACSL4高表达与结直肠癌患者的预后差相关。ACSL4在乳腺和前列腺癌细胞中的表达与性激素受体的表达呈负相关,ACSL4低表达与乳腺癌预后差相关。在人胃癌中,ACSL4的表达被下调,在人脑胶质瘤组织和细胞中表达也下调。ACSL4通过激活铁作用通路对胶质瘤细胞发挥保护和抗增殖作用,ACSL4有助于铁死亡,但其作用机制仍不清楚,可能成为治疗胶质瘤的一个新的治疗靶点。有研究通过对基因改变和临床结果进行系统分析发现,ACSL4在头颈癌、肾癌、骨髓瘤和肝癌中上调,但在膀胱癌、脑癌、白血病和肺癌中下调。数据还显示,ACSL4低表达脑癌、肺癌患者的预后差。ACSL4似乎在不同的组织中有不同的作用,ACSL4调节癌症进展的具体机制有待进一步研究[36](见Table 1)。
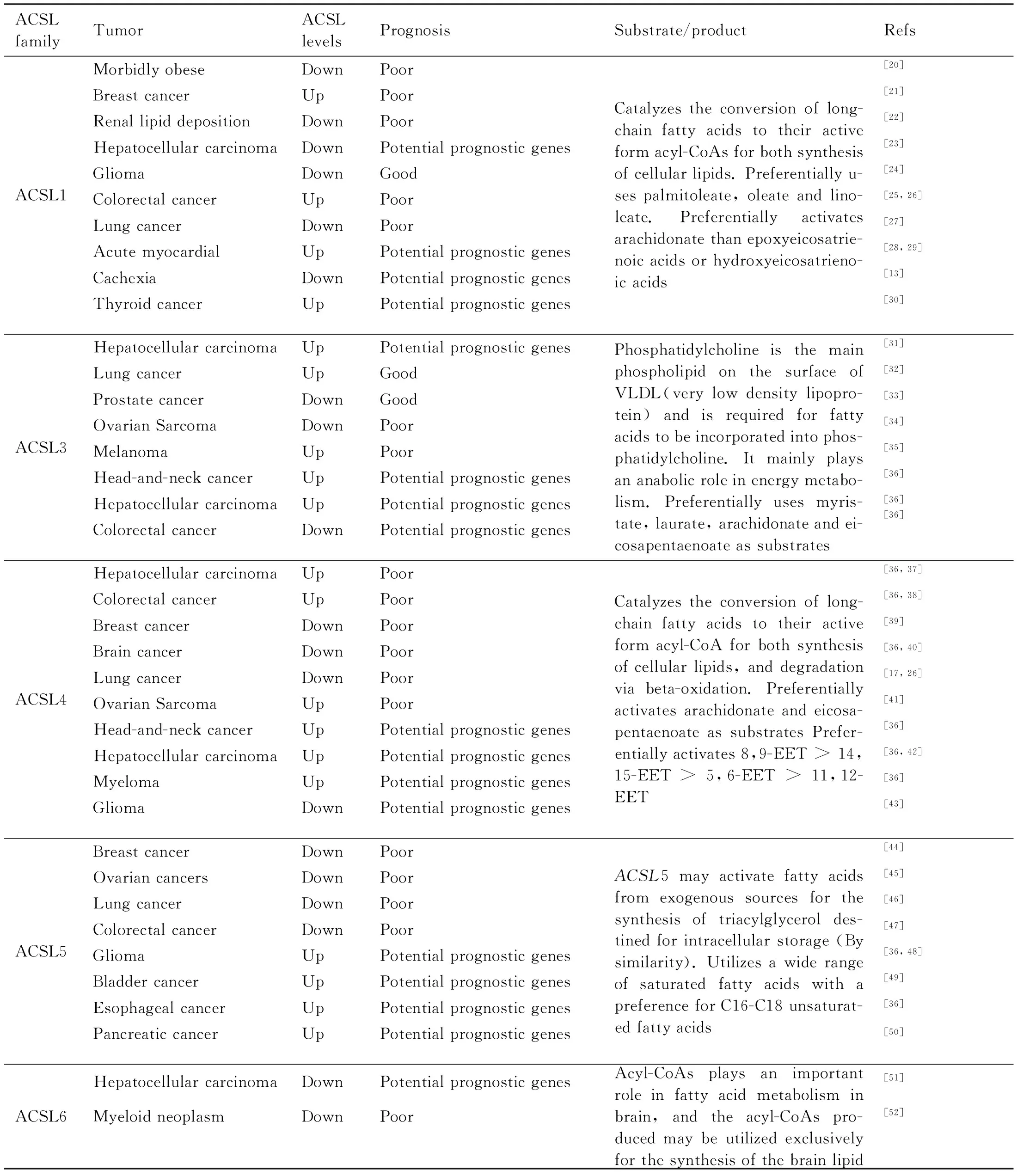
Table 1 The ACSL family and tumors
2.4 ACSL5
ACSL5存在于线粒体,在上皮细胞中高表达,能激活外源脂肪酸合成三酰基甘油并在细胞内储存,能够利用大多数的饱和脂肪酸,偏好C16~C18不饱和脂肪酸。ACSL5参与肠细胞凋亡与转录因子ONECUT2(One cut homeobox 2,OC2)协同促进肠分化和胃癌进展,可作为胃癌的早期生物标志物。目前的研究表明,ACSL5是SREBP1-c、PPARα和PPARγ等转录因子的靶基因[9]。通过对99名胰腺癌患者的全基因组表达芯片分析,ACSL5低表达患者无进展生存期(progression free survival,PFS)明显短于ACSL5高表达的患者,表明ACSL5可作为胰腺癌患者预后的潜在预后标志物。ACSL5外显子功能变异激活长链脂肪酸,参与了偏头痛的病理过程。ACSL5敲低小鼠成纤维细胞生长因子水平升高,脂肪减少,胰岛素敏感性提高,能量消耗增加。甘油三酯吸收延迟表明,ACSL5是全身能量代谢的重要调节因子,ACSL5的活性降低,可能拮抗肥胖和胰岛素抵抗的发展。ACSL5促进脂肪酸的摄取,ACSL5的上调与肝细胞脂肪变性有关,对脂肪酸诱导的肝细胞死亡敏感。ACSL5在胶质瘤中高表达,在酸性微环境中促进细胞生长。ACSL5在系统性红斑狼疮(systemic lupus erythematosus,SLE)中高表达,在系统性红斑狼疮发生的细胞凋亡中发挥作用。这表明,ACSL5可能是SLE发病机制的一个新的功能标记物和可能的治疗靶点。抑癌蛋白M通过刺激ACSL5在肝中的转录而直接降低高脂血症动物血浆中的甘油三脂。通过对基因改变和临床结果进行系统分析。结果显示,ACSL5在乳腺癌、卵巢癌、结直肠和肺癌中表达下降,ACSL5高表达预示着良好的预后(见Table 1)。
2.5 ACSL6
ACSL6存在于质膜中,在脑内高表达,对C16~C20饱和多不饱和脂肪酸表现出较高的活性,在脑内脂肪酸代谢中发挥重要作用,所产生的酰基辅酶A可专门用于脑脂的合成[53]。ACSL6与线粒体生物生成、呼吸能力和脂质氧化有关。ACSL6对精子的数量及质量有一定的影响。在分化的精子中,ACSL6高表达有助于二十二碳六烯酸(DHA,22∶6)和二十二碳五烯酸(DPA,22∶5)局部积累有助于正常精子发生,ACSL6敲除小鼠的精子数量和功能减弱,造成严重的不孕。全基因组关联研究显示,ACSL6在卵巢功能早衰发挥作用。ACSL6敲除小鼠表现出运动障碍,谷氨酸代谢改变,星形胶质细胞增多和小胶质细胞激活。精神分裂症与ACSL6的单核苷酸多态性相关。Chen等的Oncomine分析显示,ACSL6在白血病中的表达下调可作为潜在的抑癌基因,其低表达提示预后较差,在除结直肠癌以外的大多数癌症中均呈下降趋势[36](见Table 1)。
综上所述,ACSLs功能失调改变了细胞内脂肪酸的分布、种类和数量,进而导致癌症和其他代谢性疾病,例如脂肪肝、肥胖、动脉粥样硬化和糖尿病。并且在不同的癌症中,ACSLs分别发挥促癌或抑癌的作用,ACSLs还作为独立预后因素,成为各种癌症诊断和治疗的有价值的生物标志物和治疗靶点。对ACSLs在癌症中进行全面的分析具有重要意义。然而,目前仍未见全面的研究来探讨ACSLs在不同类型癌症中的表达。
3 基于长链脂酰辅酶A合成酶家族脂代谢的肿瘤靶向治疗
3.1 ACSLs的化学抑制剂
ACSLs的抑制剂TriacsinC在体内和体外均能抑制肿瘤生长,为癌症治疗提供了新的机会。但是,ACSLs保守的催化区域使得5种ACSL同工酶有冗余催化功能,抑制剂对其选择性差。例如,TriacsinC作为ACSL1、ACSL3和ACSL4的抑制剂可与脂肪酸竞争ACSLs的催化结构域。在剂量大时,TriacsinC也可作为ACSL5的竞争性抑制剂。然而,剂量大时容易对细胞造成毒性。因此,针对 ACSL 5种亚型的特异性抑制剂仍有待进一步研究。另一种可用于干扰ACSLs的方法是使用过氧化物酶体增殖激活受体(peroxisome proliferators-activated receptors ,PPARs)的拮抗剂,PPARs可转录调节ACSLs[54]。
最新研究表明,Benzimidazole可作为ACSL1的高活性抑制剂,且具有高选择性,这对调控脂质代谢具有重要意义[55]。ACSL3在维持细胞外衍生脂质与脂肪酸的氧化中发挥重要作用。推测脂肪酸的氧化抑制剂Etomoxir可能发挥着抗肿瘤的作用,但仍需要进一步验证[26]。Triclosan能通过ACSL5激活脂肪生成信号,抑制脂肪分解信号[56]。
3.2 靶向ACSLs的microRNAs
MicroRNAs (miRNAs)是内源性的非编码小RNA家族,参与多种生物过程和代谢的调控,其表达异常与癌症的发生发展密切相关。越来越多的证据表明,MicroRNAs可作为肿瘤治疗的潜在靶点。MicroRNAs与ACSL的关系在Table 2中列出。
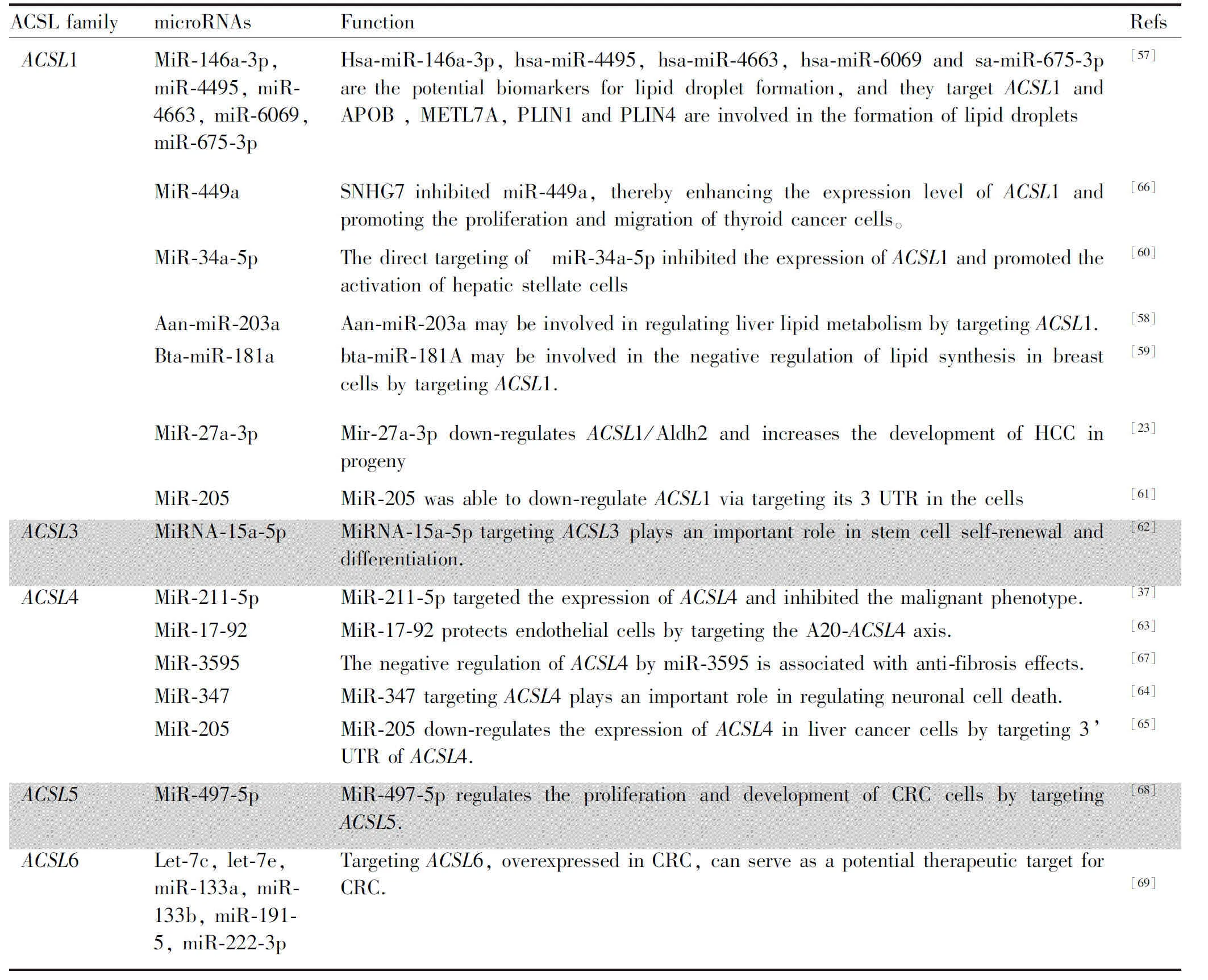
Table 2 MicroRNAs and ACSL families
MiR-146a-3p、miR-4495、miR-4663、miR-6069和miR-675-3p是脂滴形成的最新潜在生物标志物,它们靶向ACSL1参与脂滴的形成过程[57]。小核仁RNA宿主基因7(small nucleolar RNA host gene 7,NHG7)能够通过抑制miR-449a提高ACSL1的表达水平,促进甲状腺癌细胞的增殖和迁移。Aan-miR-203a[58]、bta-miR-181a[59]、miR-27a-3p[23]、miR-34a-5p[60]和miR-205[61]通过靶向ACSL1参与脂质合成的负调控,可作为治疗疾病的潜在靶点。
ACSL3作为miRNA-15a-5p的靶基因在干细胞自我更新和分化中发挥重要作用[62]。
ACSL4是miR-211-5p在HCC中的直接下游靶点,miR-211-5p在肝细胞癌组织和细胞系中表达明显下调,miR-211-5p通过抑制ACSL4的表达而抑制恶性表型[37]。miR-17-92通过靶向A20-ACSL4轴保护内皮细胞免受维拉斯汀诱导的铁蛋白作用[63]。miR-3595和miR-347[64]负调控ACSL4,在调节神经元细胞死亡中发挥重要作用。MiR-205通过靶向ACSL4的3′ UTR下调ACSL4在肝癌细胞中的表达[65]。
在结直肠癌(colorectal cancer ,CRC)患者癌组织和相邻正常组织中进行分析,ACSL5与miR-497-5p呈负相关,miR-497-5p过表达调控CRC细胞的增殖和发育。鳞状细胞肺癌(squamous cell cancer,SCC)中miR149、miR-205、miR-378、miR-422a、miR-483-5p、miR494、miR-601和miR-708过表达,CEACAM6、CGN、CLDN3、ABCC3、MLPH、ACSL5、TMEM45B和MUC1被预测为靶基因。此外,miR-27b-3p、miR-135a-5p、miR-407-5p和miR-205已被报道在转录水平抑制ACSL5[9]。
研究表明,let-7c、let-7e、miR-133a、miR-133b、miR-191-5p和miR-222-3p靶向PRPS1-2和ACSL6,在CRC中过表达,可作为CRC潜在治疗靶点。有研究表明,抑制miR-19b-1同时靶向抑制ACSL1、ACSL4和SCD1,在结直肠癌能作为潜在的治疗靶点。综上所述,脂质代谢过程中,miRNAs干预可能成为各种癌症的潜在治疗靶点(见Fig.3所示)。
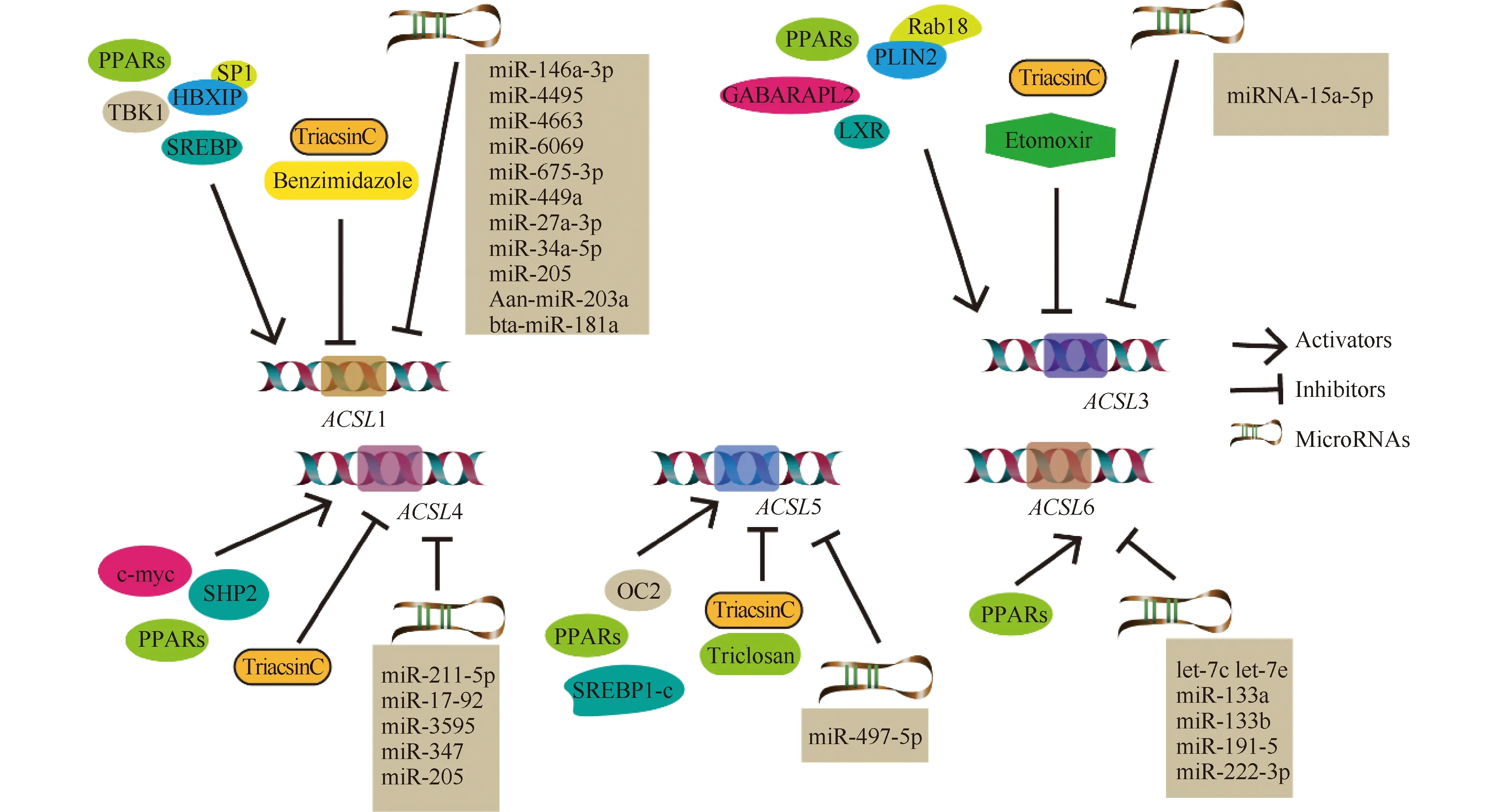
Fig.3 Regulatory mechanisms of ACSLs PPARs, peroxisome proliferator-activated receptor; HBXIP, hepatitis B interaction protein; SP1, transcription factor Sp1; SREBP, sterol regulatory element binding protein; TBK1, TRAF family member associated NF-κB activator-binding kinase 1; GABARAPL2, Gamma-aminobutyric acid receptor-associated protein; PLIN2, perilipin family proteins 2; RAB18, Member RAS Oncogene Family; LXR, liver X receptor; c-myc, myc Proto-Oncogene; SHP2, Tyrosine Phosphatase; OC2, a transcription factor
4 问题与展望
目前,基于肿瘤代谢过程的靶向治疗以及抗肿瘤药物的开发受到大量研究者的关注。目前的研究表明,ACSLs的调控因子包括转录因子和共激活因子、激素受体、蛋白激酶和非编码RNA等(见Fig.3),它们通过介导脂肪酸代谢来调控细胞的代谢过程。ACSLs作为癌症预后的独立预后因素,已成为各种癌症临床诊断和治疗的有价值的生物标志物和潜在的治疗靶点。ACSLs在不同的癌症中发挥着促癌或抑癌的作用,故针对ACSL家族特异性肿瘤治疗的抑制剂或激活剂的设计取决于肿瘤类型。目前,已有ACSLs的广泛抑制剂TriacsinC,但其特异性较差。最新的研究表明,Benzimidazole对ACSL1具有高度的选择性,Etomoxir通过作用于ACSL3发挥抗肿瘤作用。Triclosan能通过ACSL5激活脂肪生成信号,抑制脂肪分解信号,但是仍处于初步研究阶段,有待进一步验证。针对ACSL4和ACSL6的特异性抑制剂,以及ACSLs的激活剂仍有待进一步开发。miRNAs 作为一种转录后调控因子正在成为肿瘤治疗的新靶点,虽然其在对ACSLs方面的研究取得了一些进展,但是将其应用于肿瘤的诊断及靶向治疗仍有待继续研究。ACSLs在参与肿瘤细胞脂代谢过程的机制以及相关调控因子仍需要深入去研究,从而为恶性肿瘤的靶向治疗进一步提供理论依据。期望通过对ACSLs调控脂代谢机制的深入了解,更好地开发靶向药物,更有效安全的通过基因的靶向治疗控制肿瘤的发展。
