Anti-IL-12/IL-23 p40抗体对实验性自身免疫性葡萄膜炎的抑制作用及其机制
2022-09-07崔雪雪张智慧吴凌子栗勇涛陈爽陈努张晓敏
崔雪雪 张智慧 吴凌子 栗勇涛 陈爽 陈努 张晓敏
天津医科大学眼科医院 天津医科大学眼视光学院 天津医科大学眼科研究所 国家眼耳鼻喉疾病临床医学研究中心天津市分中心 天津市视网膜功能与疾病重点实验室,天津 300384
自身免疫性葡萄膜炎是一类严重威胁视力且发病机制尚不完全清楚的炎症性眼病。由CD4+T细胞功能紊乱引起的眼内炎症反应被认为在葡萄膜炎的发生和发展过程中起到关键作用。人和实验小鼠组织特异的炎症部位均有白细胞介素(interleukin,IL)-17A+γ干扰素(interferon-γ,IFN-γ)+CD4+T细胞存在,这种细胞具有低细胞毒性、高致病性以及对调节性T细胞(regulatory T cells,Treg)低敏感性等特征[1],已成为治疗多种自身免疫性疾病,如炎症性肠病(inflammatory bowel disease,IBD)、多发性硬化、类风湿关节炎、复发性葡萄膜炎的新靶点[2-5]。白细胞介素(interleukin,IL)-17A+IFN-γ+CD4+T细胞的形成是多种细胞因子作用的复杂过程,IL-12和IL-23在其中起到重要作用[6-7]。IL-12(p35和p40的异源二聚体)和IL-23(p19和p40的异源二聚体)具有共同亚基p40,针对p40亚基的单克隆抗体可以抑制IL-12R和IL-23R介导的信号转导[8-9]。Anti-IL-12/IL-23 p40单克隆抗体临床上已用于治疗慢性炎症性疾病,如银屑病、银屑病关节炎和克罗恩病,并显示出显著疗效[10-13],但其在自身免疫性葡萄膜炎患者及实验性自身免疫性葡萄膜炎(experimental autoimmune uveitis,EAU)动物模型中的作用研究较少。本研究拟探讨IL-17A+IFN-γ+CD4+T细胞在EAU发病中的动态变化,以及Anti-IL-12/IL-23 p40抗体对EAU的治疗作用及其机制。
1 材料与方法
1.1 材料
1.1.1实验动物 SPF级健康无眼疾6~8周龄C57BL/6N雌鼠66只,购自北京维通利华实验动物技术有限公司[合格证号:SCXK(京)2016-0006],饲养于天津医科大学眼科医院动物房,室温(23±2)℃,相对湿度为50%~60%,光照强度不超过300 lx,12 h昼夜规律循环。实验小鼠的喂养及使用遵循美国视觉与眼科学研究协会制定的ARVO声明,本研究方案经天津医科大学眼科医院伦理委员会批准(批文号:TJYY2019111019)。
1.1.2主要试剂及仪器 光感受器维生素A类结合蛋白(interphotoreceptor retinoid-binding protein,IRBP)651-670(上海生物工程有限公司);完全弗氏佐剂(美国Sigma公司);百日咳毒素(美国List Labs公司);CD4细胞分离试剂盒(美国英杰生命技术有限公司);EZ-press RNA纯化试剂盒(美国EZBioscience公司);FastStart Universal SYBR Green Master(瑞士Roche公司);抗鼠IL-12/IL-23 p40单克隆抗体、逆转录试剂盒(16712381,美国Thermo Fisher公司);大鼠IgG(上海赛默飞世尔科技有限公司);布雷菲德菌素A、离子霉素(美国Med ChemExpress公司);佛波酯(英国Abcam公司);抗鼠APC-CD4单克隆抗体(100412)、抗鼠PE-IL-17A单克隆抗体(506903)、抗鼠FITC-IFN-γ单克隆抗体(505806)、抗鼠Brilliant Violet 421TM-CD3单克隆抗体(100228)(美国Biolegend公司)。小动物成像仪(美国Pleasanton公司);流式细胞仪(美国BD公司);PCR仪(美国Life Technologies公司)。
1.2 方法
1.2.1EAU模型的建立 采用文献[14]的方法在小鼠的足垫部、尾根部、躯干共6个点皮下注射人IRBP 651-670(250 μg/只)和完全弗氏佐剂乳化液(200 μl/只)。免疫前及免疫后24 h分别腹腔内注射百日咳毒素0.5 μg作为附加免疫佐剂。
1.2.2流式细胞术检测EAU病程中各时间点IL-17A+IFN-γ+CD4+T细胞比例 取24只小鼠,免疫前及免疫后第3、12、18天腹腔内注射过量质量分数4%水合氯醛各处死小鼠6只。将脾脏、淋巴结研磨制备成单细胞悬浮液,脾脏用红细胞裂解液作用5 min,用磷酸盐缓冲液(phosphate buffer saline,PBS)清洗2次。眼球需先剔除晶状体,剪碎,研磨,加入1 mg/ml胶原酶D,在摇床上37 ℃孵育1 h,得到的细胞用PBS清洗2次。将细胞用1640完全培养基重悬,以1×106个/ml细胞密度接种于96孔板中。用含有佛波酯、离子霉素、布雷菲德菌素A的细胞刺激液37 ℃孵育5 h。收集细胞于流式管中,加入抗鼠APC-CD4单克隆抗体2 μl,4 ℃避光孵育30 min。PBS清洗3次,加入2 ml细胞破膜液,添加抗鼠PE-IL-17A单克隆抗体和抗鼠FITC-IFN-γ单克隆抗体各2 μl的混合液,4 ℃避光孵育30 min,PBS清洗3次。采用流式细胞仪检测样本,根据细胞体积和颗粒度,通过前向散射光和侧向散射光设门确定单核细胞,依据CD4、IL-17A、IFN-γ圈出IL-17A+IFN-γ+CD4+T细胞。
1.2.3OCT仪及小动物成像仪检测IL-17A+IFN-γ+细胞高表达组和IL-17A+IFN-γ+细胞低表达组视网膜表现 取免疫后18 d小鼠6只进行全身麻醉。采用频域光相干断层扫描(optical coherence tomography,OCT)以视盘为中心对小鼠眼底进行扫描,观察是否出现视网膜水肿、炎症细胞渗漏、视网膜脱离。采用小动物成像仪采集常规可见光眼底相,观察其斑块样、融合和线性脉络膜视网膜炎性浸润情况,以及视网膜下是否有玻璃体积血、视网膜脱离等。观察后处死小鼠,取小鼠淋巴结组织,采用流式细胞术检测淋巴结中IL-17A+IFN-γ+CD4+T细胞数量,从高到低排序,取前3位为IL-17A+IFN-γ+细胞高表达组,后3位为IL-17A+IFN-γ+细胞低表达组,比较2个组视网膜炎症程度。
1.2.4苏木精-伊红染色法观察IL-17A+IFN-γ+细胞高表达组和IL-17A+IFN-γ+细胞低表达组视网膜组织形态改变 取1.2.3部分小鼠,完整取出小鼠眼球,于体积分数10%甲醛/PBS中固定24 h,石蜡包埋,于视神经层面行5 μm厚组织切片,经苏木精-伊红染色,观察视网膜各层或玻璃体腔炎症细胞浸润、视网膜褶皱及脱离情况,以及是否出现视网膜下新生血管等。
1.2.5EAU小鼠Anti-IL-12/IL-23 p40抗体的尾静脉注射 采用随机数表法将36只小鼠随机分成Anti-IL-12/IL-23 p40组和IgG组,每组18只。免疫后第0天起,Anti-IL-12/IL-23 p40组小鼠每3天尾静脉注射1次Anti-IL-12/IL-23 p40抗体,IgG组每3天尾静脉注射1次大鼠IgG,均500 μg/只。每个时间点各组任取6只小鼠,采用流式细胞术检测免疫后12 d淋巴结中IL-17A+IFN-γ+细胞表达情况,以及免疫后18 d眼球中IL-17A+IFN-γ+细胞、CD3细胞表达情况。免疫后第24天,取剩余小鼠眼球制作苏木精-伊红染色切片观察视网膜损伤情况。
1.2.6EAU模型小鼠眼部视网膜表现评分 Anti-IL-12/IL-23 p40组和IgG组小鼠从免疫后第10天起每隔1 d扩瞳后使用直接检眼镜进行眼底检查,根据Caspi分级标准对视网膜表现进行评分:正常眼底为0分;视网膜中央出现局灶性损伤<3处为0.5分;视网膜周边和中央出现<5处但≥1处局灶性损伤为1分;弥漫性视网膜脉络膜损伤,有>5处局灶性损伤,且<5处线性损伤为2分;大的融合性视网膜脉络膜损伤,视网膜水肿,且有大量局灶性损伤和线性损伤为3分;出现大范围视网膜脱离为4分[15]。
1.2.7流式细胞术检测CD4+T细胞的体外诱导分化情况 采用CD4细胞分离试剂盒行磁珠分选,将免疫前小鼠脾脏、腹股沟淋巴结经研磨后置于红细胞裂解液中作用5 min,每1×107细胞中加入20 μl抗体混合物,4 ℃孵育20 min,隔离缓冲液冲洗1次,添加200 μl提前洗好的阴选磁珠,在摇床上轻摇,室温孵育15 min,置于磁铁上2 min,收集的悬浮液即为CD4+T细胞。实验前一晚在96孔板上铺平板结合型抗鼠CD3(10 μg/ml)抗体,4 ℃孵育过夜。取分离的CD4+T细胞以每孔2×105细胞种在96孔板中,用可溶性CD28(2.5 μg/ml)激活细胞。将细胞分为Anti-IL-2/IL-23 p40组和IgG组,分别加入Anti-IL-12/IL-23 p40抗体(10 ng/ml)和IgG(10 ng/ml),并用细胞因子诱导细胞分化。Th1分化条件为IL-12(60 ng/ml)和anti-IL-4(300 ng/ml);Th17细胞分化条件为转化生长因子(transforming growth factor,TGF)-β(5 ng/ml)、IL-6(10 ng/ml)和IL-23(10 ng/ml);IL-17A+IFN-γ+细胞分化条件为IL-12(1 ng/ml)、TGF-β(5 ng/ml)、IL-23(10 ng/ml)和IL-6(10 ng/ml)。取细胞悬液200 μl/孔,在37 ℃、体积分数5% CO2孵箱中培养4 d,收集上清及细胞,采用流式细胞术检测2个组Th1细胞、Th17细胞和IL-17A+IFN-γ+T细胞诱导分化情况,将剩余的上清液及细胞储存于-80 ℃备用。
1.2.8酶联免疫吸附测定法定量检测IL-17A+IFN-γ+CD4+T细胞诱导分化后Anti-IL-2/IL-23 p40组和IgG组IL-17和IFN-γ表达情况 取1.2.7中Anti-IL-2/IL-23 p40组和IgG组细胞上清,按照鼠IL-17和鼠IFN-γ酶联免疫吸附测定(enzyme-linked immunosorbent assay,ELISA)试剂盒说明书进行检测,将捕获抗体铺在96孔板上,4 ℃孵育过夜,用试剂稀释剂封闭1 h。加细胞上清液和小鼠重组IFN-γ标准品,室温孵育2 h后加入生物素化的山羊抗小鼠IFN-γ抗体,室温孵育2 h后加入链霉亲和素室温避光孵育20 min,加入显色剂在室温下孵育20 min。加入终止液,于酶标仪上定量检测波长540 nm或570 nm处各组IL-17和IFN-γ表达水平。
1.2.9实时荧光定量PCR法检测诱导分化后Th1细胞和Th17细胞转录因子的相对表达量 取1.2.7中Anti-IL-2/IL-23 p40组和IgG组细胞,用EZ-press RNA纯化试剂盒提取细胞mRNA。采用逆转录试剂盒将mRNA逆转录成cDNA,进行PCR扩增。引物均购自天津金唯智生物科技有限公司。T-bet正向引物序列为5'-TCACTAAGCAAGGACGGCGAATGTT-3',反向引物序列为5'-GGACATATAAGCGGTTCCCTGGCAT-3';维甲酸相关孤核受体γt(retinoid-related orphan nuclear receptor γt,ROR-γt)正向引物序列为5'-ACCTCTTT TCACGGGAGGA-3',反向引物序列为5'-TCCCACAT CTCCCACATTG-3'。GAPDH正向引物序列为5'-GCACCGTCAAGGCTGAGAAC-3',反向引物序列为5'-TGGTGAAGACGCCAGTGGA-3'。PCR反应条件:95 ℃预变性30 s,95 ℃变性30 s,60 ℃退火30 s,共40个循环。以GAPDH为内参,采用2-ΔΔCt法计算各组Th1细胞转录因子T-bet和Th17细胞转录因子ROR-γt表达情况。每组设置3个样本,每个样本设3个复孔。
1.3 统计学方法
2 结果
2.1 EAU小鼠免疫前后不同时间点脾脏、淋巴结、眼球组织中IL-17A+ IFN-γ+ CD4+ T细胞比例比较
流式细胞术检测结果显示,免疫前和免疫后第3、12、18天淋巴结、脾脏、眼球中IL-17A+IFN-γ+CD4+T细胞比例总体比较差异均有统计学意义(H=9.642、16.531、10.385,均P<0.05),其中与免疫前相比,免疫后第12天,淋巴结中IL-17A+IFN-γ+CD4+T细胞比例明显增多,免疫后第18天,脾脏、眼球中IL-17A+IFN-γ+CD4+T细胞比例明显增多,差异均有统计学意义(均P<0.05)(图1,表1)。
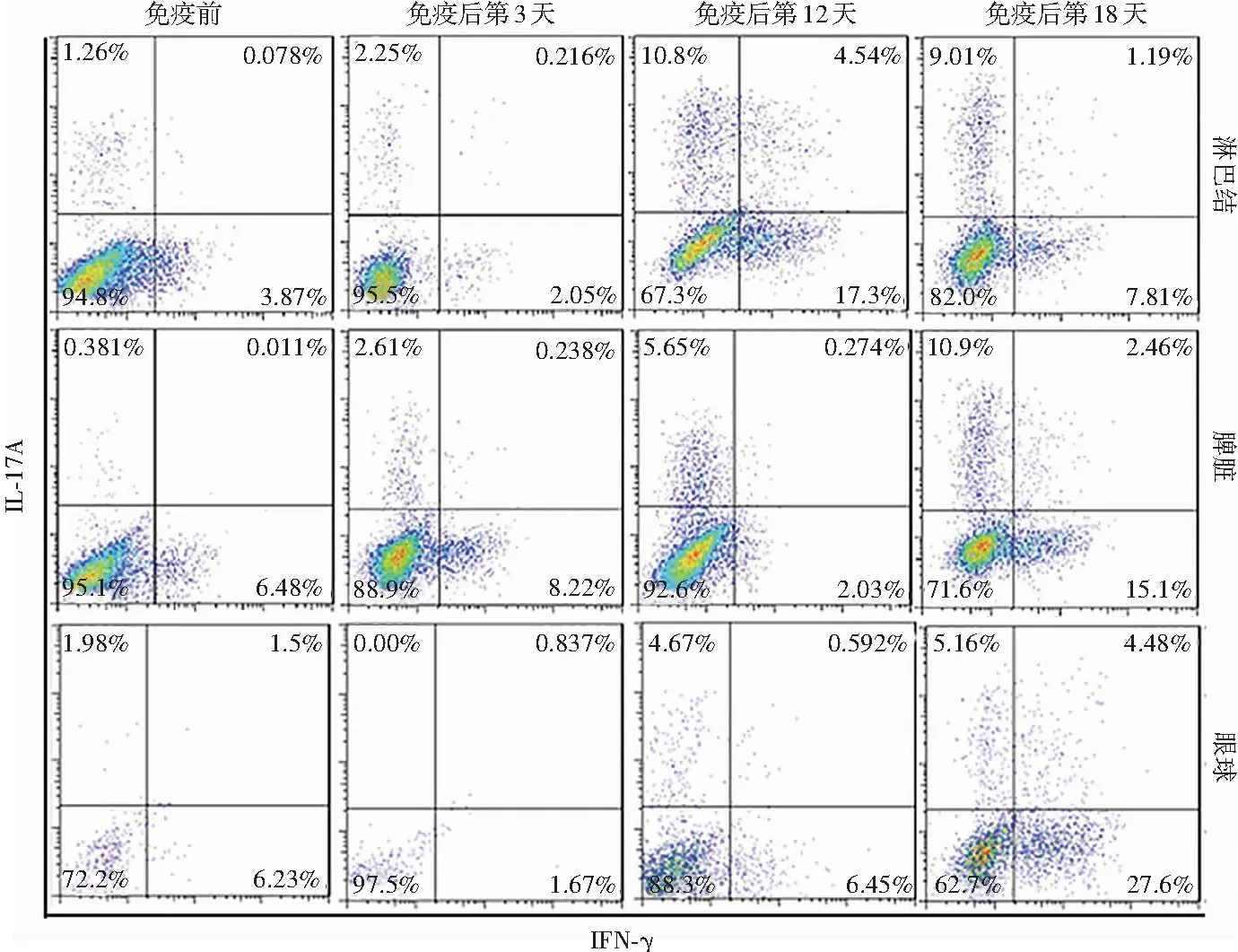
图1 流式细胞术检测IL-17A+ IFN-γ+ CD4+ T细胞在免疫前及免疫后不同时间点EAU小鼠不同组织中表达比例 与免疫前相比,免疫后第12天,淋巴结中IL-17A+ IFN-γ+ CD4+ T细胞比例明显增多,免疫后第18天,脾脏、眼球中IL-17A+ IFN-γ+ CD4+ T细胞比例明显增多 IL:白细胞介素;IFN-γ:γ干扰素
2.2 IL-17A+ IFN-γ+高表达组与IL-17A+ IFN-γ+低表达组小鼠视网膜炎症程度比较
眼底照相结果显示,IL-17A+IFN-γ+高表达组眼底可见大片状融合性视网膜脉络膜损伤,视网膜水肿,且有大量局灶性损伤和线性损伤;IL-17A+IFN-γ+低表达组眼底呈现弥漫性视网膜脉络膜损伤(图2)。OCT结果显示,IL-17A+IFN-γ+高表达组视网膜水肿、大量炎症细胞渗漏和视网膜脱离;IL-17A+IFN-γ+低表达组视网膜轻度水肿,少量炎症细胞渗漏(图3)。苏木精-伊红染色结果显示IL-17A+IFN-γ+高表达组视网膜各层及玻璃体腔大量炎性细胞浸润、视网膜高度褶皱及大面积视网膜脱离,视网膜各层分界不清;IL-17A+IFN-γ+低表达组视网膜各层及玻璃体腔有少量炎性细胞浸润,视网膜中度褶皱,视网膜各层分界清晰(图4)。

图2 IL-17A+ IFN-γ+高表达组与IL-17A+ IFN-γ+低表达组小鼠眼底照相 IL-17A+ IFN-γ+高表达组小鼠眼底可见大片状融合性视网膜脉络膜损伤,表现为严重的视网膜水肿,同时可见多个局灶性视网膜脉络膜损伤和线性损伤;IL-17A+ IFN-γ+低表达组眼底呈现弥漫性视网膜脉络膜损伤 A:IL-17A+ IFN-γ+高表达组 B:IL-17A+ IFN-γ+低表达组

图3 IL-17A+ IFN-γ+高表达组与IL-17A+ IFN-γ+低表达组小鼠眼底OCT图像 IL-17A+ IFN-γ+高表达组小鼠视网膜水肿增厚;可见大量炎性细胞渗漏和视网膜脱离;与IL-17A+ IFN-γ+高表达组小鼠比较,IL-17A+ IFN-γ+低表达组视网膜轻度水肿,少量炎性细胞渗漏 A:IL-17A+ IFN-γ+高表达组 B:IL-17A+ IFN-γ+低表达组

图4 IL-17A+ IFN-γ+高表达组与IL-17A+ IFN-γ+低表达组小鼠视网膜组织病理图(HE ×100,标尺=100 μm) IL-17A+ IFN-γ+高表达组视网膜各层及玻璃体腔大量炎性细胞浸润、视网膜高度褶皱及大面积视网膜脱离,视网膜各层分界不清;IL-17A+ IFN-γ+低表达组视网膜各层及玻璃体腔有少量炎性细胞浸润,视网膜中度褶皱,视网膜各层分界清晰 A:IL-17A+ IFN-γ+高表达组 B:IL-17A+ IFN-γ+低表达组
2.3 Anti-IL-12/IL-23 p40组与IgG组视网膜表现评分及炎症情况比较
IgG组和Anti-IL-12/IL-23 p40组不同时间点视网膜表现评分总体比较差异均有统计学意义(F组别=15.045,P=0.03;F时间=99.764,P<0.01),其中免疫后第12、14、16、18、20、22、24天视网膜表现评分均低于IgG组,差异均有统计学意义(均P<0.01)(表2)。
苏木精-伊红染色结果显示,IgG组视网膜出现重度炎性细胞浸润及广泛视网膜褶皱伴脱离。Anti-IL-12/IL-23 p40组视网膜各层出现中度炎症细胞浸润及中度视网膜褶皱(图5)。

图5 IgG组和Anti-IL-12/IL-23 p40组视网膜组织病理改变(HE ×100,标尺=100 μm) A:IgG组视网膜各层分界不清,出现重度炎症细胞浸润,广泛的视网膜褶皱伴脱离 B:Anti-IL-12/IL-23 p40组视网膜各层出现中度炎症细胞浸润,中度视网膜褶皱 图6 免疫后不同时间点2个组IL-17A+ IFN-γ+ CD4+ T细胞比例比较 A:各组免疫后第18天眼球CD3细胞表达情况 与IgG组相比,aP<0.01(独立样本t检验,n=9) B、C:各组免疫后第18天眼球IL-17A+ IFN-γ+ CD4+ T细胞比例流式细胞分析(B)及量化比较(C) 与IgG组相比,aP<0.05(独立样本t检验,n=6) D、E:各组免疫后第12天淋巴结IL-17A+ IFN-γ+ CD4+ T细胞比例流式细胞分析(D)及量化比较(E) 与IgG组比较,aP<0.05(独立样本t检验,n=6) IL:白细胞介素;IFN-γ:γ干扰素
流式细胞术检测结果显示,Anti-IL-12/IL-23 p40组免疫后第18 d眼球中CD3+细胞和IL-17A+IFN-γ+CD4+T细胞比例分别为(13.58±4.70)%和(1.52±0.29)%,分别低于IgG组的(90.11±8.07)%和(4.95±0.68)%,差异均有统计学意义(t=15.304、8.080,均P<0.05)。免疫后第12 d Anti-IL-12/IL-23 p40组淋巴结中IL-17A+IFN-γ+CD4+T细胞比例为(0.33±0.18)%,低于IgG组的(4.83±0.45)%,差异有统计学意义(t=15.974,P<0.001)(图6)。
2.4 2个组Th1、Th17和IL-17A+ IFN-γ+ CD4+ T细胞分化比例、IL-17A和IFN-γ及其转录因子表达量比较
流式细胞术检测结果显示,与IgG组相比,Anti-IL-12/IL-23 p40组Th1、Th17、IL-17A+IFN-γ+CD4+T细胞百分比明显降低,差异均有统计学意义(t=22.876、0.634、7.025,均P<0.01(表3)。ELISA检测结果显示,与IgG组相比,Anti-IL-12/IL-23 p40组IL-17和IFN-γ质量浓度明显降低,差异均有统计学意义(t=9.580、46.412,均P<0.001)(表4)。实时荧光定量PCR结果显示,Anti-IL-12/IL-23 p40组T-bet、ROR-γt mRNA相对表达量明显低于IgG组,差异均有统计学意义(t=6.097、7.526,均P<0.05)(表5)。

表2 免疫后不同时间点2个组视网膜表现评分比较(x±s,分)Table 2 Comparison of retinal scores between two groups at different time points after immunization (x±s,score)组别样本量免疫后不同时间点视网膜表现评分第10天第12天第14天第16天第18天第20天第22天第24天IgG组60.08±0.200.83±0.411.67±0.522.33±0.412.83±0.522.67±0.412.08±0.381.75±0.27Anti-IL-12/IL-23 p40组60.00±0.000.17±0.26a0.83±0.41a1.67±0.41a2.08±0.38a2.00±0.45a1.50±0.45a1.17±0.41a 注:F组别=15.045,P=0.03;F时间=99.764,P<0.01.与各自时间点IgG组比较,aP<0.01(重复测量两因素方差分析,SNK-q检验) IL:白细胞介素 Note:Fgroup=15.045,P=0.03;Ftime=99.764,P<0.01.Compared with IgG group at corresponding time points,aP<0.01 (Two-way repeated measures ANOVA,SNK-q test) IL:interleukin
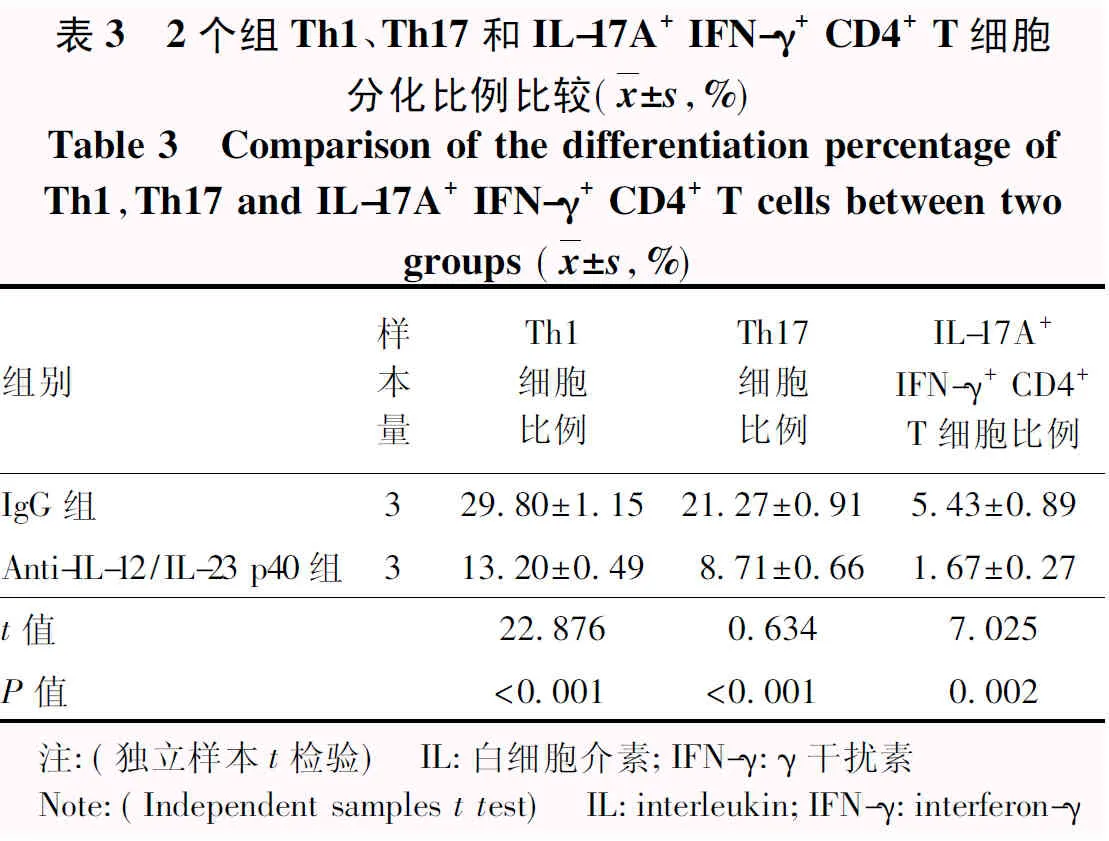
表3 2个组Th1、Th17和IL-17A+ IFN-γ+ CD4+ T细胞分化比例比较(x±s,%)Table 3 Comparison of the differentiation percentage ofTh1,Th17 and IL-17A+ IFN-γ+ CD4+ T cells between twogroups (x±s,%)组别样本量Th1细胞比例Th17细胞比例IL-17A+IFN-γ+ CD4+T细胞比例IgG组329.80±1.1521.27±0.915.43±0.89Anti-IL-12/IL-23 p40组313.20±0.498.71±0.661.67±0.27t值 22.8760.6347.025P值<0.001<0.0010.002 注:(独立样本t检验) IL:白细胞介素;IFN-γ:γ干扰素 Note:(Independent samples t test) IL:interleukin;IFN-γ:interfer-on-γ

表4 2个组IL-17A和IFN-γ质量浓度比较(x±s,pg/ml)Table 4 Comparison of IL-17A和IFN-γ concentrationbetween two groups (x±s,pg/ml)组别样本量IL-17AIFN-γIgG组347.28±4.77794.67±8.08Anti-IL-12/IL-23 p40组318.08±3.80399.33±12.34t值9.58046.412P值<0.001<0.001 注:(独立样本t检验) IL:白细胞介素;IFN-γ:γ干扰素 Note:(Independent samples t test) IL:interleukin;IFN-γ:interfer-on-γ
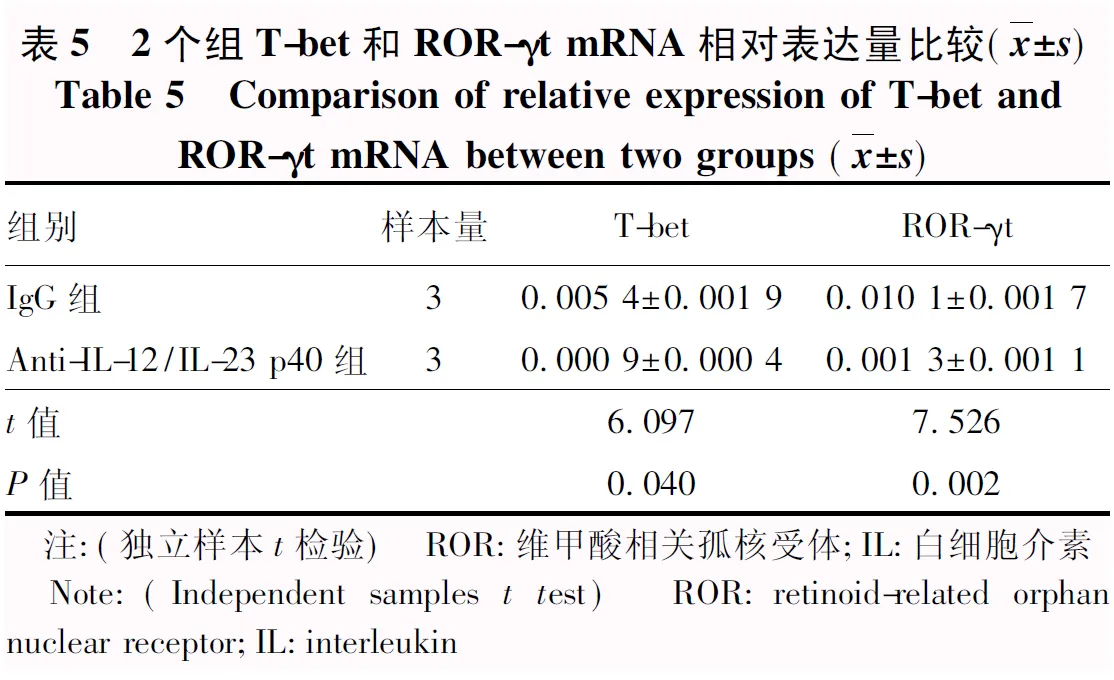
表5 2个组T-bet和ROR-γt mRNA相对表达量比较(x±s)Table 5 Comparison of relative expression of T-bet andROR-γt mRNA between two groups (x±s)组别样本量T-betROR-γtIgG组30.005 4±0.001 90.010 1±0.001 7Anti-IL-12/IL-23 p40组30.000 9±0.000 40.001 3±0.001 1t值6.0977.526P值0.0400.002 注:(独立样本t检验) ROR:维甲酸相关孤核受体;IL:白细胞介素 Note:(Independent samples t test) ROR:retinoid-related orphan nuclear receptor;IL:interleukin
3 讨论
IL-17A+IFN-γ+CD4+T细胞具有很强的致病性[16]。在体内和体外实验中,IL-17A+IFN-γ+CD4+T细胞可优先穿过人血-脑屏障,且在实验性自身免疫性脑脊髓炎(experimental autoimmune encephalomyelitis,EAE)模型中,IL-17A+IFN-γ+CD4+T细胞可在小鼠发病的效应期内在中枢神经系统中积存[17]。
本研究发现,在EAU免疫第3天各类组织IL-17A+IFN-γ+CD4+T细胞浸润均很少,随着疾病进展IL-17A+IFN-γ+CD4+T细胞不断增多,免疫第12天引流淋巴结中IL-17A+IFN-γ+CD4+T细胞显著增多,而眼球和脾脏中IL-17A+IFN-γ+CD4+T细胞则于EAU免疫第18天达峰值。以上结果表明,在EAU模型诱导的第12天左右,引流淋巴结中的免疫反应被激活,淋巴结中出现大量IL-17A+IFN-γ+CD4+T细胞,同时外周免疫组织中的IL-17A+IFN-γ+CD4+T细胞开始循环,浸润到脾脏、眼特异的炎症组织部位,因此免疫第12天以后,随着疾病进程的加剧,淋巴结中IL-17A+IFN-γ+CD4+T细胞减少,而脾脏和眼球中IL-17A+IFN-γ+CD4+T细胞逐渐增多。陈爽等[18]研究EAU模型小鼠视网膜表现评分,发现炎症起始于造模后第9~12天,炎症高峰期为造模后第16~18天。本研究表明,眼球中IL-17A+IFN-γ+CD4+T细胞于炎症起始期开始出现,于炎症高峰期达峰值。此外,本研究发现EAU进程中IL-17A+IFN-γ+CD4+T细胞占比多的小鼠眼球视神经层面病理切片、视网膜影像图显示发病更重。因此,本研究推断IL-17A+IFN-γ+CD4+T细胞多,表明EAU发病更重。
IL-12和IL-23共有p40亚基的单克隆抗体可以抑制IL-12R和IL-23R介导的信号转导,因此p40亚基对IL-17A+IFN-γ+CD4+T细胞的形成有重要作用。本研究试图通过中和IL-12/IL-23信号,抑制IL-17A+IFN-γ+CD4+T细胞的分化,探讨其对EAU进程的作用。本研究结果表明,EAU模型小鼠尾静脉注射Anti-IL-12/IL-23 p40抗体后,Anti-IL-12/IL-23 p40组小鼠的视网膜表现评分及视网膜损害表现均减轻,包括炎症细胞浸润数量、视网膜褶皱数量、视网膜脉络膜新生血管数量和视网膜脱离面积均减少,且第18天眼球中CD3细胞比例也明显低于对照组。本研究进一步通过体外实验来验证Anti-IL-12/IL-23 p40对T细胞炎性因子的作用。CD4+T细胞诱导分化实验中,与IgG组相比,Anti-IL-12/IL-23 p40组可明显抑制CD4+T细胞群中Th1、Th17、IL-17A+IFN-γ+CD4+T细胞的分化,表明Anti-IL-12/IL-23 p40可以通过抑制小鼠体内IL-17A+IFN-γ+CD4+T细胞的浸润减轻EAU模型小鼠的眼部及病理表现,并延迟EAU的发生。本研究更进一步探讨了Anti-IL-12/IL-23 p40对EAU治疗作用的具体机制。T-bet和RoR-γt分别是Th1和Th17细胞独特的转录因子。本研究发现,Anti-IL-12/IL-23 p40能分别使IL-17A+IFN-γ+CD4+T细胞T-bet、ROR-γt基因表达减少。因此,本研究推断Anti-IL-12/IL-23 p40对EAU的治疗作用部分可能是通过抑制Th1、Th17转录因子T-bet、ROR-γt表达,从而抑制IL-17A+IFN-γ+CD4+T细胞分化来实现的。但本研究未检测其他相关基因的变化,我们将在接下来研究中进一步验证。
在IBD实验模型中,Th17细胞向IL-17A+IFN-γ+CD4+T细胞转变需要T-bet和STAT4的表达[2]。同样在EAE模型中研究表明,由转录因子T-bet、Runx1和Runx3来启动Th17细胞向IL-17A+IFN-γ+CD4+T细胞分化。Chen等[19]采用干眼小鼠模型证实IL-17A+IFN-γ+CD4+T细胞群来自Th17前体并发挥致病作用。然而,一项新的研究证明Th1细胞能够在TGF-β和IL-6的影响下转分化为Th17细胞,上调RUNX1的表达,增加ROR-γt启动子中RunX1结合位点以及IL-17启动子中RunX1和ROR-γt结合位点的可及性[20-22]。因此,目前还没有明确向IL-17A+IFN-γ+CD4+T细胞分化的路线,或者这个亚群是否代表稳定的CD4+T细胞亚群。本研究中,虽然Anti-IL-12/IL-23p40能有效减轻EAU的眼部病理变化,但并未被完全抑制,我们认为是Anti-IL-12/IL-23 p40治疗后仍存在IL-17A+IFN-γ+CD4+T细胞所致。
IL-17A+IFN-γ+CD4+T细胞在EAU中的升高可被认为是生物制剂的一个选择性靶点。未来我们希望诱导产生IL-17A+IFN-γ+CD4+T细胞,以在过继转移疾病实验中评估其诱发疾病的能力,相信采用生物制剂靶向IL-17A+IFN-γ+CD4+T细胞的可塑性将为未来潜在的葡萄膜炎治疗策略提供有价值的工具。
利益冲突所有作者均声明不存在利益冲突
作者贡献声明崔雪雪:直接参与选题、酝酿和设计实验、实施研究、采集数据、分析/解释数据、起草文章;张智慧、吴凌子、栗勇涛、陈爽、陈努:直接参与选题、酝酿和设计实验;张晓敏:直接参与选题、对文章知识性内容的审阅和智力性内容的修改及定稿
