RMT1-10体外诱导耐受性树突状细胞对小鼠高危角膜移植排斥反应的抑制作用及其机制
2022-09-07赵敏杨柳清王梦宇陶钰郭永越苏锐锋石晶谭小波
赵敏 杨柳清 王梦宇 陶钰 郭永越 苏锐锋 石晶 谭小波
1承德医学院附属医院眼科,承德 067000;2承德市中心医院眼科,承德 067000
角膜移植是治疗角膜盲的有效方式,但高危角膜移植的排斥反应发生率超过70%,寻找诱导受体产生对供体的抗原特异性免疫耐受策略对防治角膜移植排斥反应具有重大意义[1]。近年来,T细胞免疫球蛋白和黏蛋白结构域分子1(T cell immunoglobulin and mucin domain containing molecule-1,Tim-1)在角膜移植排斥反应中的作用受到研究者的关注。马明等[2]研究证实Tim-1表达在活化的T细胞表面,通过提高正性共刺激信号促进T细胞活化增生以及相应细胞因子产生,最终促进角膜移植排斥反应发生。本课题组前期研究发现,Tim-1的阻断抗体RMT1-10可以诱导受体形成免疫耐受并抑制角膜移植排斥反应发生,但其作用机制尚未完全明确[3]。研究发现,如果在致敏阶段未成熟树突状细胞(immature dendritic cells,imDCs)暴露于抗原时抑制其表达主要组织相容性复合物(major histocompatibility complex,MHC)或共刺激分子可以使其转化为耐受性树突状细胞(tolerogenic dendritic cells,Tol-DCs),而Tol-DCs可以在免疫反应过程中保持其未成熟表型并通过减少抗原提呈、降低促炎细胞因子、增加调节性T细胞(regulatory T cells,Tregs)等机制诱导形成免疫耐受,因此Tol-DCs也被认为是抑制角膜移植排斥反应的有力工具[4-7]。作为共刺激分子家族的重要一员,Tim-1不仅分布于活化的CD4+T细胞表面,也分布于DCs表面,推测RMT1-10阻断Tim-1信号可能促使imDCs转化为Tol-DCs,诱导免疫耐受并抑制角膜移植排斥反应。本研究拟探讨RMT1-10体外诱导的Tol-DCs对小鼠高危角膜移植排斥反应的抑制作用及其机制。
1 材料与方法
1.1 材料
1.1.1实验动物 SPF级雄性BALB/c小鼠100只和C57BL/6小鼠50只,体质量18~22 g,购于北京华阜康生物科技股份有限公司,实验动物的饲养和使用符合国家科学技术委员会颁布的《实验动物管理条例》。本研究方案经承德医学院附属医院伦理委员会审核批准(批文号:CYFYLL2020055)。
1.1.2主要试剂及仪器 重组小鼠粒细胞-巨噬细胞集落刺激因子(recombinant mouse granulocyte-macrophage colony stimulating factor,rmGM-CSF)、重组小鼠白细胞介素4(recombinant mouse interleukin-4,rmIL-4)、FITC标记的抗鼠CD11c抗体、PE标记的抗鼠MHC-Ⅱ、CD80、CD86、Tim-4、CD103抗体(美国eBioscience公司);脂多糖、Tris-NH4Cl(美国Sigma公司);RPMI1640培养液、胎牛血清(美国Gibco公司);抗鼠Fc封闭性抗体(美国eBioscience公司);细胞计数试剂盒(cell counting kit,CCK)-8(美国Sigma-Aldrich公司);IL-10、转化生长因子β(transforming growth factor-β,TGF-β)酶联免疫吸附试验(enzyme linked immunosorbent assay,ELISA)检测试剂盒(美国Biosource公司);RMT1-10及其IgG同型对照抗体(美国Bio X Cell公司)。Multiskan FC酶标仪(美国Termo Fisher Scientific公司);FACSCalibur流式细胞仪(美国BD公司);Mitsutovo螺旋测微器(日本三丰公司)。
1.2 方法
1.2.1DCs的获取及分组处理 颈椎脱臼法处死C57BL/6小鼠,无菌取股骨,冲洗骨髓细胞,Tris-NH4Cl裂解红细胞5 min,以1×l06个细胞/孔接种于6孔板,每孔添加10 ng/ml rmGM-CSF和1 ng/ml rmIL-4,培养3 d后,吸弃培养基及悬浮细胞,重新加入RPMI1640完全培养基及rmGM-CSF、rmIL-4,继续培养3 d,收集疏松贴壁细胞即为imDCs。将获取的imDCs按照诱导干预措施的不同分为imDCs组、mDCs组、RMT1-10组和IgG同型对照组,其中imDCs组不做干预,继续培养24 h;mDCs组在培养第6天加入终质量浓度为10 mg/L脂多糖继续培养24 h;RMT1-10组在培养第1天加入200 ng RMT1-10,第6天加入终质量浓度为10 mg/L脂多糖继续培养24 h;IgG同型对照组在培养第1天加入200 ng RMT1-10的IgG同型对照抗体,第6天加入终质量浓度为10 mg/L脂多糖继续培养24 h。
1.2.2流式细胞术检测DCs表型 收集各组细胞,用含有体积分数5%胎牛血清的磷酸盐缓冲液(phosphate buffered saline,PBS)作为染色液洗涤2次。每50 μl染色液添加1~2 μl抗鼠Fc封闭性抗体。将细胞用50 μl含有封闭性抗体的染色液混悬,4 ℃避光孵育30 min。每50 μl染色液分别添加1~2 μl抗鼠CD11c、CD80、CD86、MHC-Ⅱ、Tim-4、CD103抗体或其同型IgG抗体。再加入50 μl染色液混悬,4 ℃避光孵育30 min,洗涤2次,离心半径15 cm,1 500 r/min离心5 min弃上清,100 μl PBS混悬后上机检测,Flowjo 10.0软件(日本Tomy Digital Biology公司)分析结果。测定时以前向散色光和侧向散色光设定R1排除细胞碎片,以CD11c设门R2,以平均荧光强度计算CD80、CD86、MHC-Ⅱ、Tim-4、CD103阳性细胞在CD11c阳性细胞中的百分比。每个样品均用荧光标记同型IgG抗体作为相应的阴性对照。
1.2.3ELISA法检测DCs培养上清液中IL-10和TGF-β的表达水平 收集各组DCs培养上清液,分别使用IL-10和TGF-β的ELISA检测试剂盒按说明书操作方法进行检测。抗体包被板条中加入样品或标准品(100 U/孔),室温孵育90 min,洗板,每孔加入50 μl PBS内含生物素标记抗IL-10和抗TGF-β抗体(1∶ 2 000),室温孵育60 min,PBS洗涤3次。每孔加入100 μl亲和链霉素-HRP,室温孵育20 min,PBS洗涤3次。每孔加入100 μl 0.01%四甲基联苯胺缓冲液,室温避光孵育20 min,加入100 μl 1 mmol/L H2SO4终止显色,用酶标仪测定波长450 nm处吸光度(A450)值,参考波长为690 nm,根据标准曲线计算样品细胞因子水平。
1.2.4磁柱分选法获取小鼠脾脏CD4+T细胞 颈椎脱臼法处死BALB/c小鼠,无菌摘取脾脏,200目筛网研磨过滤,裂解红细胞10 min,洗涤后调整细胞密度为1×l06/ml,加入CD4特异性磁珠(1 μl磁珠/107个细胞),4 ℃避光孵育15 min,以含有质量分数0.5%牛血清白蛋白的PBS洗涤后上磁柱分选(MS+,德国Miltenyi Biotec公司),即得到CD4+T细胞,其分选纯度经流式细胞术检测大于95%。
1.2.5混合淋巴细胞实验检测DCs刺激CD4+T细胞的增生能力 收集4个组DCs分别以5×105个细胞/孔接种于96孔板,每孔均添加25 μg/ml丝裂霉素C,重悬后作为刺激细胞,每孔再加入CD4+T细胞(5×105个/100 μl)作为反应细胞。按照刺激细胞与反应细胞数量比为1∶ 5、1∶ 10、1∶ 20和1∶ 40分别添加4个组细胞,每个比例均设3个复孔,设立单独T细胞为阴性对照。72 h后每孔添加20 μl CCK-8,继续培养4 h,用酶标仪测定A450值,参考波长620 nm。刺激指数(stimulation index,SI)=(待测样品A值-培养液对照组A值)/(阴性对照组A值-培养液对照组A值)。
1.2.6小鼠高危角膜移植模型的建立及分组 以角膜基质缝线法诱导BALB/c小鼠角膜新生血管,于右眼角膜以11-0缝线间隔120°间断缝线3针,7 d后拆线。选择4个象限新生血管均匀长入角膜中周区的小鼠作为受体。采用随机数字表法将80只受体小鼠随机分为imDCs组、mDCs组、RMT1-10组和IgG同型对照组,每组20只,分别经尾静脉注射供体源imDCs、mDCs(imDCs+脂多糖)、RMT1-10诱导的DCs(imDCs+RMT1-10+脂多糖)和RMT1-10IgG同型对照抗体诱导的DCs(imDCs+IgG+脂多糖),均为1×106个细胞/100 μl。7 d后,以C57BL/6小鼠为供体行穿透角膜移植术。腹腔内注射质量分数0.3%戊巴比妥钠(0.4 ml/只)麻醉小鼠,供体角膜植片和受体植床直径均为2.0 mm,11-0尼龙缝线间断缝合8针,消毒空气形成前房,术毕红霉素眼膏涂眼,睑缘缝合,24 h后拆除睑缘缝线观察。发生前房消失、前房出血、感染、虹膜前粘连、白内障等并发症者8例,不纳入实验并及时补充样本。手术由同一术者完成。
1.2.7裂隙灯显微镜下观察各组角膜植片排斥体征 术后每日在裂隙灯显微镜下观察受体角膜植片排斥体征,参考Larkin等[8]评分标准对角膜排斥反应进行评分:(1)角膜混浊 角膜植片完全透明为0分;植片透明度轻度丢失为1分;植片透明度中度丢失,虹膜血管可见为2分;虹膜血管窥不清,但瞳孔轮廓可见为3分;瞳孔轮廓不清为4分。(2)水肿 角膜植片无水肿为0分;角膜植片中度水肿为1分;伴有植片增厚的显著水肿为2分。(3)新生血管 植片无新生血管为0分;新生血管在任何象限伸入达到植片半径的25%为1分;新生血管在任何象限伸入达到植片半径的50%为2分;新生血管在任何象限伸入达到植片半径的75%为3分;新生血管达到植片中央为4分。3项评分之和为当日排斥反应指数(rejection index,RI),RI≥5或植片混浊评分≥3分即认为发生排斥反应,术后30 d植片仍保持透明者确定为存活。
1.2.8迟发型超敏反应检测 角膜移植术后第21天,每组按照抽签法随机抽取5只小鼠进行迟发型超敏反应(delayed type hypersensitivity,DTH)检测。首先取正常C57BL/6小鼠,颈椎脱臼法处死,浸入体积分数75%乙醇中1~2 min,无菌摘取脾脏,200目筛网研磨过滤,Tris-NH4Cl裂解红细胞5 min,转移至离心管,4 ℃下1 500 r/min离心5 min,弃上清,Hanks液重悬,调整细胞密度为5×l07/ml,加入终质量浓度为1.25 mg/ml丝裂霉素C,于37 ℃水浴中作用30 min,1 000 r/min离心10 min,弃上清,Hanks液洗涤3次。取20 μl(1×106个细胞)注射于受体小鼠右耳廓皮下,对侧耳廓注射等容量生理盐水。24 h后,以螺旋测微器测量耳廓肿胀度。耳廓肿胀度=右耳(24 h测量值-0 h测量值)-左耳(24 h测量值-0 h测量值)。取正常BALB/c小鼠5只,耳廓注射前7 d,小鼠腹部皮下注射1 ml(1×107个细胞)C57BL/6脾脏细胞悬液作为阳性对照。取正常BALB/c小鼠5只,右耳廓皮下仅注射生理盐水作为阴性对照。根据耳廓是否肿胀判定是否存在DTH反应。
1.3 统计学方法

2 结果
2.1 各组DCs中不同细胞表型所占百分比比较
各组DCs中CD80、CD86、MHC-Ⅱ、Tim-4和CD103总体比较,差异均有统计学意义(均P<0.001),其中RMT1-10组DCs中CD80、CD86、MHC-Ⅱ和Tim-4阳性细胞占CD11c阳性细胞百分比均明显低于mDCs组,差异均有统计学意义(均P<0.001);RMT1-10组Tim-4阳性细胞百分比明显低于imDCs组,CD103阳性细胞百分比明显高于其他3个组,差异均有统计学意义(均P<0.001)(图1,表1)。

图1 各组DCs不同表型比较的代表性流式图 mDCs:成熟树突状细胞;imDCs:未成熟树突状细胞;MHC:主要组织相容性复合物;Tim:T细胞免疫球蛋白和黏蛋白结构域分子

表1 各组DCs中不同细胞表型所占百分比比较(x±s,%)Table 1 Comparisons of different DCs phenotypes among various groups (x±s,%)组别样本量CD80CD86MHC-ⅡTim-4CD103imDCs组522.87±3.3625.94±2.5323.80±2.3518.32±1.4716.75±1.35mDCs组558.98±3.1965.65±2.1462.60±3.2027.04±2.359.34±1.43RMT1-10组525.12±2.64b27.86±2.68b26.03±2.53b12.39±2.07ab28.66±2.29abIgG同型对照组560.63±3.5465.24±2.5563.04±2.0527.94±3.118.91±0.98cF值209.30402.30364.6050.870169.00P值<0.001<0.001<0.001<0.001<0.001 注:与imDCs组比较,aP<0.001;与mDCs组比较,bP<0.001;与RMT1-10组比较,cP<0.001(单因素方差分析,Tukey检验) DCs:树突状细胞;imDCs:未成熟树突状细胞;mDCs:成熟树突状细胞;MHC:主要组织相容性复合物;Tim:T细胞免疫球蛋白和黏蛋白结构域分子 Note:Compared with imDCs group,aP<0.001;compared with mDCs group,bP<0.001;compared with RMT1-10 group,cP<0.001 (One-way ANOVA,Tukey test) DCs:dendritic cells;imDCs:immature dendritic cells;mDCs:mature dendritic cells;MHC:major histocompatibility complex;Tim:T cell immunoglobulin and mucin domain containing molecule
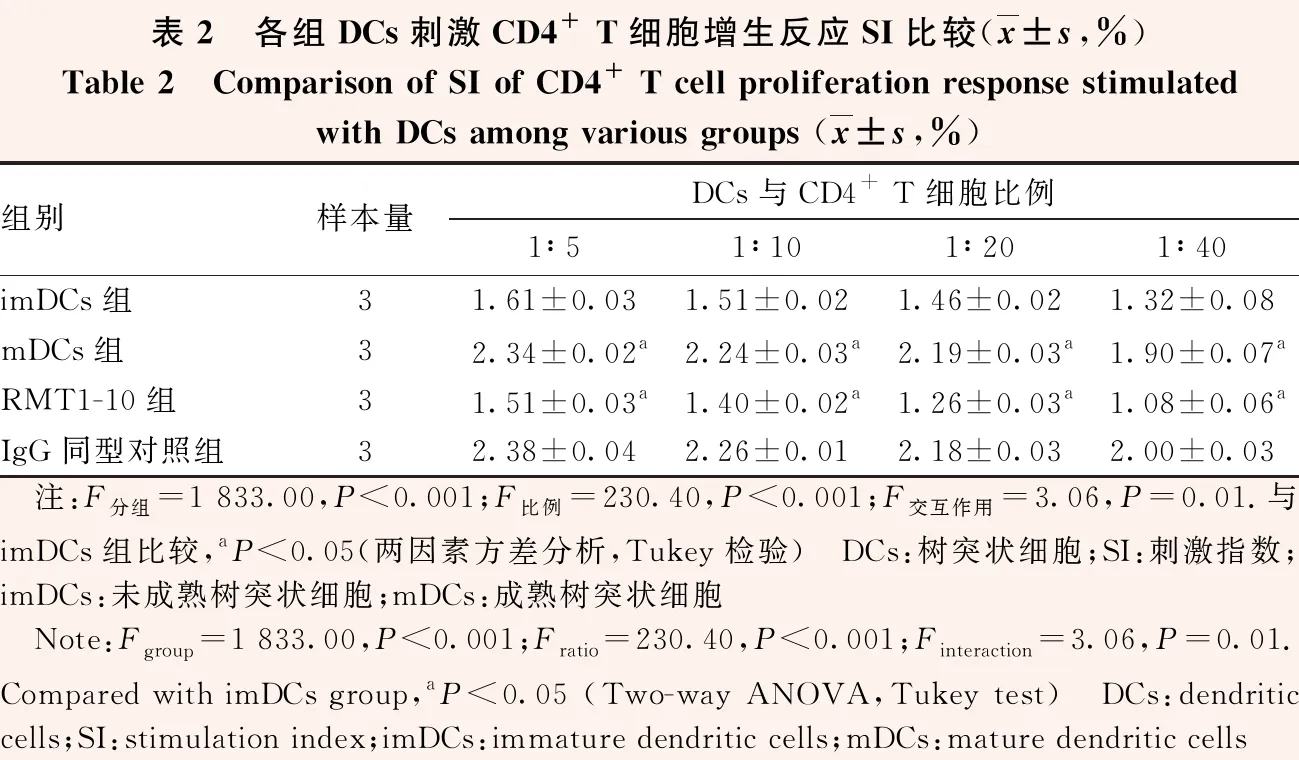
表2 各组DCs刺激CD4+ T细胞增生反应SI比较(x±s,%)Table 2 Comparison of SI of CD4+ T cell proliferation response stimulatedwith DCs among various groups (x±s,%)组别样本量DCs与CD4+ T细胞比例1∶51∶101∶201∶40imDCs组31.61±0.031.51±0.021.46±0.021.32±0.08mDCs组32.34±0.02a2.24±0.03a2.19±0.03a1.90±0.07aRMT1-10组31.51±0.03a1.40±0.02a1.26±0.03a1.08±0.06aIgG同型对照组32.38±0.042.26±0.012.18±0.032.00±0.03 注:F分组=1 833.00,P<0.001;F比例=230.40,P<0.001;F交互作用=3.06,P=0.01.与imDCs组比较,aP<0.05(两因素方差分析,Tukey检验) DCs:树突状细胞;SI:刺激指数;imDCs:未成熟树突状细胞;mDCs:成熟树突状细胞 Note:Fgroup=1 833.00,P<0.001;Fratio=230.40,P<0.001;Finteraction=3.06,P=0.01.Compared with imDCs group,aP<0.05 (Two-way ANOVA,Tukey test) DCs:dendritic cells;SI:stimulation index;imDCs:immature dendritic cells;mDCs:mature dendritic cells
2.2 各组DCs培养上清液中IL-10和TGF-β质量浓度比较
imDCs组、RMT1-10组、mDCs组和IgG同型对照组细胞培养上清液中IL-10质量浓度分别为(61.35±3.76)、(27.47±2.51)、(86.63±7.81)和(29.27±3.67)pg/ml,总体比较差异有统计学意义(F=154.30,P<0.001);TGF-β质量浓度分别为(31.48±1.69)、(13.66±1.80)、(45.23±4.32)和(15.09±0.94)pg/ml,总体比较差异有统计学意义(F=174.60,P<0.001)。RMT1-10组IL-10和TGF-β质量浓度明显高于其他组,差异均有统计学意义(均P<0.001);imDCs组IL-10和TGF-β质量浓度明显高于mDCs组和IgG同型对照组,差异均有统计学意义(均P<0.001)(图2)。
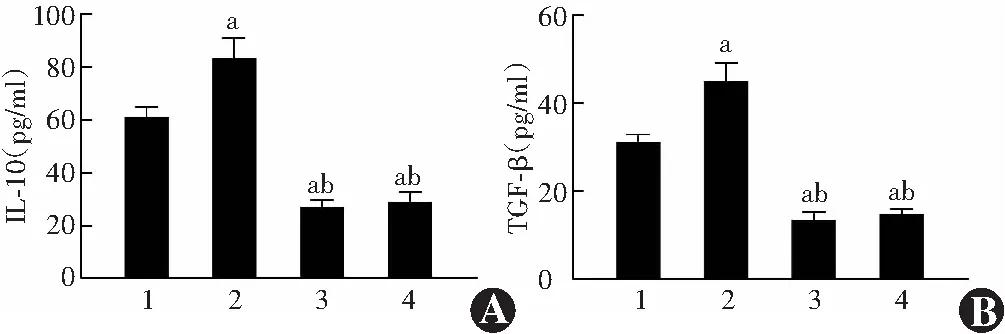
图2 各组DCs培养上清液中IL-10和TGF-β质量浓度比较 A:各组DCs培养上清液中IL-10质量浓度比较 F=154.30,P<0.001.与imDCs组比较,aP<0.001;与RMT1-10组比较,bP<0.001(单因素方差分析,Tukey检验,n=5) B:各组DCs培养上清液中TGF-β质量浓度比较 F=174.60,P<0.001.与imDCs组比较,aP<0.001;与RMT1-10组比较,bP<0.001(单因素方差分析,Tukey检验,n=5) 1:imDCs组;2:RMT1-10组;3:mDCs组;4:IgG同型对照组 IL:白细胞介素;TGF:转化生长因子
2.3 各组DCs刺激CD4+ T细胞增生反应SI比较
各组DCs刺激CD4+T细胞增生反应SI总体比较,差异均有统计学意义(F组别=1 833.00,P<0.001;F比例=230.40,P<0.001)。在同一细胞比例内,imDCs组SI均低于mDCs组,RMT1-10组SI均低于imDCs组,差异均有统计学意义(均P<0.05)(表2)。
2.4 角膜移植术后裂隙灯显微镜观察
术后14 d,mDCs组和IgG同型对照组角膜植片均发生排斥反应,可见角膜植片显著水肿并呈灰白色混浊,新生血管长入植片中央,不可窥见虹膜纹理及瞳孔。imDCs组和RMT1-10组角膜植片未见排斥反应,imDCs组角膜植片轻度水肿,新生血管长至植片边缘。RMT1-10组角膜植片透明,无水肿、新生血管,虹膜纹理及瞳孔清晰可见(图3)。
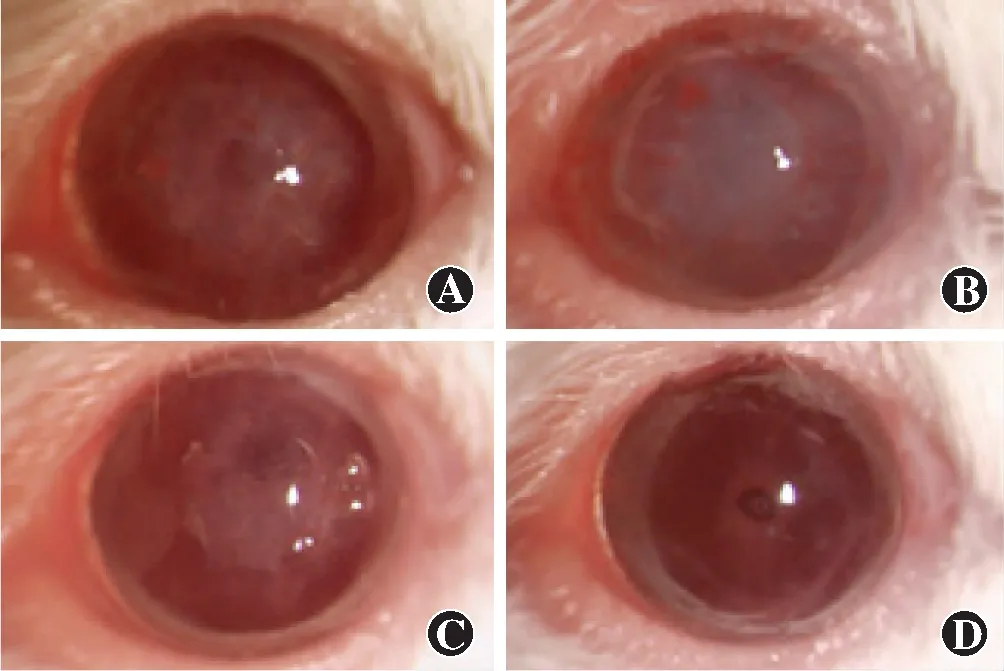
图3 术后14 d裂隙灯显微镜下各组角膜植片排斥反应情况 A:imDCs组角膜植片轻度水肿 B:mDCs组角膜植片灰白色混浊 C:IgG同型对照组角膜植片显著水肿并呈灰白色混浊 D:RMT1-10组角膜植片透明
2.5 各组DCs过继转移后受体小鼠角膜植片生存分析
将各组角膜植片生存时间绘制为Kaplan-Meier生存曲线,mDCs组和IgG同型对照组角膜植片均在术后第8天开始发生排斥反应,14 d内全部发生排斥反应。imDCs组角膜植片术后第17天开始发生排斥反应,4周内80%植片发生排斥反应。RMT1-10组角膜植片术后第24天开始发生排斥反应,4周内50%植片发生排斥反应。各组角膜植片生存曲线总体差异有统计学意义(χ2=77.69,P<0.001),其中imDCs组角膜植片存活数量明显多于mDCs组,差异有统计学意义(χ2=31.02,P<0.001);RMT1-10组角膜植片存活数量明显多于imDCs组,差异有统计学意义(χ2=9.74,P=0.002)(图4)。
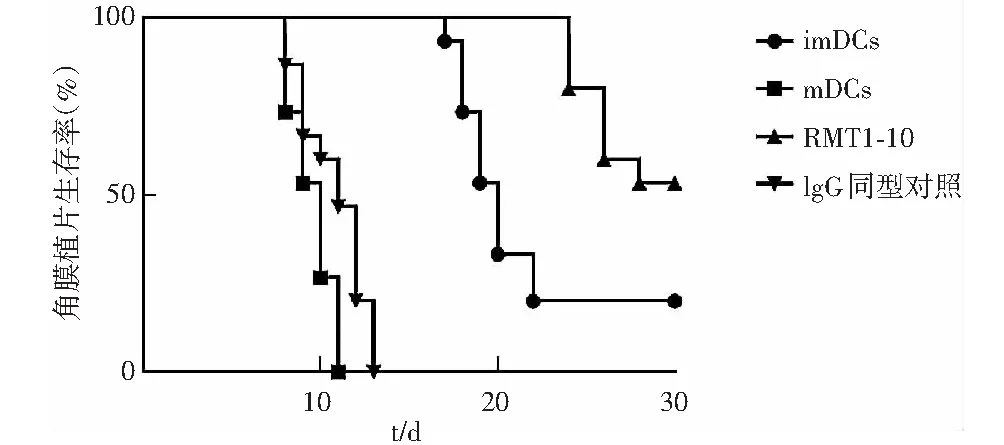
图4 各组DCs过继转移后受体小鼠角膜植片生存分析(Log-rank检验,n=15) 各组角膜植片生存曲线总体比较, χ2=77.69,P<0.001.imDCs组与mDCs组比较, χ2=31.02,P<0.001;RMT1-10组与imDCs组比较, χ2=9.74,P=0.002 imDCs:未成熟树突状细胞;mDCs:成熟树突状细胞
2.6 各组DCs过继转移后受体小鼠耳廓肿胀度比较
阳性对照组、mDCs组、IgG同型对照组、imDCs组、RMT1-10组和阴性对照组小鼠耳廓肿胀度分别为(503.6±17.2)、(475.7±17.6)、(456.2±18.8)、(225.2±39.4)、(118.1±12.6)和(106.4±7.4)μm,总体比较差异有统计学意义(F=377.10,P<0.001),其中mDCs组小鼠耳廓肿胀度低于阳性对照组,差异有统计学意义(P=0.035);imDCs组小鼠耳廓肿胀度明显低于IgG同型对照组,明显高于RMT1-10组,差异均有统计学意义(均P<0.001)(图5)。

图5 各组受体小鼠耳廓肿胀度比较(单因素方差分析,Tukey检验,n=5) F=377.10,P<0.001.与阳性对照组比较,aP<0.05;与imDCs组比较,bP<0.05 1:阳性对照组;2:mDCs组;3:IgG同型对照组;4:imDCs组;5:RMT1-10组;6:阴性对照组
3 讨论
Tim最早于2001年被发现,鼠类由8个成员组成,人类由3个成员组成,两者有3个成员最为接近,包括Tim-1、Tim-3和Tim-4。Tim家族在免疫应答和免疫耐受中扮演重要角色[9]。Tim-1是最新发现的Tim家族成员,初始CD4+T细胞表面并不表达Tim-1,但在受到T细胞表面受体刺激数小时后迅速上调并偏好表达于分化成熟的Th2细胞表面。因此,Tim-1被认为是Th2细胞的特异性表面标志物并主要参与Th2型免疫反应的发生和发展[10]。研究发现Tim-1阻断抗体RMT1-10能够有效抑制免疫排斥反应[11]。本课题组前期研究中采用腹腔内注射RMT1-10防治小鼠角膜移植排斥反应,结果显示角膜植片的存活率显著提高[3]。通过对其作用机制的探讨,发现RMT1-10可以抑制CD4+T细胞活化增生、抑制Th1反应,同时增强Tregs反应,进而诱导免疫耐受[3]。进一步研究发现,RMT1-10可以使DCs保持未成熟表型,抑制CD4+T细胞活化增生,从而抑制角膜移植排斥反应[12]。然而,虽然imDCs具有很强的抗原捕获和处理能力,以及较弱的T细胞刺激能力,但不能致敏T细胞,也不能通过使T细胞凋亡或无能或刺激Tregs诱导免疫耐受[13]。因此,RMT1-10的作用可能并非通过imDCs实现。
Tol-DCs被认为是一种介于imDCs和mDCs之间的DCs,所有诱导产生的Tol-DCs都具有一些的共性:(1)低表达共刺激分子;(2)在促成熟刺激时保持稳定同时高分泌IL-10;(3)激活T细胞的能力较弱[14]。在本研究中,经RMT1-10干预同时接受脂多糖刺激的DCs低表达MHC-Ⅱ和T细胞激活所需的共刺激分子CD80和CD86。Tim-4是Tim-1的天然配体,组成性表达于抗原提呈细胞,特别是mDCs,Tim-4可诱导Tim-1胞内尾巴区酪氨酸磷酸化,从而提供共刺激信号增强IL-4启动子转录并激活T细胞核因子转录和活化蛋白-1,因此Tim-1和Tim-4结合对于T细胞增生和细胞因子产生具有重要意义[15]。本研究中DCs表面Tim-4也同时被抑制,说明其激活T细胞的能力也较弱。实际上,目前仍不确定Tol-DCs是DCs的特定亚群还是一类具有能反映其处于活化耐受状态阶段的DCs,研究者对一些特征性Tol-DCs,如CD103+DC和穿孔素表达性DCs(perf-DCs)等进行了研究,发现CD103+DCs不仅可以诱导Tregs产生,还可以指导T细胞表面归巢分子CCR9和α4β7的表达,因此被认为是具有免疫耐受诱导功能的一种DCs[16]。在本研究中,RMT1-10诱导DCs表面CD103的表达水平明显高于其他组。因此,尽管RMT1-10诱导DCs的部分表型属于imDCs,但还具有明显不同于imDCs的耐受性表型分子表达,这类DCs是否为CD103+Tol-DCs仍需进一步验证。
从细胞因子角度来看,DCs分泌的免疫抑制因子TGF-β和IL-10对于诱导外周免疫耐受至关重要。在稳态下,CD103+DCs需要在TGF-β参与下将初始T细胞转化为Tregs。在受到脂多糖刺激时,DCs需要在TGF-β参与下减少CD80和CD86等分子表达以抵抗成熟刺激,TGF-β诱导的IL-10表达增加也参与这一过程[17]。IL-10参与多种免疫细胞,特别是Tregs和Tr1细胞的诱导[18]。在稳态下,外周的CD4+CD25-Foxp3-T细胞在TGF-β和IL-10参与下暴露于抗原后会明显上调表达Foxp3[19]。本研究中,RMT1-10诱导的DCs明显抑制CD4+T细胞增生,且分泌的TGF-β和IL-10明显多于对照组,进一步说明RMT1-10可能诱导产生的是Tol-DCs,且其免疫调节作用可能是通过上调表达TGF-β和IL-10实现的。
本课题组前期研究显示,腹腔内注射RMT1-10可以使体内DCs保持未成熟状态,进而抑制角膜移植免疫排斥反应,这种效应随着药物剂量的加大而增强,但这样可能会引起严重的全身不良反应,因此在体外诱导imDCs转化为Tol-DCs再转移至体内可能效率更高且更为安全[12]。临床上,Tol-DCs已被用于包括器官移植和自身免疫性疾病的I期临床试验,并显示出良好的安全性和应用前景[20-21]。在本研究中,RMT1-10诱导的DCs将高危角膜植片存活率明显提高且未发生明显不良反应,而受体小鼠的DTH反应更接近正常小鼠,也说明其可通过抑制受体的DTH反应安全、有效地诱导受体形成抗原特异性免疫耐受。
综上所述,本研究结果发现Tim-1阻断抗体RMT1-10可以抑制小鼠高危角膜移植排斥反应,其作用机制可能是体外诱导imDCs转化为Tol-DCs并上调TGF-β和IL-10表达,经过继转移后促进受体抗原特异性免疫耐受,进而间接延长角膜植片存活时间。随着细胞诱导技术的进步,Tol-DCs有望应用于临床角膜移植,改善角膜移植疗效、减少对免疫抑制剂的依赖、提高患者的生存质量。本研究尚存在一些局限性,如在观察RMT1-10诱导Tol-DCs的抗排斥效果时,未使用常规药物,如地塞米松作为对照。实际上,地塞米松不只是免疫抑制剂,也可能通过抑制DCs成熟诱导Tol-DCs转化,因此将其作为药物对照可能更具说服力。另外,Tol-DCs和其他免疫细胞,如Tregs、Bregs、自然杀伤细胞等构成一个调节网络,这对于放大其正反馈效应并维系免疫耐受至关重要,本研究在对RMT1-10诱导的Tol-DCs作用机制进行探讨时未对此进行深入分析,这些问题都有待后续实验进一步验证。
利益冲突所有作者均声明不存在利益冲突
作者贡献声明赵敏:实施研究、论文初稿撰写;杨柳清、王梦宇、陶钰:实施研究、采集数据;郭永越:实验数据整理;苏锐锋:实验数据分析;石晶:实验设计和分析;谭小波:酝酿和设计实验、论文审阅与修订及定稿
