IMA、LP⁃a与Stanford A型主动脉夹层动脉瘤术预后的关系
2022-09-03刘建华蒋伟闫小清武刚
刘建华 蒋伟 闫小清 武刚
Stanford A 型主动脉夹层动脉瘤(Stanford type A aortic dissection aneurysm,SAAD)是一种凶险的心血管疾病,起病急,病情复杂[1]。该类型患者临床表现为胸背部撕裂样疼痛,或伴呼吸急促、呼吸困难,若不及时治疗可出现头晕、昏迷、心力衰竭等病症,严重者可导致死亡[2]。临床对于SAAD 主要采用外科手术治疗,尽管SAAD 治疗技术在逐渐改进,手术成功率较高,但术后住院死亡率仍高达22%[3]。此外,SAAD 是一种累及整个主动脉及其分支的进行性疾病,即使在急性指数事件术后仍处于高风险状态。SAAD 的临床预后结果差异很大,准确的风险分层会进一步影响到治疗决策(例如,手术类型的选择)和出院后药物治疗,及时识别高危患者将有助于改善SAAD 整体预后。因此,早期诊断、准确风险分层对评估SAAD 术后预后有一定价值。本研究抽选326 例主动脉手术的SAAD,探讨缺血修饰白蛋白(Ischemia modified albumin;IMA)、血清脂蛋白⁃a(Serum lipoprotein⁃a,LP⁃a)与SAAD 患者术后预后的相关性。
1 资料与方法
1.1 对象
选取2019年1 至12月326 例于河南省胸科医院实施主动脉手术的SAAD 患者进行研究。纳入标准如下:①所有患者均行心脏相关影像学检查,并经检查结果分析诊断为SAAD:依据诊断标准[4⁃5],A 型急性主动脉夹层经胸超声心动图和计算机断层扫描(CT)的形态学确诊,患者出现严重的胸痛、放射至颈部或肩背痛等临床症状;②所有患者术前肾生理结构正常,无任何器质性异常;③深入肾动脉内部的假腔无破口,肾动脉均由真腔供血。排除标准:①手术过程中死亡的患者;②合并精神类疾病患者;③临床资料不完整患者。④肿瘤、自身免疫性疾病、传染病、全身炎症性疾病或手术史;并存在慢性主动脉夹层。⑤术前存在慢性肾功能不全的患者。本研究经院伦理委员会批准,患者或家属已签署知情同意书。
1.2 研究方法
1.2.1 数据收集
入院时获取患者基本医疗信息,例如一般病史[性别、年龄、体重指数(BMI)、吸烟史、高血压、糖尿病、CKD、既往主动脉支架植入术、既往心脏手术史等]和实验室测试(尿素、白细胞、葡萄糖、甘油三酯、胆固醇、高密度脂蛋白、低密度脂蛋白、纤维蛋白原、D⁃二聚体、hs⁃CRP、同型半胱氨酸、心肌肌钙蛋白、Lp(a)、IMA 等)。发病至手术时间、收缩压、舒张压、心率、升主动脉直径、器官缺血情况、主动脉置手术类型、手术时间等。
1.2.2 实验室检测
所有患者禁食约12 h 后,清晨抽取患者肘部空腹静脉血2 mL,并在1 小时内室温下以3 500 r/min 离心10 min(离心半径10 cm),获取血清,血清分为2 份。1 份采取罗氏全自动生化分析仪检测血清学相关指标。另一份在-80℃冰箱里存储待检,用于集中测量IMA 和LP⁃PLA2 水平,采用ELISA 法检测血清Lp⁃PLA2,试剂盒购于北京九强生物技术公司。
1.2.3 研究终点
所有受试者均行CTA 检测主动脉夹层,术前肾灌注不良由CTA 明确诊断,观察患者肾动脉受夹层累及,患者入院后随访至2年,随访截止日期2021年12月1日。病史和死亡结局等临床资料均从医院病史记录和患者电话访谈资料中收集。住院并发症包括急性肾功能衰竭、急性肢体缺血、低血压、低氧血症、心肌缺血性梗死、意识障碍、心包填塞和截瘫。
1.3 统计学分析
采用SPSS 21.0 统计软件进行统计学分析,计量资料采用()表示,采用t检验,计数资料用[n(%)]表示,采用χ2检验。采用多因素Logistic回归模型分析每个因子的风险比和置信区间(95%CI),以确定全因死亡率的独立预测因子。P<0.05被认为具有统计学意义。
2 结果
2.1 SAAD 患者的临床特征
与存活组相比,死亡组的血清IMA、LP⁃a 水平显著升高(P<0.05)。死亡组年龄均偏大(P<0.05)。死亡组中术前急性肾功能不全(定义为eGFR< 60 mL/min/m2)的发生率显著高于生存组(P<0.05)。血清D⁃二聚体、同型半胱氨酸、hs⁃CRP、心肌肌钙蛋白、尿素浓度在死亡组中显著高于存活组(P<0.05)。纤维蛋白原在死亡组中显着降低(P<0.05)。存活组高血压(36.2%)、术前肾灌注不良比率(8.7%)低于死亡组(66.0%、38.0%)(P<0.05)。手术时间、CPB 时间、ACC时间、HCA 时间在死亡组中均较长(P<0.05)。见表1。
表1 SAAD 患者的临床特征[(±s),n(%)]Table 1 clinical characteristics of Saad patients[(±s),n(%)]
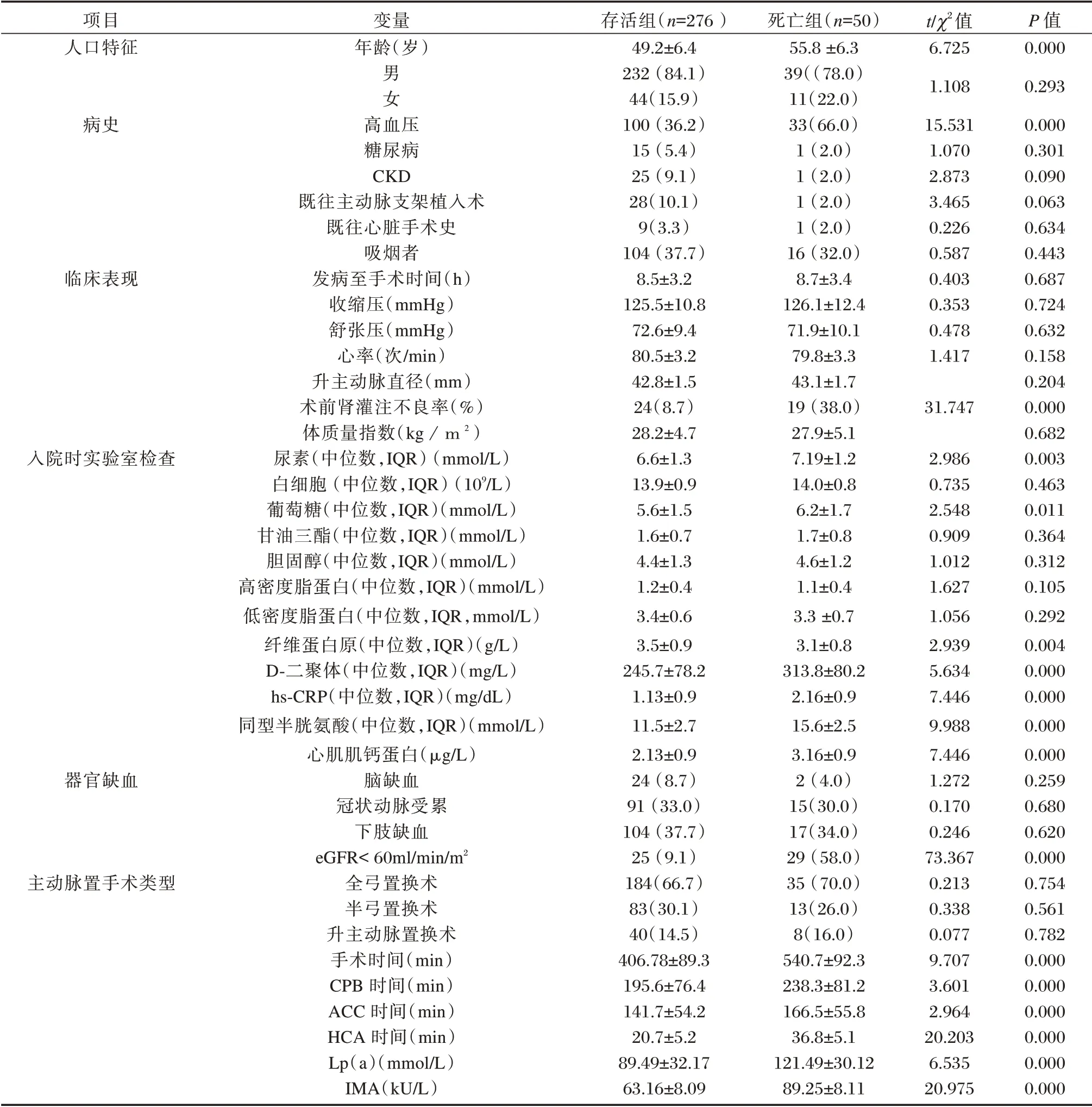
表1 SAAD 患者的临床特征[(±s),n(%)]Table 1 clinical characteristics of Saad patients[(±s),n(%)]
项目人口特征变量年龄(岁)男女病史临床表现t/χ2值6.725 1.108 15.531 1.070 2.873 3.465 0.226 0.587 0.403 0.353 0.478 1.417 31.747入院时实验室检查器官缺血主动脉置手术类型高血压糖尿病CKD既往主动脉支架植入术既往心脏手术史吸烟者发病至手术时间(h)收缩压(mmHg)舒张压(mmHg)心率(次/min)升主动脉直径(mm)术前肾灌注不良率(%)体质量指数(kg/m2)尿素(中位数,IQR)(mmol/L)白细胞(中位数,IQR)(109/L)葡萄糖(中位数,IQR)(mmol/L)甘油三酯(中位数,IQR)(mmol/L)胆固醇(中位数,IQR)(mmol/L)高密度脂蛋白(中位数,IQR)(mmol/L)低密度脂蛋白(中位数,IQR,mmol/L)纤维蛋白原(中位数,IQR)(g/L)D⁃二聚体(中位数,IQR)(mg/L)hs⁃CRP(中位数,IQR)(mg/dL)同型半胱氨酸(中位数,IQR)(mmol/L)心肌肌钙蛋白(μg/L)脑缺血冠状动脉受累下肢缺血eGFR< 60ml/min/m2全弓置换术半弓置换术升主动脉置换术手术时间(min)CPB 时间(min)ACC 时间(min)HCA 时间(min)Lp(a)(mmol/L)IMA(kU/L)存活组(n=276)49.2±6.4 232(84.1)44(15.9)100(36.2)15(5.4)25(9.1)28(10.1)9(3.3)104(37.7)8.5±3.2 125.5±10.8 72.6±9.4 80.5±3.2 42.8±1.5 24(8.7)28.2±4.7 6.6±1.3 13.9±0.9 5.6±1.5 1.6±0.7 4.4±1.3 1.2±0.4 3.4±0.6 3.5±0.9 245.7±78.2 1.13±0.9 11.5±2.7 2.13±0.9 24(8.7)91(33.0)104(37.7)25(9.1)184(66.7)83(30.1)40(14.5)406.78±89.3 195.6±76.4 141.7±54.2 20.7±5.2 89.49±32.17 63.16±8.09死亡组(n=50)55.8 ±6.3 39((78.0)11(22.0)33(66.0)1(2.0)1(2.0)1(2.0)1(2.0)16(32.0)8.7±3.4 126.1±12.4 71.9±10.1 79.8±3.3 43.1±1.7 19(38.0)27.9±5.1 7.19±1.2 14.0±0.8 6.2±1.7 1.7±0.8 4.6±1.2 1.1±0.4 3.3 ±0.7 3.1±0.8 313.8±80.2 2.16±0.9 15.6±2.5 3.16±0.9 2(4.0)15(30.0)17(34.0)29(58.0)35(70.0)13(26.0)8(16.0)540.7±92.3 238.3±81.2 166.5±55.8 36.8±5.1 121.49±30.12 89.25±8.11 2.986 0.735 2.548 0.909 1.012 1.627 1.056 2.939 5.634 7.446 9.988 7.446 1.272 0.170 0.246 73.367 0.213 0.338 0.077 9.707 3.601 2.964 20.203 6.535 20.975 P 值0.000 0.293 0.000 0.301 0.090 0.063 0.634 0.443 0.687 0.724 0.632 0.158 0.204 0.000 0.682 0.003 0.463 0.011 0.364 0.312 0.105 0.292 0.004 0.000 0.000 0.000 0.000 0.259 0.680 0.620 0.000 0.754 0.561 0.782 0.000 0.000 0.000 0.000 0.000 0.000
2.2 主动脉夹层术预后不良的影响因素Logistic回归模型分析
随访2年,根据随访期间全因死亡概率分为存活组276 例和死亡组50 例。以主动脉夹层术后是否全因死亡为因变量,将单因素中P<0.05 因素为自变量,绘制ROC 曲线,以各指标最大约登指数得出血清IMA、LP⁃a 水平的最佳分界值(分别为:76.78 kU/L、118.52 mmol/L)。见图1。多因素分析结果显示,年龄、术前肾灌注不良、D⁃二聚体、血清IMA 水平、血清LP⁃a 水平为SAAD 患者住院死亡的独立危险因素。见表2。
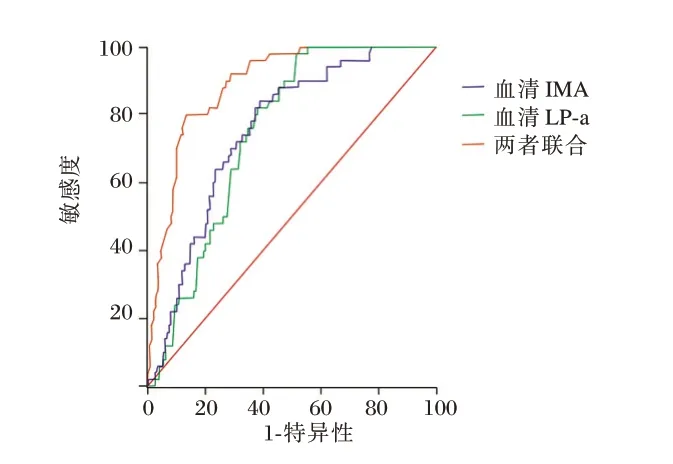
图1 血清IMA、LP⁃a 水平诊断SAAD 术后发生全因死亡的ROC 曲线Figure 1 ROC curve of serum IMA and lp⁃a levels in the diagnosis of all⁃cause death after Saad
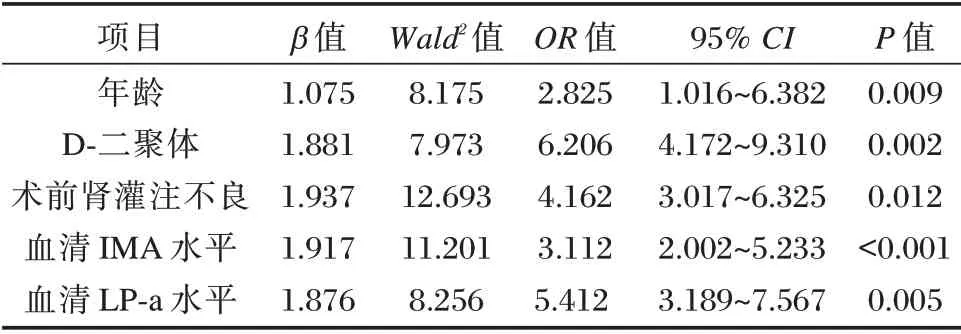
表2 主动脉夹层术预后不良的影响因素Logistic 回归模型分析Table 2 logistic regression analysis of factors affecting the poor prognosis of aortic dissection
2.3 血清IMA、LP⁃a 水平最佳截断值
当血清IMA 最佳截断值为76.78 kU/L时,诊断SAAD 术后发生全因死亡AUC 为0.754(95% CI0.612~0.831),灵敏度为 61.32%,特异性84.51%;血清LP⁃a 水平最佳截断值为118.52 mmol/L,血清LP⁃a 诊断SAAD 术后发生全因死亡 的AUC 为0.747(95% CI0.679~0.813),灵敏度为62.35%,特异性82.17%。两者联合诊断SAAD 术后发生全因死亡的AUC 为0.892(95%CI0.847~0.927),灵敏度为86.74%,特异性80.02%。见表3。

表3 血清IMA、LP⁃a 水平最佳截断值Table 3 optimal cutoff values of serum IMA and lp⁃a levels
3 讨论
尽管早期诊断和及时的外科手术可降低发病时的死亡风险,但由于Stanford A 型主动脉夹层动脉瘤病情危重,手术操作复杂,以致该类型患者在接受手术后仍存在较高的病死率[6⁃7]。因此,了解影响患者术后发生死亡的危险因素,并给予及时有效的干预,对降低其术后病死率具有重要意义。尽管大量研究已经证明了生物标志物在预测SAAD 中的作用,但缺乏对多标志物(如心电图、影像和实验室预后指标)的系统研究,以预测SAAD术后死亡的危险性[8]。本研究检查了SAAD 患者术后死亡与各指标之间的关系,结果表明,血清D⁃二聚体、血清IMA 水平、血清LP⁃a 增高及术前肾灌注不良可增加SAAD 术后全因死亡风险,提示在临床中应注意监测SAAD 患者血清血清D⁃二聚体、血清IMA 水平、血清LP⁃a 水平,观察术前肾灌注情况,及时处理,以改善患者预后。值得注意的是,在SAAD 患者中,D⁃二聚体并不总是升高,因此,D⁃二聚体可能不能作为潜在SAAD 术后预后的的生物标志物,建议今后进一步研究SAAD 患者中D⁃二聚体浓度变化,以明确其预后预测价值。
缺血修饰白蛋白(ischemia modified albumin,IMA)在急性冠脉综合征(Acute coronary syn⁃drome,ACS)、经皮冠状动脉介入治疗(percutane⁃ous coronary intervention,PCI)术后和缺血性心肌病等缺血性疾病或者手术中均可见。IMA 因局部血流减少促使该区域内ROS 活化,ROS 可对白蛋白的N 端部分进行修饰,导致IMA 大量生成,因此血清中IMA 水平的改变可作为预测缺血性损伤的标志物[9]。Manini 等[10]研究证明,以75 U/mL作为IMA 血清水平的临界值时,IMA 预测心脏不良事件的敏感性为80%;进一步研究发现,将IMA 联合肌钙蛋白I(Troponin I,TnI)共同预测心脏不良事件,其敏感性提升,说明两者联合预测比单独检测IMA 在预测心脏不良事件中的意义更大。Lp⁃a 是一种特殊脂蛋白,由肝脏合成,但Lp⁃a 在体内的浓度保持在一定范围不变化,且不受吸烟、脂代谢、年龄、糖代谢等因素的影响[11⁃12]。目前大量研究表明,冠心病与Lp⁃a 存在一定的相关性,其浓度的升高可促使冠状动脉粥样硬化,因此Lp⁃a 能用于预测急性心肌梗死,同时其被列为冠心病的一个独立危险因素[13⁃14]。近年研究[15]发现,SAAD 患者血清脂蛋白⁃a 水平明显增高,提示脂蛋白⁃a 与SAAD发生可能相关。本研究结果显示,血清IMA 诊断SAAD 术后发生全因死亡的灵敏度为61.32%,特异性84.51%;血清LP⁃a 水平诊断SAAD 术后发生全因死亡的灵敏度为62.35%,特异性82.17%。两者联合诊断SAAD 术后发生全因死亡的灵敏度为86.74%,特异性80.02%。AUC 值越接近于1,指标诊断准确性越高。本研究血清IMA、LP⁃a 水平诊断SAAD 术后发生全因死亡的AUC 均>0.74,说明此两项指标及联合诊断在评价SAAD 术后发生全因死亡时均有较高准确性。
综上所述,血清IMA、LP⁃a 水平升高与SAAD患者术后死亡具有明显正相关性,今后考虑可将其作为预后的独立预测标志物。
